Vue d’ensemble générale
Une grande fraction des micro-organismes ne réside pas seulement en nous mais vit également sur nous. En effet, la peau humaine abrite un mélange hétérogène de bactéries, de champignons et de virus, pour la plupart non pathogènes, qui contribuent probablement à la santé de la surface cutanée (figure 1). Propionibacterium acnes (P. acnes) est un anaérobie Gram positif omniprésent, à croissance lente, en forme de bâtonnet et ne formant pas de pores (figure 2), que l’on trouve sur tous les sites corporels, y compris les follicules sébacés du visage et du cou (Funke et al., 1997 ; Grice et Segre, 2011 ; Findley et Grice, 2014). Il est souvent considéré comme faisant partie de notre microbiote commensal aux sites de barrière (Cogen et al., 2008) qui est établi via des mécanismes de tolérance immunitaire adaptative pendant la période précoce du nouveau-né (Scharschmidt et al., 2015). Bien que la distribution topographique de l’anaérobe dans les sites sébacés soit importante, la distribution spatiale et personnelle de P. acnes est plus spécifique à l’individu qu’au site (Oh et al., 2014). En outre, la biogéographie et l’individualité de P. acnes sont très dynamiques, car les changements de santé ou les modifications du pH, de la température, de l’humidité et/ou de la teneur en sébum peuvent également affecter l’éventail des niches occupées par le micro-organisme (Grice et al., 2009). Tout comme la distribution des microbes cutanés, les conditions de la peau peuvent également façonner la fonction de P. acnes en termes d’expansion des agents pathogènes dans les maladies. Par exemple, P. acnes a été associé à des agressions cutanées telles que l’acné vulgaire sur le visage et le cou, et l’hypermélanose maculaire progressive sur le dos (Bojar et Holland, 2004 ; Kurokawa et al., 2009 ; Barnard et al., 2016). En outre, certains phylotypes de P. acnes associés à des maladies ont la capacité de persister sur les implants corporels et les dispositifs chirurgicaux, provoquant un large éventail d’états infectieux postopératoires, tels que l’endocardite, l’endophtalmie et les infections intravasculaires du système nerveux (Perry et Lambert, 2011 ; Portillo et al., 2013). Les caractéristiques fâcheuses de P. acnes s’étendent également à la prostate, où l’invasion tissulaire et le dépôt intracellulaire de la bactérie ont été fréquemment observés dans les cellules épithéliales glandulaires et les macrophages circulants ; un phénomène qui contribuerait indirectement à l’hyperplasie bénigne de la prostate (HBP) et au cancer de la prostate (Tanabe et al, 2006 ; Alexeyev et al., 2007 ; Fassi-Fehri et al., 2011 ; Mak et al., 2012 ; Bae et al., 2014 ; Davidsson et al., 2016). Cependant, on ne sait pas exactement quels sont les mécanismes sous-jacents utilisés par P. acnes pour induire une infection, une inflammation et/ou des métastases en dehors de la peau. Ce que l’on sait avec une certaine certitude, c’est que les kératinocytes, sébocytes et/ou adipocytes infectés par des bactéries sécrètent plusieurs chimiokines et cytokines pro-inflammatoires ainsi que des facteurs antimicrobiens (ex, cathelicidin) laissant entrevoir des mécanismes pathologiques spécifiques (Graham et al., 2004 ; Nagy et al., 2006 ; Lee et al., 2010 ; Zhou et al., 2015 ; Sanford et al., 2016 ; Yu et al., 2016).
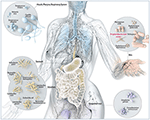
Figure 1. Illustration schématique des microbes courants présents sur les sites de barrière chez l’homme, y compris P. acnes. Bien que P. acnes soit présent sur toutes les surfaces externes et internes (c’est-à-dire les épithéliums buccal et gastro-intestinal, la conjonctive), il est plus répandu sur la peau humaine. Il réside dans les follicules pileux du visage et du dos, où il est associé à l’acné vulgaire, une maladie de peau courante. Pour la plupart, P acnes est encore considéré comme un micro-organisme bénin et commensal, mais les rapports sur son côté opportuniste malveillant sont de plus en plus nombreux. Adapté et avec l’aimable autorisation de Bryan Christie Design (http://bryanchristiedesign.com/).
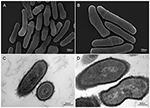
Figure 2. Images par microscopie électronique à balayage et à transmission (MEB et MET) de la souche KPA de P. acnes (A, B = MEB ; C, D = MET). Les progrès récents des techniques d’isolement et de culture révèlent que les infections à P. acnes ont été largement sous-estimées, ce qui jette une nouvelle lumière sur cette espèce bactérienne opportuniste. Microscopie de Volker Brinkmann, Institut Max Planck pour la biologie des infections, Berlin, Allemagne. Barre d’échelle = 200/300nm.
Sarcoïdose
La sarcoïdose est une maladie d’étiologie inconnue qui entraîne une inflammation dans des organes aussi divers que les poumons, le foie, la peau et les lymphatiques. Un lien putatif de la sarcoïdose avec P. acnes a été proposé pour la première fois lorsque la bactérie a été isolée de lésions sarcoïdales de la peau et des ganglions lymphatiques (Eishi et al., 2002 ; Yamada et al., 2002). Ces résultats ont été largement corroborés (de Brouwer et al., 2015), et approfondis par diverses expériences in vitro démontrant la capacité d’invasion de P. acnes dans les lignées cellulaires HEK293T (rein embryonnaire humain) et A549 (carcinome épithélial alvéolaire humain) (Tanabe et al., 2006). Des travaux plus récents sur le liquide et les cellules de lavage broncho-alvéolaire (LBA) sarcoïdes ont montré une importante régulation à la hausse d’une réponse immunitaire spécifique de P. acnes (Schupp et al., 2015). En outre, des expériences sur des souris ont montré que P. acnes viable peut induire des granulomes pulmonaires similaires à ceux observés chez les patients atteints de sarcoïdose (Werner et al., 2017). Un aperçu général détaillant le lien entre la sarcoïdose et P. acnes est par ailleurs donné par Eishi (2013).
Des études tentant de caractériser les voies de signalisation activées par P. acnes au cours de l’infection ont montré que le facteur nucléaire kappaB , un facteur de transcription qui régule l’expression des gènes impliqués dans les cascades immunitaires et inflammatoires est activé par P. acnes (Kim et al., 2002). Plus largement, le récepteur TLR2 (toll-like receptor 2) s’est révélé être un récepteur critique pour la réponse NF-κB-dépendante à P. acnes, révélant la capacité de cette bactérie à provoquer l’activation sélective des gènes de l’immunité innée (Inohara et Nuñez, 2001 ; Chamaillard et al., 2003 ; Moreira et Zamboni, 2012). En outre, le rôle de la génétique de l’hôte a été examiné dans les cas de sarcoïdose qui étaient associés à une infection par P. acnes. Des polymorphismes mononucléotidiques (SNP) dans le domaine d’oligomérisation de liaison aux nucléotides (NOD) des protéines NOD1 et NOD2 ont été corrélés à l’infection par P. acnes chez 73 patients atteints de sarcoïdose avec 52 pneumonies interstitielles et 215 témoins sains (Tanabe et al., 2006). NOD1 et NOD2 sont des récepteurs intracellulaires de reconnaissance des formes qui peuvent détecter des molécules bactériennes telles que les fragments de peptidoglycane. Dans le même ordre d’idées, des expériences in vitro ont montré que l’internalisation de P. acnes dans des cellules HEK293T peut entraîner l’activation de NOD1 et NOD2, ce qui suggère un mécanisme pathologique basé sur une inflammation chronique ou une immunosuppression locale (Tanabe et al., 2006). Ces résultats suggèrent également que les P. acnes invasifs peuvent agir comme des ligands bactériens pour provoquer une activation aberrante des récepteurs NOD chez certains individus présentant une susceptibilité durable à la sarcoïdose. Cependant, de futures expériences doivent clarifier la chronologie mécaniste exacte de si ou comment l’activation aberrante de NF-κB médiée par P. acnes peut induire la formation de granulomes d’une manière dépendante de NOD1/NOD2.
Bien que P. acnes invasif puisse être une étiologie possible de la sarcoïdose et peut-être d’autres maladies, l’élucidation de la causalité et de la corrélation entre P. acnes et la pathologie est trouble car l’hétérogénéité de la souche bactérienne, la génétique de l’hôte ainsi que les environnements de l’hôte doivent être pris en compte chaque fois qu’une étude relie un microbiome à un état pathologique.
Hyperplasie bénigne de la prostate (HBP) et cancer de la prostate
Les processus inflammatoires chroniques ou récurrents ont longtemps été impliqués dans la progression de l’HBP et du cancer de la prostate (De Marzo et al…, 1999 ; Nelson et al., 2004 ; Sfanos et al., 2014). L’inflammation est attribuée à la présence de biomarqueurs spécifiques tels qu’une élévation de l’interleukine (IL)-6, du facteur de nécrose tumorale alpha (TNFα) et de la protéine de phase aiguë, la protéine C réactive (Mechergui et al., 2009 ; Menschikowski et al., 2013 ; Yu et al., 2015). Des travaux récents sur les fluides urologiques (c’est-à-dire l’urine, le liquide séminal, les sécrétions prostatiques) ainsi que sur les biopsies de la prostate suggèrent un changement conditionnel significatif vers certaines espèces microbiennes qui peuvent être utilisées comme un indice diagnostique (Yu et al., 2015 ; Ni et al, 2016).
De nombreux travaux suggèrent que l’association spécifique de P. acnes avec la prostate et l’invasion des cellules épithéliales de la prostate en particulier (Figure 3) pourrait contribuer à la pathologie de l’HBP ou du cancer de la prostate avec une composante inflammatoire (Sfanos et al., 2013 ; Davidsson et al., 2016). Cependant, il n’est actuellement pas clair si P. acnes représente un véritable agent infectieux de la prostate, un commensal ou un microbion prostatique accidentel. Il est plausible que les P. acnes localisés dans la prostate soient des dérivés de la peau introduits accidentellement, par exemple lors d’une biopsie de la prostate – un point de vue qui devrait susciter des inquiétudes avec certains scénarios de bilan diagnostique.
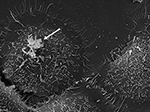
Figure 3. SEM de la souche P6 de P. acnes (flèche) in vitro sur des cellules épithéliales prostatiques cultivées RWPE1. Le comportement invasif des cellules épithéliales de la prostate de P. acnes est bien documenté dans les études in vivo et cellulaires où un processus d’invasion médié par la vimentine semble probable (Mak et al., 2012). Microscopie de Volker Brinkmann, Institut Max Planck pour la biologie des infections, Berlin, Allemagne. Barre d’échelle = 2 μm.
Quoi qu’il en soit de la voie d’entrée ou du potentiel pathogène, un nombre important de tissus prostatiques obtenus par résection transurétrale pour l’HBP, ou par prostatectomie radicale pour le cancer, ont été précédemment testés positifs pour des agrégats de P. acnes résidant apparemment dans des macrophages itinérants (Alexeyev et al., 2007 ; Bae et al., 2014). D’autres rapports basés sur des échantillons humains ont fourni d’autres preuves d’un lien entre l’HBP ou le cancer de la prostate et P. acnes en utilisant diverses approches techniques, notamment la culture, la microscopie confocale pour la visualisation de la bactérie et l’hybridation in situ, l’immunohistochimie (figure 4) et le profilage de l’ARNr 16S bactérien par PCR (Hochreiter et al., 2000 ; Cohen et al., 2005 ; Sfanos et al., 2008 ; Fassi-Fehri et al., 2011 ; Bae et al., 2014 ; Davidsson et al., 2016). D’autres preuves proviennent d’études animales indiquant que l’inoculation de P. acnes dans la prostate et la vessie de murins ou de rats entraîne une réponse inflammatoire manifeste à long terme et un large éventail de perturbations cellulaires au sein de la prostate (Olsson et al., 2012 ; Shinohara et al., 2013).
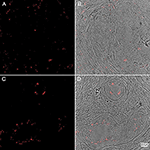
Figure 4. Immunohistochimie d’échantillons de tissu prostatique humain coloré avec l’anticorps P. acnes (rouge). Adapté avec la permission de Fassi-Fehri et al., 2011 (figure supplémentaire 2B). Présence de P. acnes dans des échantillons de tissu prostatique humain présentant une hyperplasie bénigne de la prostate (A, B) ou un adénocarcinome (C, D). Une charge bactérienne étendue a été détectée dans les deux cas.
Les tentatives d’analyse phylogénétique des souches de P. acnes associées à la maladie provenant de glandes prostatiques cancéreuses ont révélé que la plupart des isolats prostatiques appartiennent à des clades phylogénétiques qui sont rares sur la peau humaine, ce qui indique qu’une contamination dérivée de la peau pendant le prélèvement est peu probable (Mak et al., 2013 ; Davidsson et al., 2016). Dans le même ordre d’idées, des voies inflammatoires similaires à celles décrites pour la sarcoïdose, notamment NF-κB, IL-6, STAT3 et COX2, semblent être activées par P. acnes à la fois dans des conditions in situ et in vitro (Drott et al., 2010 ; Fassi-Fehri et al., 2011 ; Mak et al., 2013 ; Tsai et al., 2013 ; Bae et al., 2014). Bien que l’étiologie précise de ces changements inflammatoires ne soit pas encore claire, plusieurs récepteurs membranaires de reconnaissance des formes sont largement distribués dans les systèmes urinaire et génital des mammifères et reconnaissent avidement les composants bactériens et viraux (Jorgensen et Seed, 2012 ; Gambara et al., 2013). Ces récepteurs des cellules hôtes, par exemple les TLR, favorisent la production de cytokines, qui est une caractéristique essentielle de l’immunité innée contre les agents pathogènes microbiens. Collectivement, ces résultats suggèrent que par leur capacité à déclencher divers aspects de l’immunité, les P. acnes envahissants peuvent agir comme conducteur primaire et/ou amplificateur de la gravité de la maladie.
Spondylodiscite et douleurs dorsales
L’une des plusieurs complications post-opératoires impliquant P. acnes est l’inflammation du disque intervertébral et de l’espace intervertébral environnant (discite) après une discectomie (Harris et al., 2005). L’infection dégénérative concomitante des vertèbres adjacentes (spondylodiscite) peut être une caractéristique commune et la cause première de graves dommages neurologiques et de douleurs si le traitement est retardé (Uçkay et al., 2010). Outre l’introduction chirurgicale involontaire directement dans la colonne vertébrale, les agents pathogènes peuvent également arriver par l’intermédiaire de l’approvisionnement en sang artériel et veineux de la colonne vertébrale (propagation hématogène). Si Staphylococcus aureus, Escherichia coli et Proteus sont les plus fréquemment isolés, P. acnes est l’agent pathogène anaérobie le plus abondant dans ce contexte et probablement sous-déclaré en raison des difficultés de culture. Certaines données cliniques indiquent que les patients présentant une hernie discale nucléaire (nucleus pulposus) infectée par des pathogènes anaérobies en général, et par P. acnes en particulier, sont plus susceptibles de développer une inflammation et un œdème des vertèbres adjacentes (changements de Modic de type I) et des douleurs dorsales (Albert et al., 2013 ; Urquhart et al., 2015). Des suivis cliniques et animaux corroborent aujourd’hui les premiers résultats montrant que la prolifération locale de P. acnes entraîne une régulation ascendante des marqueurs inflammatoires et une dégénérescence du disque cohérente avec les changements de Modic (Aghazadeh et al., 2016 ; Dudli et al., 2016). Il y a même maintenant les premières preuves cliniques qui suggèrent que l’infection bactérienne du disque intervertébral par P. acnes et/ou Staphylococcus epidermidis peut en fait précéder tous les autres problèmes comme la cause profonde de la hernie discale et des changements pathologiques associés (Rajasekaran et al…, 2017).
Maladie de Parkinson (MP)
Le cerveau en dégénérescence est caractérisé par des dommages au système neuronal qui peuvent être attribués à l’agrégation atypique et au dépôt de protéines mutantes ou mal repliées (par exemple, les corps de Lewy et les neurites de Lewy), comme cela est clairement documenté dans la MP idiopathique (Taylor et al., 2002). Ce que l’on ignore généralement, c’est que le cerveau est également susceptible d’être envahi par des agents pathogènes allant des virus et des bactéries aux champignons. Ces agents pathogènes, ou plus précisément leurs composants endogènes et/ou leurs métabolites, peuvent produire des déficits neurologiques centraux allant de signes subtils de démence et de dystonie, qui résultent d’une infection chronique et récurrente (De Chiara et al., 2012 ; Bibi et al., 2014), à des maladies plus graves des motoneurones, comme celles observées par exemple avec le rétrovirus endogène humain K (Li et al., 2015). Ainsi, il est clair que les humains ont une charge systémique de microbes extrêmement lourde (Potgieter et al., 2015 ; Spadoni et al., 2015) qui peut accessoirement contribuer à la pathologie des maladies neurodégénératives progressives à composante protéique atypique. Cette hypothèse de travail bénéficie certainement d’un soutien considérable, car le comportement cognitif, émotionnel ou pathologique semble être indirectement affecté par la distribution spatiale et personnelle des microbes agissant par l’intermédiaire de l’axe intestin-cerveau (Figure 5) (Collins et al., 2012 ; Dinan et al., 2013 ; Mayer et al., 2014 ; Burokas et al., 2015). En effet, une récente étude cas-témoins a démontré que la variation microbienne dans le tractus gastro-intestinal, à la fois entre et au sein des individus ; correspond le plus significativement aux variations phénotypiques de la MP (Scheperjans et al., 2015 ; Vizcarra et al., 2015). Bien que les mécanismes sous-jacents reliant la composition du microbiote aux différences dans la MP ne soient pas clairs, la constatation ci-dessus pourrait au moins expliquer la prévalence élevée des anomalies gastro-intestinales observées chez les patients atteints de MP (Dobbs et al., 2016). En établissant un autre lien entre le microbiote et la gravité de la MP, les biopsies de la muqueuse sigmoïde et le matériel fécal prélevé chez les patients atteints de MP ont révélé la présence d’espèces bactériennes opportunistes et pro-inflammatoires qui causent souvent la constipation chronique, le syndrome du côlon irritable et la colite ulcéreuse (Keshavarzian et al., 2015). Collectivement, ces premiers résultats suggèrent que les relations entre les différentes communautés microbiennes dans l’intestin sont une comorbidité commune dans la MP, et que les signatures individuelles uniques de l’écosystème intestinal peuvent renforcer les déficiences motrices classiques de la MP.
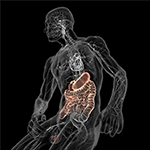
Figure 5. Illustration schématique de l’axe intestin-cerveau (en couleur) avec le système digestif rempli de microbes à une extrémité et le cerveau avec ses centres d’homéostasie (hypothalamus et hypophyse) à l’autre. Les deux sont reliés par le système nerveux cardiovasculaire et autonome, y compris le nerf vague (nerf crânien X) qui pourrait faciliter la transition microbienne vers le système nerveux central (SNC). Avec l’aimable autorisation de Bryan Christie Design (http://bryanchristiedesign.com/).
Dans ce contexte, la question à poser est de savoir s’il existe des preuves que P. acnes joue un rôle quelconque dans la physiopathologie de la MP. Pour que cette possibilité existe, deux conditions doivent être réunies : (1) l’infection par P. acnes doit précéder l’apparition des symptômes classiques de la maladie tels que les tremblements, l’initiation motrice et la lenteur des mouvements ; et (2) l’inoculation de P. acnes doit suffisamment induire les symptômes de la MP et/ou entraîner la perte des neurones de projection de la dopamine dans le noyau du mésencéphale appelé substantia nigra pars compacta. Jusqu’à présent, notre laboratoire a détecté des grappes de P. acnes localisées dans les neurones du mésencéphale et dans les structures corticales voisines de cerveaux autopsiés atteints de la maladie de Parkinson (figure 6). Cette découverte inattendue ajoute de la crédibilité au fait que P. acnes contribue indirectement à des épisodes locaux d’inflammation similaires à ceux observés dans la sarcoïdose et l’HBP. Une question ouverte est de savoir dans quelle mesure P. acnes peut indirectement renforcer certaines caractéristiques pathologiques de la maladie de Parkinson. Comme la MP est un trouble très hétérogène, il est peu probable qu’un seul mécanisme pathologique s’applique à tous les phénotypes de la MP. Néanmoins, il est intriguant de spéculer que les microbes cutanés résidents pourraient initier ou amplifier la progression de la MP par le biais de facteurs inflammatoires et/ou de prédisposition génétique.

Figure 6. Immunohistochimie d’échantillons de tissus de cerveau moyen PD humain colorés pour P. acnes (vert ; A+B), les microtubules neuronaux (MAP2 ; rouge ; A) et les noyaux (DAPI ; bleu ; A+B). L’auto-fluorescence de la lipofuscine liée à l’âge a été éteinte avec du noir Soudan B. Présence de P. acnes (flèche) dans l’espace périplasmique d’un neurone humain (A) entre le noyau (n) et le cytosquelette ; ou neutrophile (B) avec son noyau multilobé caractéristique à l’intérieur d’un capillaire du mésencéphale (Cap). Ces observations sont typiques de la MP et absentes dans la plupart des sections témoins. Les mouvements rétrogrades le long des nerfs crâniens, les micro-saignements induits par un traumatisme ainsi que le système glymphatique nouvellement découvert représentent des voies microbiennes potentielles vers le SNC.
Si P. acnes peut accéder aux cellules dopaminergiques du mésencéphale, quelle est la voie d’inoculation et d’infection la plus probable ? Bien que la peau soit physiquement compartimentée par rapport au cerveau, l’inoculation croisée reste un facteur de risque. Par exemple, les narines pourraient héberger des souches pathogènes de P. acnes qui se déplaceraient ensuite vers le parenchyme cérébral pour hyperactiver les macrophages locaux appelés microglies, un phénomène qui est une caractéristique constante de la pathologie de la MP (revue par Chao et al., 2014). Les recherches sur les infections nosocomiales montrent que des espèces bactériennes aussi diverses que Pneumococcus sp. (Zwijnenburg et al., 2001) et Salmonella sp. (Bollen et al., 2008) se déplacent facilement le long du nerf olfactif (nerf crânien 1 ; CN 1) et finissent par atteindre le bulbe olfactif. Une autre voie d’entrée potentielle pour les microbes nuisibles ou les protéines mal repliées dangereuses est le nerf vague (nerf crânien 10 ; CN 10). En effet, dans certaines circonstances, des agrégats mal repliés sous forme de corps de Lewy et de neurites de Lewy semblent migrer du nerf vague vers le cerveau, ce qui constitue une preuve supplémentaire que les bactéries pathogènes, associées à des protéines toxiques, peuvent contribuer à la vulnérabilité sélective des neurones (Holmqvist et al., 2014). Il est intéressant de noter que les noyaux cérébraux des CN 1 et 10 sont parmi les premiers sites à présenter de manière préférentielle un dépôt de corps de Lewy et de neurites de Lewy au cours de la progression de la maladie de Parkinson (Braak et al., 2004). Cette observation particulière met non seulement en évidence une voie d’entrée probable des bactéries dans le cerveau, mais fournit également un mécanisme potentiel pour l’observation selon laquelle la vagotomie tronculaire diminue significativement le risque de MP (Svensson et al., 2015). Le lien entre le traumatisme crânien et la MP (Harris et al., 2013 ; Jafari et al., 2013 ; Pearce et al., 2015), ainsi que la notion de microbiome sanguin diversifié (Potgieter et al., 2015), impliquent un vaste potentiel d’opportunisme pathogène lors de brèches traumatiques dans la barrière hémato-encéphalique. Avec la découverte récente d’un système lymphatique cérébral (glymphatique) (Iliff et al., 2012 ; Hitscherich et al., 2016), une autre voie potentielle d’infection cérébrale doit être envisagée.
Ensemble, il existe des preuves précliniques et certaines preuves cliniques pour impliquer indirectement P. acnes comme une variable indépendante affectant l’incidence ou la sévérité de la MP. Ces preuves sont complétées par des rapports associant un trouble cutané grave, l’acné inversa, à la maladie d’Alzheimer (Wang et al., 2010). D’un point de vue thérapeutique, la possibilité que P. acnes entraîne ou amplifie les caractéristiques fondamentales de la MP représente une ressource importante pour les approches antibiotiques des maladies neurodégénératives. Et du point de vue de la recherche, il serait intéressant d’examiner de plus près les patients souffrant de troubles cutanés pour trouver des preuves de neuropathologie avec un début plus précoce et un phénotype de maladie plus sévère.
Perspectives futures
L’examen présenté dans cet article souligne un côté sombre inattendu de P. acnes en ce qui concerne la pathologie. La persistance intracellulaire de P. acnes est impliquée dans des maladies des poumons et de la prostate, voire du cerveau. Il s’agit d’un témoignage clair de la pathogénicité des bactéries dérivées de la peau dans certains phénotypes de maladies. Des recherches plus approfondies devront se concentrer sur plusieurs questions émergentes dans la biologie de P. acnes : (1) quelles sont les interactions cruciales de P. acnes dans la susceptibilité aux maladies ? (2) Quels sont les mécanismes utilisés par P. acnes pour influencer la progression de la maladie ? (3) Si certaines populations de P. acnes peuvent accroître la susceptibilité à la gravité de la maladie, existe-t-il d’autres configurations de P. acnes qui sont protectrices ? (4) Preuve du concept selon lequel l’infection par P. acnes est directement associée à la pathologie de la maladie, ou plus précisément, l’étude du concept montre-t-elle une causalité ou simplement une corrélation ? Et enfin (5) La pathologie due à P. acnes peut-elle être traitée par une antibiothérapie conventionnelle et des applications diagnostiques ?
Contributions des auteurs
JL, KER, JC, KR, CH, AM, HB et GT ont préparé le manuscrit. JL et MS ont préparé les figures.
Financement
Le financement intra-muros de JL a été fourni par le NYIT College of Osteopathic Medicine.
Déclaration de conflit d’intérêts
Les auteurs déclarent que la recherche a été menée en l’absence de toute relation commerciale ou financière qui pourrait être interprétée comme un conflit d’intérêts potentiel.