Dans cette série, Colin Baker de l’école de Bedford propose des démonstrations spectaculaires, conçues pour capter l’imagination de l’élève. Les démonstrations sont faciles à préparer, sûres à jeter et elles fonctionnent.
Rien ne tend à imprimer les faits chimiques dans l’esprit autant que l’exposition d’expériences intéressantes – Samuel Parkes, 1816
En septembre 1931, le chimiste américain Wallace Carothers, travaillant dans les laboratoires de DuPont, a fait état de recherches sur des molécules « géantes » appelées polymères, basées sur la compréhension de la structure chimique de la laine. Ses travaux portent sur une fibre appelée simplement « 66 », un numéro dérivé de sa structure moléculaire. En 1935, le nylon, la « fibre miracle », est né et a connu un énorme succès sur son marché initial, la bonneterie féminine. Lorsque les États-Unis entrent dans la Seconde Guerre mondiale en décembre 1941, le War Production Board affecte toute la production de nylon à un usage militaire, notamment pour les parachutes et les pneus des bombardiers B29.

Source : Colin Baker
La réaction entre le dichlorure de décanedioyle et le 1,6-diaminohexane
Un chlorure de diacide dans un solvant organique forme une couche immiscible avec une diamine aliphatique dans l’eau. A l’interface, où les deux solutions incolores se rencontrent, un polymère blanc à longue chaîne se forme. Ce film de polymère peut être tiré de l’interface et est immédiatement remplacé au fur et à mesure qu’il est retiré. Si vous arrêtez de tirer, rien ne semble se passer – la réaction s’arrête, mais elle reprend immédiatement lorsque vous recommencez à tirer. La réaction peut se produire pendant plusieurs heures.

Source : Colin Baker
Kit
- Cyclohexane, 100cm3 (irritant, hautement inflammable) ;
- Dichlorure de décanedioyle, 5.0cm3 ;
- Eau distillée, 100cm3 ;
- Carbonate de sodium anhydre, 10g ;
- 1,6-diaminohexane, 5,0g ;
- Deux béchers, 250cm3 ;
- Bécher, 5cm3 ;
- Pincettes ;
- Bâtonnets de verre.
Sécurité
Le dichlorure de décanedioyle et le 1,6-diaminohexane sont corrosifs. Ils sont nocifs en cas d’ingestion ou d’inhalation et, au contact de la peau, provoquent des brûlures. Ils sont des irritants sévères. Le cyclohexane est hautement inflammable et constitue un irritant.
Procédure
Préparez les deux solutions suivantes :
Solution A : dichlorure de décanedioyle dans le cyclohexane. Mettez 100cm3 de cyclohexane dans un bécher de 250cm3, ajoutez 5,0cm3 de dichlorure de décanedioyle et remuez pour dissoudre. Cette solution se conserve pendant environ quatre semaines.
Solution B : 1,6-diaminohexane dans du carbonate de sodium aqueux. Mettre 100cm3 d’eau distillée dans un bécher de 250cm3, ajouter 10g de carbonate de sodium anhydre et remuer pour dissoudre. Ajouter 5,0g de 1,6-diaminohexane solide et remuer pour dissoudre.
Verse 2cm3 de solution A dans un bécher de 5cm3. Ajouter avec précaution un volume égal de solution B. La solution A contient le solvant organique, est plus dense que la couche aqueuse et constitue donc la couche inférieure. Saisissez le film de polyamide (un solide blanc) qui commence à se former à l’interface de ces deux solutions avec une pince à épiler et tirez-le lentement hors du bécher. Enroulez la fibre autour d’une tige de verre et continuez à tirer. Arrêtez le processus lorsqu’un des réactifs est épuisé.
Conseils particuliers
Il faut faire attention en ajoutant la deuxième solution pour éviter le mélange. Démontrez comment la fibre peut être tirée en un fil continu, puis organisez un concours pour voir quelle paire d’élèves peut produire la plus longue fibre. Ils devraient être capables de produire jusqu’à 5 m avant que la fibre ne se casse. Ils se rendent rapidement compte qu’ils ont besoin d’aide pour soutenir la fibre – je divise la classe en deux grands groupes, chacun armé de tiges de verre. Mes élèves ont produit des fibres de plus de 30 m, en essayant même de contourner les coins. Vous devrez limiter le volume maximum de chaque solution à 10cm3. Les élèves doivent porter des gants et éviter tout contact avec la fibre. Si la fibre se casse, elle doit être enveloppée dans du papier absorbant. Tout déversement doit être épongé avec du papier absorbant et mis à la poubelle.
Objectifs pédagogiques
Les polyamides sont des polymères dont les unités répétitives sont maintenues ensemble par des liaisons amides, -CO-NH-.
Nylon-6,10
Le nylon-6,10 est fabriqué à partir de deux monomères, l’un contient six atomes de carbone, l’autre 10 – d’où son nom. Le monomère à 10 atomes de carbone est le dichlorure de décanedioyle (ClOC(CH2)8 COCl), un chlorure d’acide avec un groupe -COCl à chaque extrémité. L’autre monomère est une chaîne à six atomes de carbone avec un groupe amino, -NH2, à chaque extrémité. Il s’agit du 1,6-diaminohexane (H2 N(CH2)6 NH2, également connu sous le nom d’hexane-1,6-diamine).
Lorsque ces deux composés se polymérisent, les groupes amine et acide se combinent, avec à chaque fois la perte d’une molécule de chlorure d’hydrogène :
n ClOC-(CH2)8-COCl + n H2N-(CH2)6-NH2 → -(CO-(CH2)8-CONH-(CH2)6-NH)n – + n HCl
Ce processus de formation de polymères impliquant la perte d’une petite molécule est appelé polymérisation par condensation.
Nylon-6,6
Ce polymère est obtenu par condensation de deux molécules à six carbones, l’acide hexanedioïque et le 1,6-diaminohexane. Dans l’industrie, le cyclohexane est utilisé pour fabriquer les deux monomères. Si le cyclohexane est oxydé, le cycle s’ouvre et les deux extrémités de la chaîne portent un groupe acide – l’acide hexanedioïque est formé. Si cet acide est neutralisé avec de l’ammoniac, on obtient le sel de diammonium (NH4 OOCCH2 CH2 CH2 COONH4) qui peut être déshydraté (par chauffage à 350°C) et réduit (à l’aide de H2/Ni) en 1,6-diaminohexane. Une polymérisation par condensation du diacide et de la diamine se produit avec une perte d’eau :
n HOOC-(CH2)4 -COOH + n H2 N-(CH2)6 -NH2 → -(CO-(CH2)4 -CONH-(CH2)6 -NH)n – + n H2 O
Nylon-6
Il est possible de fabriquer du nylon à partir du monomère unique caprolactame (hexahydro-2H-azépine-2-one, 1).
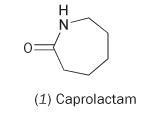
Le caprolactame contient une liaison amide interne. La polymérisation de cette molécule entraîne l’ouverture du cycle et sa jonction pour former une chaîne continue :
-(NH-(CH2)5 -CONH-(CH2)5 -CONH-(CH2)5 -CO)n –
Le nylon a révolutionné l’industrie textile et a été le précurseur de nombreuses fibres modernes et synthétiques actuelles. Il reste un matériau important et largement utilisé dans la fabrication.