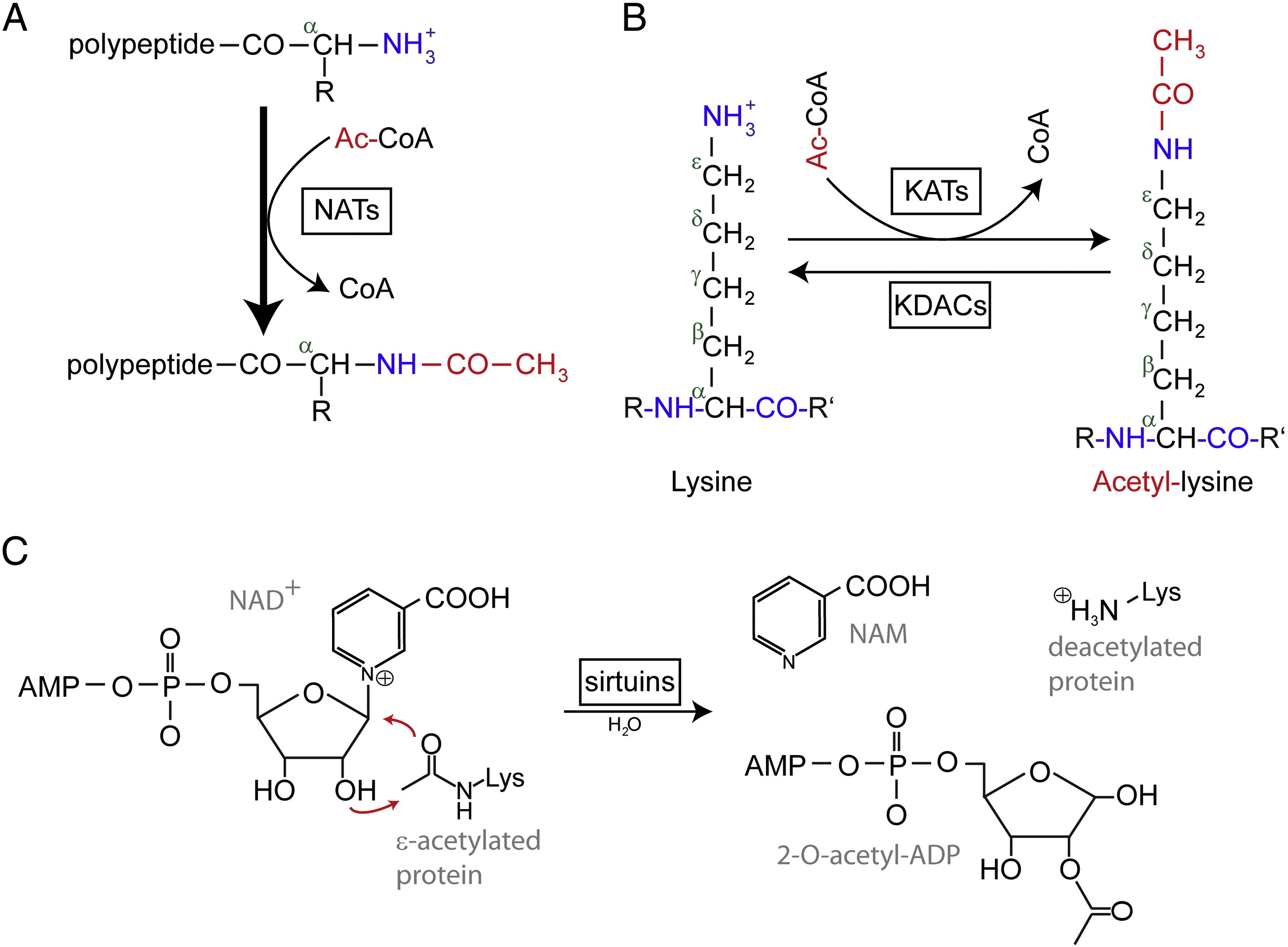
L’acétylation désigne une réaction qui introduit un groupe fonctionnel acétyle dans un composé chimique, dans laquelle l’atome d’hydrogène d’un groupe hydroxyle est remplacé par un groupe acétyle (CH3 CO) pour donner un ester spécifique, l’acétate. L’acétylation des protéines revêt couramment deux formes différentes. Chez l’homme, la quasi-totalité (80 % à 90 %) des protéines sont acétylées de manière co-traductionnelle à leur extrémité Nα des chaînes polypeptidiques naissantes. Un autre type est typiquement acétylé sur les résidus lysine.
Acétylation N-terminale
L’acétylation N-terminale (Nt) est catalysée par des Nt-acétyltransférases (NATs) et s’avère jusqu’à présent irréversible. Les NATs, enzymes mono- ou multisubstances constituées d’une sous-unité catalytique et de jusqu’à deux sous-unités auxiliaires, peuvent transférer un groupe acétyle de l’acétyl-coenzyme A (Ac-CoA) au groupe α-amino du premier résidu d’acide aminé de la protéine. Dans les TAN, la sous-unité auxiliaire majeure module l’activité et la spécificité du substrat de la sous-unité catalytique. Différents TAN sont responsables de l’acétylation des Nt. Chez l’homme, six TAN ont été découverts jusqu’à présent, dont NatA, NatB, NatC, NatD, NatE et NatF. En plus de la différence de composition des sous-unités, les divers NATs varient dans leurs spécificités de substrat.
L’acétylation de Nt joue différents rôles dans les effets moléculaires. Tout d’abord, la Nt-acétylation détermine la localisation subcellulaire pour certaines protéines. Par exemple, Arl3 et Grh1, deux protéines associées au Golgi, ne peuvent pas s’associer à l’appareil du Golgi lorsqu’il manque le groupe Nt-acétyle. Deuxièmement, il est rapporté que la Nt-acétylation retient les protéines dans le cytosol et inhibe une migration de translocation post-traductionnelle vers le réticulum endoplasmique (RE) et la voie sécrétoire. En outre, l’acétylation de Nt peut altérer les propriétés de l’extrémité N-terminale pour que les interactions protéine-protéine soient modulées. Il a été démontré pour plusieurs protéines que l’affinité avec leurs partenaires de liaison augmentait après avoir été Nt-acétylées. Par exemple, l’enzyme de conjugaison de l’ubiquitine E2 Ubc12 subit une Nt-acétylation par NatC permettant une affinité accrue envers son partenaire d’interaction, l’ubiquitine ligase E3 Dcn1. De plus, la Nt-acétylation contrôle la qualité et la durée de vie des protéines, et régule la stœchiométrie des protéines par la voie de la règle N-end.
L’acétylation N-terminale a de nombreuses fonctions en physiologie. Les NATs sont essentiels au développement normal, au développement des os et des vaisseaux sanguins. L’acétylation N-terminale peut réguler la pression sanguine, la localisation du protéasome, les hormones, ainsi que la structure et la fonction des organelles. Dans les maladies humaines, elle est liée aux maladies neurodégénératives (comme la maladie d’Alzheimer, la maladie de Parkinson et la démence à corps de Lewy) et au cancer (comme le cancer du poumon, le cancer du sein, le cancer colorectal).
L’acétylation de la lysine
Les résidus lysine acétylés ont été découverts pour la première fois dans les histones régulant la transcription des gènes. Mais l’acétylation de la lysine ne se limite pas aux histones. Contrairement à l’acétylation des Nt, l’acétylation des lysines est réversible. L’acétylation est catalysée par les lysine acétyltransférases (KATs) et la désacétylation des résidus lysine est catalysée par les lysine désacétylases (KDACs).
Il est rapporté que 17-22 gènes KATs ont été identifiés dans le génome humain (Le nombre exact de KATs est controversé), qui peuvent être classés en trois familles différentes, y compris la famille GCN5 (general control non-derepressible 5)-related acetyltransferase (GNAT), la famille MYST, et la famille p300/CBP (CREB-binding protein). Les substrats connus des complexes KAT ne comprennent pas seulement des protéines d’histone, mais aussi différents facteurs de transcription, des corégulateurs transcriptionnels et certaines protéines de voies de signalisation cellulaire spécifiques comme p53, β-caténine, NF-κB, MyoD ou Rb. Et même certaines molécules d’ARN peuvent être acétylées. Il existe quatre types différents de KDAC, à savoir les classes I, II, III et IV. Les classes I, II et IV sont des amidohydrolases Zn2 +-dépendantes, tandis que la classe III (également appelée sirtuines) utilise le NAD+ comme co-substrat pour son activité catalytique sont des amidohydrolases Zn2 +-dépendantes.
Les histones sont les premières protéines acétylées découvertes. Les molécules d’histones sont modifiées par différents PTM, y compris la phosphorylation, la méthylation et l’acétylation. L’acétylation des histones, détermine l’assemblage des histones ainsi que le repliement et la compacité de l’interaction ADN-histone et présente donc un commutateur entre la structure permissive et répressive de la chromatine. En plus des histones, les KATs peuvent catalyser les protéines du cytosquelette. Il y a quelques nouveaux sites d’acétylation identifiés dans d’autres protéines, y compris les protéines HMG, c-Myc, les récepteurs d’œstrogène et d’androgène, E2F/Rb et ainsi de suite.
Les rôles physiologiques de l’acétylation de la lysine ont été rapportés. Les protéines histones sont associées à une régulation étroite de pratiquement tous les types de processus liés à l’ADN comme la transcription, la réplication, la recombinaison, la réparation, ainsi que la traduction et la formation de structures chromatiniennes spécialisées. Par conséquent, l’acétylation de la lysine des protéines affecte une gamme de voies de signalisation cellulaire ainsi que le métabolisme, les réponses au stress, l’apoptose et le trafic membranaire.
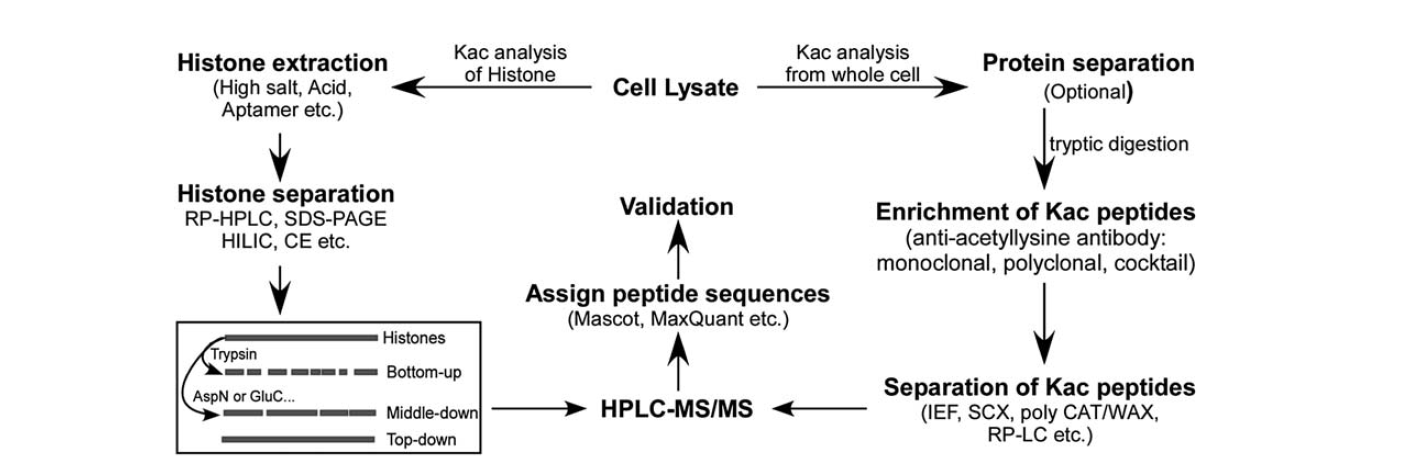
Il existe relativement moins d’outils disponibles pour identifier l’acétylation de la lysine. Avec le développement de la spectrométrie de masse, elle a été un outil important pour l’identification et la quantification de l’acétylation de la lysine. L’analyse de l’acétylation de la lysine des histones se fait en plusieurs étapes : lysat cellulaire, extraction des histones, séparation des histones, spectrométrie de masse et analyse des données. Les étapes d’analyse pour l’acétylation de la lysine des protéines à partir de la cellule entière comprennent le lysat cellulaire, la séparation des protéines, l’enrichissement des peptides d’acétylation de la lysine, la séparation des peptides d’acétylation de la lysine, la spectrométrie de masse et l’analyse des données.