D’abord, affinons les bases des fondamentaux de la cytométrie en flux
Qu’est-ce que la cytométrie en flux ?
La cytométrie en flux est une technique utilisée pour détecter et mesurer les caractéristiques physiques et chimiques d’une population de cellules ou de particules. Dans ce procédé, un échantillon contenant des cellules ou des particules est mis en suspension dans un fluide et injecté dans l’instrument de cytométrie en flux.
Quel est le but de la cytométrie en flux ?
La cytométrie en flux fournit une méthode bien établie pour identifier les cellules en solution et est le plus souvent utilisée pour évaluer le sang périphérique, la moelle osseuse et d’autres fluides corporels. Les études de cytométrie en flux sont utilisées pour identifier et quantifier les cellules immunitaires et caractériser les hémopathies malignes.Elles permettent de mesurer :
- la taille des cellules
- la granularité des cellules
- l’ADN total
- les nouvelles synthèses
- l’expression génique de l’ADN
- les récepteurs de surface
- les protéines intracellulaires. protéines
- signal transitoire
La possibilité d’effectuer ces mesures dans un laps de temps très rapide est l’un des principaux avantages du procédé de cytométrie en flux. Ils peuvent quantifier jusqu’à trois à six propriétés ou composants sont quantifiés dans un seul échantillon, cellule par cellule, pour environ 10 000 cellules, en moins d’une minute.
Instrumentation et méthodologie de la cytométrie en flux
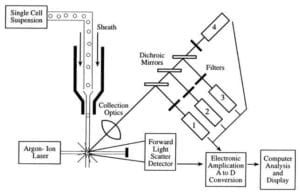 Les cytomètres en flux prennent une suspension de cellules uniques monodispersées et non agglutinées et les font passer une à la fois (file unique) devant un faisceau laser où chaque cellule traverse le faisceau laser, la lumière diffusée et fluorescente et sont ensuite comptées et triées ou caractérisées davantage.
Les cytomètres en flux prennent une suspension de cellules uniques monodispersées et non agglutinées et les font passer une à la fois (file unique) devant un faisceau laser où chaque cellule traverse le faisceau laser, la lumière diffusée et fluorescente et sont ensuite comptées et triées ou caractérisées davantage.
Les trois principaux composants d’un cytomètre en flux sont la fluidique, l’optique et l’électronique.
- Le système fluidique d’un cytomètre en flux est responsable du transport des échantillons du tube d’échantillon à la cellule en flux, devant le laser, triés et/ou jetés.
- Les composants du système optique comprennent les sources de lumière d’excitation, les lentilles et les filtres optiques utilisés pour collecter et déplacer les longueurs d’onde de la lumière autour de l’instrument et le système de détection qui génère le photocourant. La différence de réponse en longueur d’onde dans les données aide à analyser le type de cellule.
- L’électronique ou l’instrumentation du cytomètre en flux.
L’un des grands principes de l’utilisation de la cytométrie en flux est la capacité d’analyser le cycle cellulaire complet et d’analyser le contenu en ADN dans différentes phases. Le suivi des événements naturels du cycle cellulaire peut fournir des informations pour le diagnostic des maladies et le pronostic des thérapies. Les différentes phases du cycle cellulaire peuvent révéler une altération du contenu de l’ADN et d’autres anomalies indiquant la présence d’une tumeur ou des signes de mort cellulaire avancée. Les expressions de données sont stockées dans un ordinateur via un logiciel spécialisé de cytométrie en flux associé à l’utilisation de l’instrument choisi au moment de l’analyse. Les données de cytométrie en flux sont typiquement rapportées de deux manières distinctes : un histogramme et/ou un graphique en points2.
| phase G1: | L’ARN, les ribosomes et les protéines sont synthétisés |
| phase S: | L’ADN est répliqué |
| phase G2 : | Représente la phase entre la synthèse de l’ADN et la mitose |
| phase M: | Les cellules sont divisées en deux cellules filles |
FACS
Le tri cellulaire activé par fluorescence (FACS) est un type spécialisé de cytométrie en flux. Il fournit une méthode pour trier un mélange hétérogène de cellules biologiques dans deux ou plusieurs récipients, une cellule à la fois, sur la base des caractéristiques spécifiques de diffusion de la lumière et de fluorescence de chaque cellule. Elle diffère de la cytométrie de flux en ce sens qu’elle fournit une caractérisation unique par rapport au simple comptage et au tri des cellules. Il est courant que les deux principes fonctionnent dans un processus de type co-caractérisation pour offrir une approche qualitative et quantitative complète de l’analyse cytométrique en flux.
Le processus de cytométrie en flux :
La suspension cellulaire est entraînée au centre d’un flux étroit et rapide de liquide. L’écoulement est disposé de façon à ce qu’il y ait une grande séparation entre les cellules par rapport à leur diamètre. Un mécanisme vibrant force le flux de cellules à se briser en gouttelettes individuelles. Le système est réglé de manière à ce qu’il y ait une faible probabilité que plus d’une cellule par gouttelette. Juste avant que le flux ne se brise en gouttelettes, le flux passe par une station de mesure de fluorescence où le caractère fluorescent d’intérêt de chaque cellule est mesuré.
Un anneau de charge électrique est placé juste au point où le flux se brise en gouttelettes. Une charge est placée sur l’anneau en fonction de la mesure d’intensité de fluorescence immédiatement antérieure, et la charge opposée est piégée sur la gouttelette lorsqu’elle se brise du flux. Les gouttelettes chargées tombent alors à travers un système de déviation électrostatique qui dévie les gouttelettes dans des conteneurs en fonction de leur charge. Dans certains systèmes, la charge est appliquée directement au flux, et la gouttelette qui se détache conserve une charge de même signe que le flux. Le flux est ensuite ramené à la neutralité après que la gouttelette se détache.
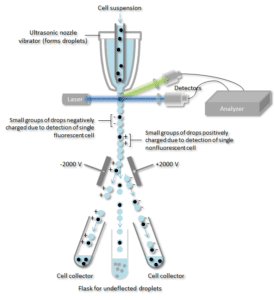
Un anticorps spécifique d’une protéine de surface cellulaire particulière est associé à une molécule fluorescente puis ajouté à un mélange de cellules. L’étape suivante est le processus de fluorescence, alors que, les cellules spécifiques passent à travers un faisceau laser, ils sont surveillés. Les gouttelettes contenant une seule cellule se voient attribuer une charge positive ou négative, selon que la cellule possède ou non un anticorps marqué par fluorescence. Les gouttelettes contenant une seule cellule sont alors détectées par un champ électrique et déviées dans des tubes de collecte séparés en fonction de leur charge permettant une séparation facile des cellules marquées par l’anticorps fluorescent.
Cytométrie en flux multicolore
La cytométrie en flux multicolore est une technique utile lors de l’examen de populations mixtes de cellules, telles que des cellules sanguines et tissulaires dans des échantillons humains et animaux. Généralement, un type de cellule spécifique est marqué avec un colorant fluorescent (marqueurs) comme le fluorophore ou l’iodure de propidium. La possibilité d’utiliser plusieurs marqueurs fluorescents simultanément permet d’identifier plusieurs types de cellules, ainsi que des marqueurs fonctionnels qui caractérisent davantage chaque échantillon. Il existe des instruments spécialisés capables de mesurer plus de 12 couleurs 3,4 . Ces colorants et marqueurs fluorescents sont mesurés par différentes longueurs d’onde de la lumière émise par le laser afin de trier par type de cellule individuelle. Chaque marqueur est excité à une longueur d’onde spécifique de la lumière pour les différencier lors de l’utilisation de marqueurs multiples.
Adapter un panneau de coloration typique de 4 à 6 couleurs à plus de 12 couleurs n’est pas simplement une question de « plug and play », il doit être abordé d’une manière systématique pour obtenir des paramètres réussis dans un panneau de coloration. Les principes de base de la conception d’un panneau fonctionnent mieux s’ils sont basés sur une recherche préalable à l’utilisation. En d’autres termes, la préparation est la clé même dès le processus de début de référence à l’indice de coloration en ce qui concerne la correspondance efficace des fluorochromes par la luminosité5.
Conseil de cytométrie en flux :
Passez du temps à comprendre les nuances subtiles de votre cytomètre en flux avant de concevoir votre panel d’anticorps primaires. Concentrez-vous sur les endroits où les mesures les plus sensibles peuvent être effectuées sur le système. Il y a plus à dire que la simple intensité fluorescente.
Envisagez de substituer un fluorochrome moins lumineux pour éviter les erreurs de canal.
Applications courantes de la méthodologie de la cytométrie en flux
La cytométrie en flux fait partie intégrante de plusieurs domaines cliniques, notamment le diagnostic, les plans de traitement et les maladies systémiques, qu’elles soient statiques ou progressives. Au fur et à mesure que nous en apprenons davantage sur les applications pratiques d’utilisation de la cytométrie en flux, la base de connaissances s’élargit. Aujourd’hui, plus que jamais, les chercheurs sont très enthousiastes à l’idée de pouvoir en apprendre davantage sur les complexités de certaines maladies et conditions. Cela a conduit à un changement rapide dans le modèle de diagnostic et a radicalement modifié les approches médicales pour traiter des maladies telles que le cancer6.
La méthodologie de la cytométrie en flux est souvent associée à d’autres modèles de tests complets tels que l’examen morphologique. Dans de nombreux cas, les néoplasmes hématologiques décrivent des changements morphologiques spécifiques, et la cytométrie en flux fournit une plus grande spécificité et aide les pathologistes à développer des anomalies tissulaires ou d’autres maladies avancées. La cytométrie en flux, dans certains cas, peut prédéterminer la récurrence du cancer avant que les changements morphologiques ne soient détectés7.
Plusieurs des principales applications utilisées dans le cadre des milieux cliniques modernes à la fois thérapeutiques et orientés vers la recherche comprennent :
- Expression des protéines – dans toute la cellule, même dans le noyau
- Modifications post-traductionnelles des protéines – y compris les protéines clivées et phosphorylées
- ARN – y compris les miRNA, et les transcriptions d’ARNm
- État de santé des cellules-détection des cellules apoptotiques ou de la mort cellulaire
- État du cycle cellulaire-fournissant un outil puissant pour évaluer les cellules en phase G0/G1 par rapport à la phase S, G2, ou polyploïdie, y compris l’analyse de la prolifération et de l’activation cellulaires
- Identification et caractérisation de sous-ensembles distincts de cellules dans un échantillon hétérogène – y compris la distinction des cellules mémoires effectrices centrales des cellules T épuisées ou des cellules T régulatrices
Wrapping Up
Les principes de base de la cytométrie en flux ont peu changé au cours de la dernière décennie, mais les applications de cette technologie ont beaucoup évolué. Les fondements de la cytométrie en flux ont été cohérents avec sa fonction première, qui consiste à interroger des cellules ou des particules individuelles dans un flux avec un laser lorsque les cellules passent devant un ensemble de détecteurs stationnaires. De plus en plus, d’autres couleurs de fluorescence sont détectées par les cytomètres, parallèlement au tri à grande vitesse et à la fonction analytique8.
La cytométrie en flux joue un rôle essentiel dans la recherche en sciences moléculaires et continue d’évoluer à un rythme rapide. Il existe plusieurs cytomètres en flux commerciaux sur le marché. Ils ont tendance à fonctionner sur le même principe de base, mais il existe des différences importantes dans leur conception, et les concepts sur l’alignement et l’intégration d’autres composants.
Sientôt à l’horizon, une instrumentation 3D sera introduite et incorporée dans un instrument propriétaire hybride produit par NanoCellect Biomedical, le trieur de cellules WOLF. Nous pouvons également nous attendre à ce que le développement de sondes fluorescentes à spectre étroit, l’intégration de techniques de biologie moléculaire à la cytométrie en flux et l’évaluation de marqueurs acellulaires tels que les cytokines soient des éléments clés de l’évolution continue de l’analyse par cytométrie en flux et de la technologie de dosage cellulaire.
Sources :
1 http://clinchem.aaccjnls.org/content/46/8/1221
2 https://pubmed.ncbi.nlm.nih.gov/18615596-flow-cytometry-histograms-transformations-resolution-and-display/
3 https://onlinelibrary.wiley.com/doi/full/10.1002/cyto.a.20959
4 https://currentprotocols.onlinelibrary.wiley.com/doi/abs/10.1002/cpim.26
5 https://www.nature.com/articles/nprot.2006.250
6 https://pubmed.ncbi.nlm.nih.gov/19967915-immunophenotypic-analysis-of-bone-marrow-b-lymphocyte-precursors-hematogones-by-flow-cytometry/
7 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4803461/
8 https://link.springer.com/protocol/10.1385/0-89603-150-0:543