
Lorsqu’on fait barboter du chlore gazeux dans une bouteille de jus de tomate, le mélange chlore/jus de tomate devient presque complètement blanc en cinq minutes. Ce changement spectaculaire est le résultat de l’action chimique du chlore, agissant comme un agent de blanchiment oxydant, sur les pigments du jus de tomate. Lorsque de vieilles coupures de journaux, décolorées par le vieillissement et l’exposition à la lumière, sont traitées avec une solution aqueuse de borohydrure de sodium à 1 %, le papier est blanchi de façon spectaculaire en vingt minutes. Dans ce cas, le papier a retrouvé sa couleur blanche d’origine par l’action du borohydrure de sodium agissant comme agent de blanchiment réducteur.
Un agent de blanchiment est une substance qui peut blanchir ou décolorer d’autres substances. Les substances colorées contiennent généralement des groupes d’atomes, appelés chromophores , qui peuvent absorber la lumière visible ayant des longueurs d’onde spécifiques et caractéristiques, et réfléchir ou transmettre la partie de la lumière qui n’est pas absorbée. Par exemple, si un chromophore absorbe la lumière bleue, il réfléchira la lumière de la couleur complémentaire, et la substance contenant le chromophore apparaîtra jaune. Les agents de blanchiment détruisent essentiellement les chromophores (supprimant ainsi la couleur), via l’oxydation ou la réduction de ces groupes absorbants. Ainsi, les agents de blanchiment peuvent être classés comme des agents oxydants ou des agents réducteurs .
Certaines des utilisations des agents de blanchiment sont :
- Le blanchiment des textiles et des tissus
- Le blanchiment de la pâte de bois
- L’élimination des taches
- Le blanchiment et le nettoyage commercial et domestique
- . Comme ingrédients des nettoyants récurants et des produits pour lave-vaisselle
- La décoloration des cheveux
Agents de blanchiment oxydants
Un grand nombre d’agents de blanchiment oxydants ont été passés en revue par Jules A. Szilard dans Agents et techniques de blanchiment (1973). Les agents de blanchiment oxydants (et les agents de blanchiment) couramment utilisés aujourd’hui sont : le chlore, le dioxyde de chlore, les hypochlorites alcalins, le peroxyde d’hydrogène, les composés peroxygénés et la lumière solaire et artificielle.
Chlore (Cl 2 ). La découverte du chlore par le chimiste suédois Carl Wilhelm Scheele en 1774 a marqué le début de l’ère moderne du blanchiment. Selon Sidney M. Edelstein, dans un article de revue de 1948 intitulé « Le rôle de la chimie dans le développement de la teinture et du blanchiment », le chimiste français Claude-Louis Berthollet a été le premier à utiliser le chlore pour blanchir les tissus de coton et de lin.
Le chlore a été utilisé pour blanchir la pâte de bois. De nombreuses usines de pâte à papier employant le procédé de fabrication de pâte Kraft préparent l’hydroxyde de sodium (nécessaire pour digérer les copeaux de bois) sur place via l’électrolyse de la saumure , une solution aqueuse concentrée de chlorure de sodium.
2NaCl + 2H 2 O → 2NaOH + H 2 + Cl 2 (1)
Le chlore est un produit secondaire. Le blanchiment ultérieur au chlore de la pâte brune donne un produit qui peut être utilisé pour la fabrication de papier d’écriture et d’impression. Malheureusement, les composés organiques de la pâte sont à la fois oxydés et chlorés, ce qui donne de petites quantités de composés organochlorés, dont
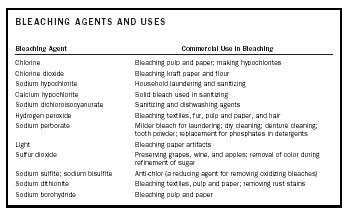
| AGENTS DE BLANCHISSEMENT ET UTILISATIONS | |
| Agent de blanchiment | Utilisation commerciale dans le blanchiment |
| Chlore | Blanchiment de la pâte et du papier ; fabrication d’hypochlorites |
| Dioxyde de chlore | Blanchiment du papier kraft et de la farine |
| Hypochlorite de sodium | Lavage et désinfection des habitations |
| Calcium. hypochlorite | Agent de blanchiment solide utilisé dans l’assainissement |
| Dichloroisocyanurate de sodium | Agents d’assainissement et de lavage de la vaisselle |
| Peroxyde d’hydrogène | Blanchiment des textiles, fourrure, pâte et papier, et cheveux |
| Perborate de sodium | Agent de blanchiment plus doux pour le blanchiment ; nettoyage à sec ; nettoyage des dentiers ; poudre dentaire ; remplacement des phosphates dans les détergents |
| Lumière | Blanchiment des objets en papier |
| Dioxyde de soufre | Conservation du raisin, du vin et des pommes ; élimination de la couleur pendant le raffinage du sucre |
| Sulfite de sodium ; bisulfite de sodium | Anti-chlore (agent réducteur pour éliminer les agents de blanchiment oxydants) |
| Dithionite de sodium | Blanchiment des textiles, de la pâte à papier et du papier ; éliminer les taches de rouille |
| Borohydrure de sodium | Blanchiment de la pâte à papier et du papier |
dioxines. En fait, la dioxine la plus abondante produite par le processus de pâte à papier et de blanchiment, la 2,3,7,8-tétrachlorodibenzo- p -dioxine (2,3,7,8-TCDD), s’est avérée être à la fois un cancérogène et une toxine mortelle . Ainsi, le chlore comme agent de blanchiment est remplacé par des agents de blanchiment plus sûrs, le dioxyde de chlore et le peroxyde d’hydrogène. En fait, la tendance dans les industries de la pâte et du papier est au blanchiment totalement sans chlore (TCF). Le chlore est maintenant utilisé dans l’industrie du blanchiment principalement pour préparer des solutions d’hypochlorite et des agents de blanchiment secs tels que l’hypochlorite de calcium.
Dioxyde de chlore (ClO 2 ). Le dioxyde de chlore a été utilisé comme agent de blanchiment à la fois dans sa phase gazeuse et en solution aqueuse. En raison de sa nature explosive, le dioxyde de chlore en phase gazeuse est souvent dilué avec de l’azote ou du dioxyde de carbone. S’il est stocké ou expédié, le dioxyde de chlore est passé à l’eau froide et conservé sous réfrigération.
Le dioxyde de chlore est préparé industriellement par la réduction du chlorate de sodium par le dioxyde de soufre en solution aqueuse.
2NaClO 3 + SO 2 + H 2 SO 4 → 2ClO 2 + 2NaHSO 4 (2)
Une méthode relativement sûre pour la préparation de ClO 2 implique la réaction entre le chlorite de sodium (NaClO 2 ) et le formaldéhyde (H 2 CO).
H 2 CO + H + + ClO 2 – → HOCl + HCOOH (3)
Lorsque la réaction 3 se déroule, le pH de la solution diminue (en raison de la production d’acide formique ). L’acidité accrue de la solution favorise la formation de ClO 2 , illustrée par l’équation 4.
HCOOH + HOCl + 2ClO 2 – → 2ClO 2 + Cl – + H 2 O + HCOO – (4)
En solution acide, le dioxyde de chlore se comporte comme un agent oxydant. La réduction complète de ClO 2 est représentée dans l’équation 5.
ClO 2 + 4H + + 5 e – → Cl – + 2H 2 O (5)
Les étapes individuelles de cette réaction de réduction globale produisent HClO 2 , HOCl, et Cl 2 , qui se comportent tous comme des agents oxydants. Un milieu acide est nécessaire, car ClO 2 se disproportionne en solution alcaline, comme le montre l’équation 6.
2ClO 2 + 2OH – → ClO 3 – + ClO 2 – + H 2 O (6)
Le dioxyde de chlore est principalement utilisé pour le blanchiment de la pâte à papier.
Hypochlorites (OCl – ). Les solutions de blanchiment hypochlorites sont fabriquées à partir de NaOCl et, dans une moindre mesure, de Ca(OCl) 2 . Les hypochlorites sont utilisés dans les blanchisseries, comme désinfectants, dans le blanchiment de la pâte à papier et des textiles, et dans l’élimination de l’encre du papier recyclé. Les solutions de blanchiment commerciales sont obtenues en faisant passer du chlore gazeux à travers de l’hydroxyde de sodium aqueux, froid et dilué, comme indiqué dans l’équation 7.
Cl 2 + 2OH – → OCl – + Cl – + H 2 O (7)
Alternativement, l’ion hypochlorite peut être généré par l’hydrolyse de composés organiques azote-chlore. Certains des composés azotés-chlorés les plus importants utilisés de cette manière sont les isocyanurates chlorés. Ceux-ci trouvent une utilisation dans les produits de nettoyage et les lave-vaisselle.
Pour être un agent de blanchiment efficace, la solution d’hypochlorite doit être maintenue alcaline (pH > 9,0), afin de supprimer l’hydrolyse de l’OCl – (voir équation 8) et d’empêcher la formation de HOCl instable.
OCl – + H 2 O → HOCl + OH – (8)
Dans les solutions acides, HOCl se forme et se décompose.
3HOCl → HClO 3 + 2HCl (9)
HOCl réagira également avec HCl, un des produits de décomposition.
HOCl + HCl → H 2 O + Cl 2 (10)
Les solutions de blanchiment à l’hypochlorite ne doivent pas contenir de cations de métaux lourds, car ces cations (comme la lumière ou la chaleur) favorisent la décomposition de l’HOCl, comme le montre l’équation 11.
2HOCl → 2HCl + O 2 (11)
Les principes actifs des agents de blanchiment hypochlorite varient en fonction du pH. À pH < 2, Cl 2 est le principal composant en solution ; à pH 4 à 6, HOCl est l’espèce dominante ; à pH > 9, OCl – est le seul composant présent. C’est l’ion hypochlorite en solution basique qui est l’ingrédient actif de l’eau de Javel domestique, qui est généralement composée d’environ 5 à 6 % de NaOCl. L’ion OCl – oxyde les chromophores des matériaux colorés, et est lui-même réduit en ions chlorure et hydroxyde.
OCl – + H 2 O + 2 e – → Cl – + 2OH – (12)
Le processus de blanchiment effectué par l’agent de blanchiment hypochlorite commercial est souvent amélioré par l’utilisation d’azurants optiques, composés qui absorbent la lumière ultraviolette incidente et émettent de la lumière visible, ce qui donne au tissu un aspect plus brillant et plus blanc.
Peroxyde d’hydrogène (H 2 O 2 ) . Le peroxyde d’hydrogène peut être préparé par la réaction du peroxyde de baryum et de l’acide sulfurique (voir équation 13). Comme le sulfate de baryum précipite, le peroxyde d’hydrogène est facilement séparé.
BaO 2 + H 2 SO 4 → BaSO 4 + H 2 O 2 (13)
Le peroxyde d’hydrogène, en tant qu’agent de blanchiment utilisé dans l’industrie de la pâte et du papier, présente l’avantage d’être non polluant. En raison de l’instabilité du peroxyde d’hydrogène pur, des solutions aqueuses sont employées pour le blanchiment. A température ambiante, le peroxyde d’hydrogène se décompose très lentement en eau et en oxygène.
2H 2 O 2 → H 2 O + O 2 (14)
Cependant, la présence de cations de métaux de transition (notamment Fe 3+ , Mn 2+ , et Cu 2+ ) et d’autres catalyseurs accélère considérablement cette réaction. Par conséquent, le peroxyde d’hydrogène aqueux doit être stabilisé avec des agents complexants qui séquestrent les cations de métaux de transition.
L’espèce de blanchiment active dans le peroxyde d’hydrogène est l’anion perhydroxyle , OOH – , formé par l’ionisation de H 2 O 2 .
H 2 O 2 + H 2 O → H 3 O + + OOH – (15)
La constante d’ionisation acide du peroxyde d’hydrogène est très faible ( K a = 2 × 10 -12 ) avec pour conséquence que les solutions de H 2 O 2 doivent être rendues alcalines pour

pour augmenter la concentration de OOH – . En l’absence d’un milieu alcalin, le peroxyde d’hydrogène n’est plus efficace comme agent de blanchiment. Par exemple, l’étape de décoloration de la teinture des cheveux emploie souvent du peroxyde d’hydrogène (5-6%), mais aussi de l’ammoniac pour fournir un milieu alcalin.
Dans le même temps, le pH ne doit pas dépasser 11, car à ce moment-là, la décomposition de OOH – commence à se produire.
2OOH – → O 2 + 2OH – (16)
Composés peroxygénés. Il existe un certain nombre de composés peroxygénés solides qui libèrent du peroxyde d’hydrogène lorsqu’ils sont dissous dans l’eau. Il s’agit notamment du perborate de sodium (NaBO 3 z 4H 2 O ou NaBO 2 z H 2 O 2 z 3H 2 O) et du carbonate de sodium peroxyhydraté (2Na 2 CO 3 z 3H 2 O 2 ). La structure du perborate de sodium contient le peroxoanion B 2 (O 2 ) 2 (OH) 4 2- , qui contient deux liaisons O-O qui relient deux groupes BO 2 (OH) 2- tétraédriques. Ces composés peroxygénés sont utilisés dans les détergents, les nettoyants pour prothèses dentaires et les poudres à dents.
Blanchiment à la lumière. Le blanchiment qui fait appel à la lumière naturelle du soleil ou à la lumière artificielle a été utilisé pour éliminer les taches des objets en papier et pour traiter les textiles. Le matériau à blanchir est d’abord immergé dans une solution alcaline de bicarbonate de calcium ou de magnésium, puis protégé des rayons ultraviolets en le recouvrant de plexiglas, de Lexan ou de Mylar. On laisse ensuite l’exposition à la lumière pendant deux à quatre heures, pour la lumière naturelle du soleil, et deux à douze heures, pour la lumière artificielle.
Agents de blanchiment réducteurs
Les agents réducteurs utilisés dans le blanchiment comprennent les sulfites, les bisulfites, les dithionites et le borohydrure de sodium, qui sont tous utilisés dans le blanchiment de la pâte à papier et des textiles.
Sulfites (SO 3 2- ) et bisulfites (HSO 3 – ). L’état d’oxydation du soufre à la fois dans SO 3 2- et HSO 3 – est +4, et l’oxydation à +6 se produit facilement, avec la formation de SO 4 2- et HSO 4 – , respectivement, ce qui fait des sulfites et des bisulfites de bons agents réducteurs.
Dithionites (S 2 O 4 2- ) . Le dithionite de sodium et le dithionite de zinc ont trouvé une utilisation dans le blanchiment des pâtes mécaniques et des textiles. La préparation de l’ion dithionite s’effectue par la réduction de l’ion bisulfite et du dioxyde de soufre avec de la poussière de Zn.
2HSO 3 – + SO 2 + Zn → Zn 2+ + S 2 O 4 2- + SO 3 2- + H 2 O (17)
L’ion dithionite, S 2 O 4 2- , qui a le soufre au degré d’oxydation +3, se comporte comme un agent réducteur fort en solution alcaline.
S 2 O 4 2- + 4OH – → 2SO 3 2- 2H 2 O + 2 e – (18)
Lorsque le pH est abaissé, le pouvoir réducteur de l’ion dithionite diminue, comme le prévoit le principe de LeChatelier.
Les dithionites sont utiles pour éliminer les taches de rouille, et des solutions de citrate neutre de Na 2 S 2 O 4 ont été utilisées pour éliminer les produits de corrosion du fer sur les objets récupérés du Titanic.
Borohydrure de sodium (NaBH 4 ). Le borohydrure de sodium a été utilisé principalement dans le blanchiment industriel des pâtes mécaniques. L’ion BH 4 – est un fort agent réducteur en solution alcaline.
BH 4 – + 10OH – → BO 3 3- + 8 e – + 7H 2 O (19)
Un problème lié à l’utilisation du borohydrure de sodium est que l’ion BH 4 – se décompose lentement en solution aqueuse.
BH 4 – + 4H 2 O → B(OH) 4 – + 4H 2 (20)
Comme méthode alternative, les sels de BH 4 – peuvent être dissous soit dans CH 3 OH, soit dans C 2 H 5 OH, moins toxique. La décomposition de l’ion BH 4 – dans les alcools se produit à une vitesse beaucoup plus lente :
BH 4 – + 4ROH → B(OR) 4 – + 4H 2 (R = CH 3 , C 2 H 5 ) (21)
Conclusion
Un agent de blanchiment peut blanchir ou décolorer une substance en réagissant avec les chromophores qui sont responsables de la couleur de la substance. Selon la nature des chromophores, l’agent de blanchiment sera soit un agent oxydant, soit un agent réducteur. C’est-à-dire que le chromophore est soit oxydé soit réduit pour produire une substance incolore ou blanchie. Les agents de blanchiment et leurs utilisations commerciales sont résumés dans le tableau 1.