Tendance 2 : Pour les oxoacides d’un atome central donné, l’acidité augmente avec l’état d’oxydation de l’élément central ou, en d’autres termes, le nombre d’oxygènes liés à l’atome central.
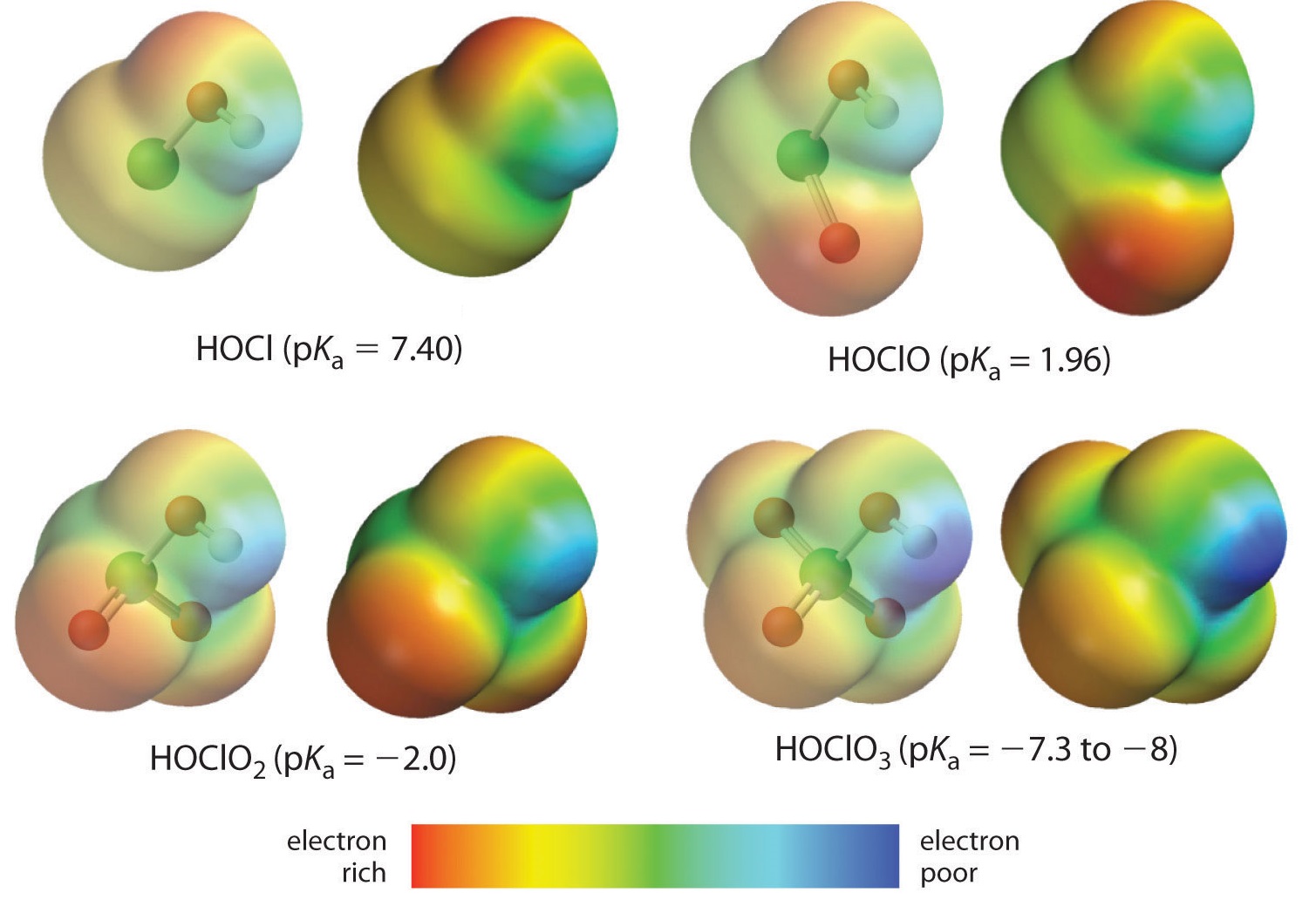
Nous examinons ici la tendance pour les acides dans lesquels il y a un nombre variable d’oxygène lié à un atome central donné. Les séries d’acides perchlorique (\(\ce{ClO_4^{-}}\)), chlorique (\(\ce{ClO_3^{-}}\)), chloreux (\(\ce{ClO_2^{-}}\)) et hypochloreux (\(\ce{ClO^{-}}\)) en sont des exemples. Dans ces séries, plus le nombre d’oxygènes est élevé, plus l’acide est fort. Cela peut s’expliquer de plusieurs façons. Du point de vue de l’acide lui-même, le facteur clé est à nouveau l’effet inductif, impliquant dans ce cas la capacité des oxygènes attachés à l’atome central à tirer sur la densité électronique à travers la liaison OH. C’est ce que montre le diagramme de densité de charge des oxoacides de chlore représenté sur la figure \(\PageIndex{1}\), dans lequel la charge positive partielle de l’hydrogène acide augmente avec le nombre d’oxygènes présents.
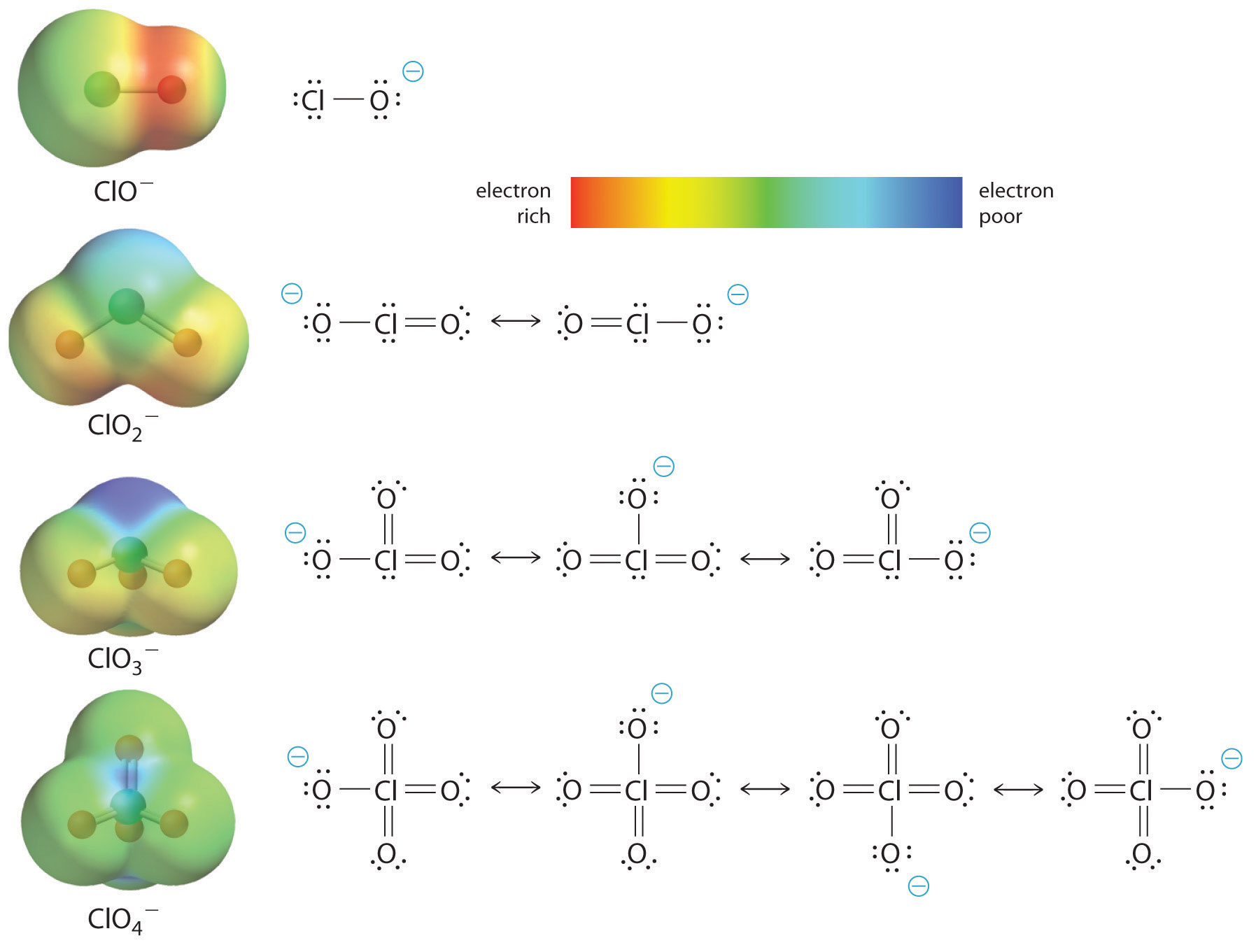
L’augmentation de l’acidité de l’oxoacide avec le nombre d’oxygènes liés à l’atome central peut également être vue en considérant la stabilité de l’oxyanion conjugué. Le fait que la stabilité de la base conjuguée augmente avec le nombre d’oxygènes peut être observé à partir des diagrammes de répartition de la charge et des modèles de liaison de Lewis pour les oxyanions de chlore représentés sur la figure \(\PageIndex{2}\). Comme la charge négative est répartie sur un plus grand nombre d’atomes d’oxygène, elle devient de plus en plus diffuse.
Exercice \(\PageIndex{1}\)
Le soufre et le sélénium forment tous deux des oxoacides de formule \(\ce{H_2EO_4}\) où E est soit S soit Se. Ils sont appelés respectivement acide sulfureux et acide sélénieux. Quel oxoacide devrait être plus acide : l’acide sélénieux ou l’acide sulfureux ?
Réponse
L’acide sulfureux devrait être plus acide. Comme le soufre est plus électronégatif que le sélénium, le soufre polarisera davantage les liaisons OH, ce qui les rendra plus acides. Cette prédiction est confirmée par une comparaison des valeurs de \(pK_a\) pour les acides :
| Acide | \(pK_{a1}\) | \(pK_{a2}\) |
|---|---|---|
| acide sulfureux, \(H_2SO_3\) | 1.85 | 7,2 |
| acide sélénieux, \(H_2SeO_3\) | 2,62 | 8,32 |