Dans des réactions comme les réactions de méthylation – élimination exhaustives de Hofmann, l’oléfine la moins substituée est généralement formée comme produit majeur. C’est ce qu’on appelle la règle d’Hofmann. Toutes ces réactions portent des groupes partants chargés comme -NR3+ ou -SR2+ et impliquent des bases fortes. La règle de Zaitsev (ou règle de Saytzeff) attire notre attention sur une autre possibilité. En éliminant HX, on obtient l’oléfine la plus stable (Fig 2.3.1). La contradiction apparente dans cet ensemble de règles est facilement résolue par un regard critique sur les mécanismes impliqués dans ces deux ensembles de conditions de réaction.
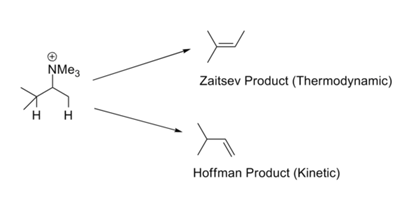
Il pourrait y avoir deux raisons pour de telles préférences. Ingold (1960) et Bunnett (1969) ont suggéré qu’un groupe partant chargé positivement augmente l’acidité des β-protons. Un substituant en position β pourrait diminuer de manière hyperconjuguée l’acidité du β-proton. Par conséquent, un groupe méthyle terminal (qui n’a pas de substituant alkyle) est plus acide que le proton méthine interne (portant au moins un substituant alkyle). Lorsque le groupe partant est un halogène, le mécanisme se déplace vers E1. Dans ces conditions, la stabilité de la double liaison qui se développe devient importante, ce qui conduit au produit thermodynamiquement plus stable. L’école de H.C. Brown avait suggéré (1956) que les facteurs stériques gouvernent ces réactions d’élimination. Les groupes partants chargés sont grands par rapport aux groupes partants neutres.
Les groupes partants plus grands comme -NR3+ et -SR2+ donnent plus de produit d’Hoffmann que les groupes plus petits comme les halogènes. L’encombrement de la base augmente également le produit de Hoffmann au détriment du produit de Zaitsav. La situation semble être plus complexe. Lorsque la force de la base a été augmentée sans augmenter le volume du site de réaction (X-C6H4-O¯), le produit de Hoffmann a augmenté au détriment du produit de Zaitsav (Froemsdorf (1966,67)). Ceci suggère un mécanisme E1cB, où l’acidité du proton β est importante. Ainsi, le mécanisme (et donc la composition des produits) pourrait être modifié par des facteurs tels que la taille du groupe partant, la taille de la base, la nature du groupe partant et la force de la base.
Contributeurs
- Prof. R Balaji Rao (Département de chimie, Banaras Hindu University, Varanasi) dans le cadre des technologies de l’information et de la communication
.