
Kun kloorikaasua kuplitetaan tomaattimehua sisältävän sylinterin läpi, kloorin ja tomaattimehun seos muuttuu lähes täysin valkoiseksi viiden minuutin kuluessa. Tämä näyttävä muutos on seurausta hapettavana valkaisuaineena toimivan kloorin kemiallisesta vaikutuksesta tomaattimehun pigmentteihin. Kun vanhoja sanomalehtileikkeitä, jotka ovat ikääntymisen ja valolle altistumisen vuoksi värjäytyneet, käsitellään 1-prosenttisella natriumboorihydridin vesiliuoksella, paperi valkaistuu dramaattisesti 20 minuutissa. Tässä tapauksessa paperi on palautettu alkuperäiseen valkoiseen väriinsä pelkistävänä valkaisuaineena toimivan natriumboorihydridin vaikutuksesta.
Valkaisuaine on aine, joka voi valkaista tai värinpoistaa muita aineita. Värilliset aineet sisältävät yleensä atomiryhmiä, joita kutsutaan kromoforeiksi , jotka voivat absorboida näkyvää valoa, jolla on tietyt, niille ominaiset aallonpituudet, ja heijastaa tai läpäistä valon sen osan, jota ei absorboida. Jos esimerkiksi kromofori absorboi sinistä valoa, se heijastaa komplementtivärin valoa, ja kromoforia sisältävä aine näyttää keltaiselta. Valkaisuaineet lähinnä tuhoavat kromoforit (ja poistavat siten värin) näiden absorboivien ryhmien hapettumisen tai pelkistymisen kautta. Näin ollen valkaisuaineet voidaan luokitella joko hapettaviksi tai pelkistäviksi aineiksi.
Joitakin valkaisuaineiden käyttökohteita ovat mm :
- Tekstiilien ja kankaiden valkaisu
- Puumassan valkaisu
- Tahrojen poisto
- Kaupallinen ja kotitalouksien pyykinpesu ja puhdistus
- . Pesu- ja astianpesuaineiden ainesosina
- Hiusten valkaisu
Hapettavat valkaisuaineet
Suuren määrän hapettavia valkaisuaineita on tarkastellut Jules A. Szilard teoksessa Bleaching Agents and Techniques (1973). Nykyisin yleisesti käytettyjä hapettavia valkaisuaineita (ja valkaisuaineita) ovat: kloori, klooridioksidi, emäksiset hypokloriitit, vetyperoksidi, peroksiyhdisteet sekä auringonvalo ja keinovalot.
Kloori (Cl 2 ). Ruotsalaisen kemistin Carl Wilhelm Scheelen vuonna 1774 tekemä kloorin löytö merkitsi valkaisun modernin aikakauden alkua. Sidney M. Edelsteinin vuonna 1948 ilmestyneessä lehtiartikkelissa ”The Role of Chemistry in the Development of Dyeing and Bleaching” (Kemian rooli värjäyksen ja valkaisun kehityksessä) todetaan, että ranskalainen kemisti Claude-Louis Berthollet käytti ensimmäisenä klooria puuvilla- ja pellavakankaiden valkaisuun.
Klooria on käytetty puumassan valkaisuun. Monet sellutehtaat, jotka käyttävät voimamassanvalmistusprosessia, valmistavat natriumhydroksidia (jota tarvitaan puuhakkeen pilkkomiseen) paikan päällä elektrolyysillä suolavedestä, joka on väkevää natriumkloridin vesiliuosta.
2NaCl + 2H 2 O → 2NaOH + H 2 + Cl 2 (1)
Kloori on sivutuote. Ruskosellun myöhempi kloorivalkaisu antaa tuotteen, jota voidaan käyttää kirjoitus- ja painopaperin valmistukseen. Valitettavasti sellussa olevat orgaaniset yhdisteet sekä hapettuvat että kloorautuvat, jolloin syntyy pieniä määriä orgaanisia klooriyhdisteitä, kuten
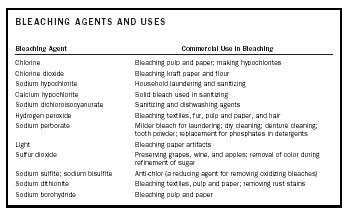
| VALKAISUAINEET JA KÄYTTÖTARKOITUKSET | |
| Valkaisuaine | Kaupallinen käyttö valkaisussa |
| Kloori | Massa- ja paperin valkaisu; hypokloriittien valmistus |
| Klooridioksidi | Voimapaperin ja jauhojen valkaisu |
| Natriumhypokloriitti | Kotitalouksien pesu ja desinfiointi |
| Kalsium hypokloriitti | Kiinteä valkaisuaine, jota käytetään desinfioinnissa |
| Natriumdikloroisosyanuraatti | Desinfiointi- ja astianpesuaineet |
| Vetyperoksidi | Tekstiilien valkaisu, turkisten, massan ja paperin sekä hiusten valkaisuun |
| Natriumperboraatti | Miedompi valkaisuaine pesuun; kuivapesuun; hammasproteesien puhdistukseen; hammaspuuteriin; fosfaattien korvaamiseen pesuaineissa |
| Valo | Paperiesineiden valkaisuun |
| Rikkidioksidi | Viinirypäleiden, viinin ja omenoiden säilöntään; värin poistoon sokerin puhdistuksessa |
| Natriumsulfiitti; Natriumbisulfiitti | Antikloori (pelkistävä aine hapettavien valkaisuaineiden poistamiseen) |
| Natriumditioniitti | Tekstiilien, massan ja paperin valkaisu; ruostetahrojen poistaminen |
| Natriumboorihydridi | Massan ja paperin valkaisu |
dioksiinit. Itse asiassa sellun ja valkaisuprosessin tuottama runsain dioksiini, 2,3,7,8-tetraklooridibentso- p -dioksiini (2,3,7,8-TCDD), on todettu sekä syöpää aiheuttavaksi että tappavaksi myrkyksi . Niinpä klooria valkaisuaineena ollaan korvaamassa turvallisemmilla valkaisuaineilla, kuten klooridioksidilla ja vetyperoksidilla. Itse asiassa massa- ja paperiteollisuuden suuntaus on kohti täysin kloorivapaata (TCF) valkaisua. Klooria käytetään nykyään valkaisuteollisuudessa pääasiassa hypokloriittiliuosten ja kuivavalkaisuaineiden, kuten kalsiumhypokloriitin, valmistukseen.
Klooridioksidi (ClO 2 ). Klooridioksidia on käytetty valkaisuaineena sekä kaasufaasissa että vesiliuoksena. Räjähdysherkkyytensä vuoksi kaasufaasissa oleva klooridioksidi laimennetaan usein typellä tai hiilidioksidilla. Varastoitaessa tai kuljetettaessa klooridioksidi johdetaan kylmän veden läpi ja säilytetään jäähdytettynä.
Klooridioksidia valmistetaan teollisesti pelkistämällä natriumkloraattia rikkidioksidilla vesiliuoksessa.
2NaClO 3 + SO 2 + H 2 SO 4 → 2ClO 2 + 2NaHSO 4 (2)
Suhteellisen turvallinen menetelmä ClO 2:n valmistamiseksi on natriumkloriitin (NaClO 2 ) ja formaldehydin (H 2 CO) välinen reaktio.
H 2 CO + H + + ClO 2 – → HOCl + HCOOH (3)
Reaktion 3 edetessä liuoksen pH laskee (muurahaishapon muodostumisen vuoksi ). Liuoksen lisääntynyt happamuus edistää ClO 2 :n muodostumista, mikä näkyy yhtälössä 4.
HCOOH + HOCl + 2ClO 2 – → 2ClO 2 + Cl – + H 2 O + HCOO – (4)
Happamassa liuoksessa klooridioksidi käyttäytyy hapettimena. ClO 2:n täydellinen pelkistyminen on esitetty yhtälössä 5.
ClO 2 + 4H + + + 5 e – → Cl – + 2H 2 O (5)
Tämän kokonaispelkistysreaktion yksittäiset vaiheet tuottavat HClO 2 :ta, HOCl:ta ja Cl 2 :ta, jotka kaikki käyttäytyvät hapettimina. Tarvitaan hapan väliaine, koska ClO 2 disproportionoituu emäksisessä liuoksessa, kuten yhtälössä 6 on esitetty.
2ClO 2 + 2OH – → ClO 3 – + ClO 2 – + H 2 O (6)
Klooridioksidia käytetään pääasiassa sellun valkaisuun.
Hypokloriitit (OCl – ). Hypokloriittivalkaisuliuoksia valmistetaan NaOCl:sta ja vähäisemmässä määrin Ca(OCl) 2 :sta. Hypokloriitteja käytetään pesussa, desinfiointiaineina, sellun ja tekstiilien valkaisussa sekä painovärin poistossa kierrätyspaperista. Kaupallisia valkaisuliuoksia saadaan johtamalla kloorikaasua kylmän, laimean, vesipitoisen natriumhydroksidin läpi yhtälön 7 mukaisesti.
Cl 2 + 2OH – → OCl – + Cl – + H 2 O (7)
Vaihtoehtoisesti hypokloriitti-ioni voidaan tuottaa orgaanisten typpiklooriyhdisteiden hydrolyysillä. Eräitä tärkeimpiä tällä tavoin käytettäviä typpiklooriyhdisteitä ovat klooratut isosyanuraatit. Niitä käytetään puhdistus- ja astianpesuaineissa.
Jotta hypokloriittiliuos olisi tehokas valkaisuaine, se on pidettävä emäksisenä (pH > 9,0), jotta OCl -:n hydrolyysi (ks. yhtälö 8) tukahdutetaan ja estetään epävakaan HOCl:n muodostuminen.
OCl – + H 2 O → HOCl + OH – (8)
Happamissa liuoksissa HOCl muodostuu ja hajoaa.
3HOCl → HClO 3 + 2HCl (9)
HOCl reagoi myös HCl:n kanssa, joka on yksi hajoamistuotteista.
HOCl + HCl → H 2 O + Cl 2 (10)
Hypokloriittivalkaisuliuokset eivät saa sisältää raskasmetallien kationeja, koska nämä kationit (kuten valo tai lämpö) edistävät HOCl:n hajoamista, kuten yhtälössä 11 esitetään.
2HOCl → 2HCl + O 2 (11)
Hypokloriittivalkaisuaineiden vaikuttavat aineet vaihtelevat pH:n mukaan. pH:ssa < 2 Cl 2 on liuoksen pääkomponentti; pH:ssa 4-6 HOCl on hallitseva laji; pH:ssa > 9 OCl – on ainoa läsnä oleva komponentti. Juuri emäksisessä liuoksessa oleva hypokloriitti-ioni on kotitalouksien valkaisuaineen aktiivinen ainesosa, joka on tyypillisesti noin 5-6 prosenttia NaOCl:ää. OCl -ioni hapettaa värillisten materiaalien kromoforit ja pelkistyy itse kloridi- ja hydroksidi-ioneiksi.
OCl – + H 2 O + 2 e – → Cl – + 2OH – (12)
Kaupallisten hypokloriittivalkaisuaineiden aikaansaamaa valkaisuprosessia tehostetaan usein käyttämällä optisia kirkasteita, yhdisteitä, jotka absorboivat kohdalleen osuvaa ultraviolettivaloa ja säteilevät näkyvää valoa saaden kankaan näyttämään kirkkaammalta ja vaaleammalta.
Vetyperoksidi (H 2 O 2 ) . Vetyperoksidia voidaan valmistaa bariumperoksidin ja rikkihapon reaktiolla (ks. yhtälö 13). Koska bariumsulfaatti saostuu, vetyperoksidi on helppo erottaa.
BaO 2 + H 2 SO 4 → BaSO 4 + H 2 O 2 (13)
Sellu- ja paperiteollisuudessa käytettävänä valkaisuaineena vetyperoksidilla on se etu, että se ei saastuta. Puhtaan vetyperoksidin epävakauden vuoksi valkaisussa käytetään vesiliuoksia. Vetyperoksidi hajoaa huoneenlämmössä hyvin hitaasti vedeksi ja hapeksi.
2H 2 O 2 → H 2 O + O 2 (14)
Siirtymämetallien kationien (erityisesti Fe 3+ , Mn 2+ ja Cu 2+ ) ja muiden katalyyttien läsnäolo kuitenkin nopeuttaa tätä reaktiota huomattavasti. Tämän vuoksi vesipitoinen vetyperoksidi on stabiloitava kompleksinmuodostajilla, jotka sitovat siirtymämetallien kationit.
Vetyperoksidin aktiivinen valkaisulaji on perhydroksyylianioni , OOH – , joka muodostuu H 2 O 2 :n ionisoituessa.
H 2 O 2 + H 2 O → H 3 O + + OOH – (15)
Vetyperoksidin happoionisaatiovakio on hyvin pieni ( K a = 2 × 10 -12 ), minkä seurauksena H 2 O 2 -liuokset on tehtävä emäksisiksi, jotta

nostaa OOH-pitoisuutta – . Ilman emäksistä väliainetta vetyperoksidi ei ole enää tehokas valkaisuaine. Esimerkiksi hiusten värjäyksen valkaisuvaiheessa käytetään usein vetyperoksidia (5-6 %), mutta myös ammoniakkia emäksisen väliaineen aikaansaamiseksi.
Samalla pH ei saa nousta yli 11:n, koska tällöin alkaa OOH – hajoaminen.
2OOH – → O 2 + 2OH – (16)
Peroksiyhdisteet. On olemassa useita kiinteitä peroksiyhdisteitä, jotka vapauttavat vetyperoksidia veteen liuetessaan. Näitä ovat natriumperboraatti (NaBO 3 z 4H 2 O tai NaBO 2 z H 2 O 2 z 3H 2 O) ja natriumkarbonaattiperoksyhydraatti (2Na 2 CO 3 z 3H 2 O 2 ). Natriumperboraatin rakenne sisältää peroksoanionin B 2 (O 2 ) 2 (OH) 4 2- , joka sisältää kaksi O-O-sidosta, jotka yhdistävät kaksi tetraedristä BO 2 (OH) 2-ryhmää. Näitä peroksiyhdisteitä käytetään pesuaineissa, hammasproteesien puhdistusaineissa ja hammasjauheissa.
Valon avulla tapahtuva valkaisu. Valkaisua, jossa käytetään joko luonnollista auringonvaloa tai keinotekoista valoa, on käytetty tahrojen poistamiseen paperiesineistä ja tekstiilien käsittelyyn. Valkaistava materiaali upotetaan ensin joko kalsium- tai magnesiumbikarbonaatin emäksiseen liuokseen ja suojataan sen jälkeen ultraviolettisäteilyltä peittämällä se pleksilasilla, Lexanilla tai Mylarilla. Tämän jälkeen valolle altistamisen annetaan tapahtua kahdesta neljään tuntia, jos kyseessä on luonnollinen auringonvalo, ja kahdesta kahteentoista tuntia, jos kyseessä on keinotekoinen valo.
Pelkistävät valkaisuaineet
Valkaisussa käytettäviä pelkistäviä aineita ovat mm. sulfiitit, bisulfiitit, ditioniitit ja natriumboorihydridi, joita kaikkia käytetään massan ja tekstiilien valkaisussa.
Sulfiitit (SO 3 2- ) ja bisulfiitit (HSO 3 – ). Sekä SO 3 2- :n että HSO 3 – :n rikin hapetusaste on +4, ja hapettuminen +6:een tapahtuu helposti, jolloin muodostuu SO 4 2- :ta ja HSO 4 – :ta, mikä tekee sulfiiteista ja bisulfiiteista hyviä pelkistimiä.
Ditioniitit (S 2 O 4 2- ) . Sekä natrium- että sinkkiditioniittia on käytetty mekaanisen massan ja tekstiilien valkaisussa. Ditioniitti-ionin valmistus tapahtuu bisulfiitti-ionin ja rikkidioksidin pelkistämisellä Zn-pölyllä.
2HSO 3 – + SO 2 + Zn → Zn 2+ + S 2 O 4 2- + SO 3 2- + H 2 O (17)
Ditioniitti-ioni, S 2 O 4 2- , jossa rikki on hapetusasteessa +3, käyttäytyy voimakkaana pelkistimenä emäksisessä liuoksessa.
S 2 O 4 2- + 4OH – → 2SO 3 2- 2H 2 O + 2 e – (18)
pH:n laskiessa ditioniitti-ionin pelkistävä voima vähenee, kuten LeChatelierin periaate ennustaa.
Ditioniitit ovat käyttökelpoisia ruostetahrojen poistamisessa, ja Na 2 S 2 O 4:n neutraaleja sitraattiliuoksia käytettiin raudan korroosiotuotteiden poistamiseen Titanicilta talteen otetuista esineistä.
Natriumboorihydridi (NaBH 4 ). Natriumboorihydridiä on käytetty pääasiassa mekaanisen massan teolliseen valkaisuun. BH 4 -ioni on vahva pelkistysaine emäksisessä liuoksessa.
BH 4 – + 10OH – → BO 3 3- + 8 e – + 7H 2 O (19)
Natriumboorihydridin käytön ongelmana on, että BH 4 -ioni hajoaa hitaasti vesiliuoksessa.
BH 4 – + 4H 2 O → B(OH) 4 – + 4H 2 (20)
Vaihtoehtoisena menetelmänä BH 4 -suolat voidaan liuottaa joko CH 3 OH:hon tai vähemmän myrkylliseen C 2 H 5 OH:hon. BH 4 -ionin hajoaminen alkoholeissa tapahtuu paljon hitaammin:
BH 4 – + 4ROH → B(OR) 4 – + 4H 2 (R = CH 3 , C 2 H 5 ) (21)
Johtopäätös
Valkaisuaine voi valkaista tai värinpoistaa ainetta reagoimalla aineen väristä vastaavien kromoforien kanssa. Kromoforien luonteesta riippuen valkaisuaine on joko hapettava tai pelkistävä aine. Toisin sanoen kromofori joko hapetetaan tai pelkistetään värittömän tai valkaistun aineen tuottamiseksi. Taulukossa 1 on yhteenveto valkaisuaineista ja niiden kaupallisista käyttötarkoituksista.