PalaminenEdit
Tyydyttymättömät hiilivedyt voivat useimpien muiden hiilivetyjen tavoin käydä läpi palamisreaktioita, jotka tuottavat hiilidioksidia ja vettä täydellisessä palamisessa. Reaktioyhtälö on:
- CxHy + y+4x/4O2 → y/2H2O + xCO2
Hapen puuttuessa palaminen muuttuu epätäydelliseksi palamiseksi ja tuottaa hiilimonoksidia ja hiiltä.
Tyydyttymättömät hiilivedyt tuottavat helpommin epätäydellistä palamistuotetta kuin tyydyttyneet. Tämän seurauksena tyydyttymättömien hiilivetyjen palamisessa on yleensä keltainen liekki, joka eroaa tyydyttyneiden hiilivetyjen sinisestä liekistä. Tämä osoittaa, että tyydyttymättömien hiilivetyjen palamiseen liittyy monivaiheisia mekanismeja, ja hiilen palaminen aiheuttaa keltaisen liekin värin.
Koska tyydyttymättömien hiilivetyjen vetypitoisuus on pienempi, ne tuottavat vähemmän vettä ja vähentävät liekin kosteutta sekä vähentävät hapenkulutusta. Polttoaineena voidaan käyttää esimerkiksi asetyleeniä(etyyniä).

Vertailtuna tyydyttyneiden hiilivetyjen yksittäisiin σ C-C-sidoksiin, tyydyttymättömillä hiilivedyillä on elektronitiheys π-sidoksessa, jossa elektronitiheys ei ole paljoa σ:n kaltaista elektronitiheyden päällekkäisyyttä. Tämän seurauksena yhteen kaksoissidokseen varastoitunut kemiallinen energia on pienempi kuin kahdessa yksinkertaisessa sidoksessa. Näin ollen tyydyttymättömien hiilivetyjen palaminen, jossa hiilihiilisidokset katkeavat energian vapauttamiseksi, vapauttaa vähemmän energiaa kuin saman moolimäärän tyydyttyneiden hiilivetyjen, joissa on sama määrä hiiltä, polttaminen. Tämä suuntaus näkyy selvästi hiilivetyjen palamisen vakioentalpia-luettelossa.
| Hiililuku | Aine | Aine | Tyyppi | Formula | Hcø(kJ/mol) |
|---|---|---|---|---|---|
| 2 | etaani | kyllästetty | C2H6 | -1559.7 | |
| eteeni | tyydyttymätön | C2H4 | -1410.8 | ||
| etyyni | tyydyttymätön | C2H2 | -1300.8 | ||
| 3 | propaani | tyydyttymätön | CH3CH2CH3 | -2219.2 | |
| propeeni | tyydyttymätön | CH3CH=CH2 | -2058.1 | ||
| propiini | tyydyttymätön | CH3C≡CH | -1938.7 | ||
| 4 | butaani | tyydyttymätön | CH3CH2CH2CH3 | -2876.5 | |
| but-1-eeni | tyydyttymätön | CH2=CH-CH2CH3 | -2716.8 | ||
| but-1-yne | tyydyttymätön | CH≡C-CH2CH3 | -2596.6 |
Elektrofiilinen additioEdit
Kaksois- tai kolmoissidokset, joita tyydyttymättömissä hiilivedyissä on oltava, tarjoavat suuren elektronitiheyden, joka tekee molekyyleistä täydellisiä paikkoja elektrofiilisille additioreaktioille. Tällaisessa reaktiossa yksi π-sidos hiilien välillä katkeaa kahdeksi erilliseksi σ-sidokseksi kunkin hiilen ja lisätyn ryhmän välillä. Mekanismissa on yleensä mukana karbokationin välimuoto.
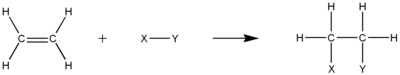
HydrataatioMuokkaa
Hydrataatio on vetykaasun elektrofiilistä additiota tyydyttymättömään hiilivetyyn. Tuloksena on tyydyttyneempi hiilivety, mutta ei välttämättä tule tyydyttynyt hiilivety. Esimerkiksi alkiinin puolihydrogenointi voi muodostaa alkeenin. Prosessissa π-sidosten kokonaislukumäärän on kuitenkin pienennyttävä. Myös π hiili-hiilisidos on välttämätön tässä prosessissa.
Eteenin vetykytkennän reaktioyhtälö etaanin muodostamiseksi on:
- H2C=CH2 + H2→H3C-CH3
Vetykytkentäreaktio vaatii tavallisesti katalyyttejä nopeutensa lisäämiseksi.
Tyydyttymättömään hiilivetyyn lisättävien vetyjen kokonaislukumäärä riippuu sen tyydyttymättömyysasteesta. Tyydyttymättömään hiilivetyyn, jonka kaava on CXHY, voidaan lisätä enintään 2X+2-Y vetyatomia. Tällöin molekyylistä tulee kylläinen.
Halogenointi Muokkaa
Vetysidoksen tapaan halogeenin(X2) heterolyysi tuottaa elektrofiilisen X+-ionin, jonka jälkeen sen kimppuun hyökkää π-sidoksen elektroni. Toisin kuin vety, halogenointi tuottaa haloniumioneja välituotteena karbokationien sijasta useimmissa muissa tapauksissa. Haloniumkationi jättää rajoitetusti tilaa X-ionin hyökkäykselle ja muuttuu vain trans-tuotteeksi. Halogenoinnin nettotulos on yhden π-sidoksen väheneminen ja kahden hiili-halogeeni σ-sidoksen lisääntyminen kahdessa hiilessä.

Reaktioyhtälö bromin additiolle eteeniin on esimerkiksi:
- H2C=CH2 + Br2→H2CBr-CH2Br (trans)
Bromitestiä käytetään hiilivetyjen kylläisyyden testaamiseen. Testissä lisätään bromivettä tuntemattomaan hiilivetyyn; jos hiilivety purkaa bromivettä halogenoitumisreaktion seurauksena, voidaan päätellä, että hiilivety on tyydyttymätön. Jos se ei purkaudu, se on tyydyttynyt.
Bromitestiä voidaan käyttää myös tyydyttymättömien hiilivetyjen tyydyttymättömyysasteen osoittamiseen. Bromiluku määritellään grammana bromia, joka pystyy reagoimaan 100 g tuotteen kanssa. Samoin kuin hydrataatio, myös bromin halogenointi riippuu π-sidosten lukumäärästä. Suurempi bromiluku osoittaa korkeampaa tyydyttymättömyysastetta.
HydrataatioEdit
Tyydyttymättömien hiilivetyjen π-sidokset ovat myös valmiita ottamaan vedestä H+ ja OH-. Reaktioon liittyy yleensä vahva happo katalysaattorina. Tämä johtuu siitä, että hydrataatiomekanismin ensimmäisessä vaiheessa π-sidos deprotonoi H+:n vahvasta haposta muodostaen karbokationin. Reaktion nettotuloksena on alkoholi.
Eteenin hydrataation reaktioyhtälö on:
- H2C=CH2 + H2O→H3C-CH2OH
Kolmiosidoksen π-sidokset pystyvät myös käymään läpi hydrataation happamassa tilassa ja muodostamaan enoleja. Enoli ei kuitenkaan ole tuote vaan välituote, ja lopputuote on ketoni. Enoliväliaine tautomerisoituu ja muodostaa vakaamman ketonin.
Etyynin hydrataation reaktioyhtälö asetaldehydin muodostamiseksi on:
- HC≡CH + H2O → H2C=CH-OH
- H2C=CH-OH ⇌ H3C-CHO
HydrohalogenointiMuokkaa

Hydrohalogenoinnissa on kyse H-X:n lisäyksestä tyydyttymättömiin hiilivetyihin. Tällöin yksi π C=C-sidos vähenee ja syntyy 2 C-H- ja C-X σ-sidosta, joilla on 2 erillistä hiiltä. Välikarbokationin muodostuminen on selektiivistä ja noudattaa Markovnikovin sääntöä. Alkeenin hydrohalogenointi johtaa haloalkaaniin ja alkiinin hydrohalogenointi vinyylihalogenidiin. Alkiinin hydrohalogenointi on paljon hitaampaa kuin alkeenin.
Eteenin HBr-lisäyksen reaktioyhtälö on:
- H2C=CH2 + HBr→H3C-CH2Br
HapettuminenEdit

Tyydyttymättömien hiilivetyjen hapettuminen riippuu hapettimen voimakkuudesta. Heikko hapetin johtaa dihydroksylaatioon, yhden π-sidoksen poistumiseen kahdeksi σ-sidokseksi hapen kanssa. Alkeenin dihydroksylaatio tuottaa diolia, ja alkiinin dihydroksylaatio tuottaa vikinaalista dikarbonyyliä.
Vahvempi hapetin, esimerkiksi KMnO4 tai otsoni, johtaa hapettuvaan pilkkoutumiseen. Tällöin π-sidos katkeaa σ-sidoksen kanssa, jolloin hiilivetymolekyyli jakautuu kahtia. Happi sitoutuu kahteen jäljelle jäävään π-sidokseen erikseen. Alkeenin oksidatiivinen pilkkoutuminen tuottaa ketoneja tai aldehydejä riippuen kaksoissidoksen paikasta, ja alkyynien pilkkoutuminen tuottaa karboksyylihappoa.
Allylinen substituutioMuutos
Tyydyttymättömien hiilivetyjen π-sidos alentaa allylisen C-H-sidoksen dissosiaatioenergian, joka on sp2-hiilivetyjen viereisen hiilen C-H-sidos. Tämän seurauksena vapaiden radikaalien substituutioreaktio suosii additioreaktioita.
Esimerkki tästä on NBS-bromausreaktio alkeenin kanssa. NBS:n N-Br-sidos on heikko, joten vapaita Br-radikaaleja muodostuu paljon. Vapaa radikaali hyökkää heikentyneiden allyylihydrogeenien kimppuun ja korvaa ne bromiatomeilla. Reaktioyhtälö on:
- RCH2CH=CH2 + (CH2CO)2NBr → RCHBrCH=CH2 + RCH=CHCHCH2Br + (CH2CO)2N
Reaktiossa syntyy kaksi isomeeria, joissa bromi on kiinnittynyt eri hiileihin. Reaktio vaatii suuren määrän vapaita Br-radikaaleja elektrofiilisten Br+-ionien sijasta, jotka menevät additioreaktioon. NBS on olennainen edellytys tällaisten olosuhteiden aikaansaamiseksi.
Jos allyylihiileen on liitetty hiilivetyryhmiä, se tekee tästä hiilestä tyydyttyneemmän. Zaitsevin säännön mukaan tämä hiili muodostaa vakaamman karbokationivälituotteen. Tämän seurauksena tapahtuu allylinen uudelleenjärjestäytyminen ja π-sidos siirtyy tähän hiileen. Näin syntyy päätuote, jossa bromi on substituoitu hiileen, joka on neljän sidoksen päässä hiilivetyryhmästä.
SykloadditionEdit

Tyydyttymättömien hiilivetyjen kohdalla rengasrakenne ja π-sidokset voivat kumpikin lisätä tyydyttymättömyysastetta, rengasrakenteiden ja π-sidosten vaihtuminen voi tapahtua erityisissä olosuhteissa. Esimerkiksi konjugoidun dieenin ja substituoidun alleenin tapauksessa tapahtuu Diels-Alderin reaktio, joka muodostaa syklohekseenin. Tällainen reaktio on stereokemiallisesti erittäin selektiivinen.
Alkynit voivat metallikatalyyttien, esimerkiksi koboltin, vaikutuksesta käydä läpi myös sykliliitosreaktion, jota kutsutaan alkyynitrimerisaatioksi. Kolme alkyniä käy läpi ”2+2+2”-syklisaatioreaktion ja liittyvät nopeasti yhteen muodostaen bentseenin.Eri alkeenien trimerisaatio ei yleensä ole selektiivinen, mutta erityisesti suunnitellut katalyytit voivat lisätä selektiivisyyttä.
Reagoi ligandinaEdit

Tyydyttymättömien hiilivetyhiilivetyjen sisältämässä delokalisoituneessa π-sidoksessa saadaan aikaan suuri elektronitiheys, jolloin molekyylillä on mahdollista toimia metallin ligandina. Alkeeniligandissa sidosrakennetta voidaan kuvata Dewar-Chatt-Duncanson-mallilla. Tällöin π-elektronitiheys luovutetaan metallin d-orbitaaleille. Mitä voimakkaampi luovutus on, sitä voimakkaampi on takasidos metallin d-orbitaalista alkeenin π*-anti-sidosorbitaaliin. Tämä vaikutus vähentää alleenin sidosjärjestystä ja kasvattaa C-C-sidoksen pituutta. Tämän seurauksena metalli muodostaa kahden hiilen kanssa pienen rengasrakenteen.
DCD-malli voi kuvata myös alkyeenin ligandirakennetta. Metallikompleksi voi olla myös alkyneiden trimerisaation välituotteena, joten metallit voivat olla reaktion katalyyttejä.
Alkeneen ligandikompleksien synteesi voidaan kuvata elektrofiilisenä additioreaktiona.
Samoin kuin lineaarisilla tyydyttymättömillä hiilivedyillä, myös areneilla on delokalisoituneita π-sidoksia, jotka pystyvät luovuttamaan metalleille kompleksin muodostamiseksi. Tapauksissa, kuten bentseenissä, hiilet luovuttavat metallille yhtä paljon elektroneja, kun taas joissakin muissa tapauksissa hiilet luovuttavat metallille eri tavoin, jolloin areni taipuu tai dearomatisoituu.