Kerrataan ensin virtaussytometrian perusteet
Mitä on virtaussytometria?
Virtaussytometria on tekniikka, jota käytetään solu- tai hiukkaspopulaation fysikaalisten ja kemiallisten ominaisuuksien havaitsemiseen ja mittaamiseen. Tässä prosessissa soluja tai hiukkasia sisältävä näyte suspendoidaan nesteeseen ja ruiskutetaan virtaussytometrilaitteeseen.
Mikä on virtaussytometrian tarkoitus?
Virtaussytometria tarjoaa vakiintuneen menetelmän solujen tunnistamiseen liuoksesta, ja sitä käytetään yleisimmin perifeerisen veren, luuytimen ja muiden kehon nesteiden arviointiin. Virtaussytometriatutkimuksia käytetään immuunisolujen tunnistamiseen ja kvantifiointiin sekä hematologisten maligniteettien kuvaamiseen.1 Niillä voidaan mitata:
- solun kokoa
- solun rakeisuutta
- DNA:n kokonaismäärää
- uusia syntetisoituja
- DNA:n geeniekspressiota
- pintareseptoreita
- sisäsoluisia proteiinit
- transienttinen signaali
Kyky suorittaa nämä mittaukset hyvin nopeassa ajassa on yksi virtaussytometrisen prosessin tärkeimmistä eduista. Niillä voidaan kvantifioida jopa kolmesta kuuteen ominaisuutta tai komponenttia kvantifioidaan yhdessä näytteessä solu solulta noin 10 000 solun osalta alle minuutissa.
Virtaussytometrian instrumentointi ja metodologia
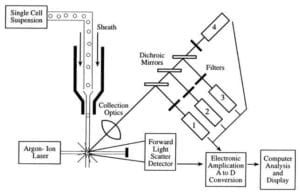 Virtaussytometrit ottavat suspensiossa monodispersiivisiä yksittäisiä soluja, jotka eivät ole paakkuuntuneita, ja ajavat ne yksitellen (single file) lasersäteen ohi, jolloin kukin solu läpäisee lasersäteen, sironneen ja fluoresoivan valon, minkä jälkeen solut lasketaan ja lajitellaan tai karakterisoidaan edelleen.
Virtaussytometrit ottavat suspensiossa monodispersiivisiä yksittäisiä soluja, jotka eivät ole paakkuuntuneita, ja ajavat ne yksitellen (single file) lasersäteen ohi, jolloin kukin solu läpäisee lasersäteen, sironneen ja fluoresoivan valon, minkä jälkeen solut lasketaan ja lajitellaan tai karakterisoidaan edelleen.
Virtaussytometrin kolme pääkomponenttia ovat fluidiikka, optiikka ja elektroniikka.
- Virtaussytometrin fluidijärjestelmä vastaa näytteiden kuljettamisesta näyteputkesta virtaussoluun, laserin ohi, lajiteltuna ja/tai hävitettynä.
- Optisen järjestelmän komponentteihin kuuluvat kiihdytysvalonlähteet, linssit ja optiset suodattimet, joita käytetään keräämään ja liikuttamaan valon aallonpituuksia laitteen ympärillä, sekä detektointilaitejärjestelmä, joka synnyttää valokennon. Aallonpituusvasteen ero datassa auttaa analysoimaan solutyyppiä.
- Elektroniikka tai virtaussytometrin instrumentointi.
Virtaussytometrian käytön tärkeimpiä periaatteita on kyky analysoida koko solusykli ja analysoida DNA:n sisältö eri vaiheissa. Solusyklin luonnollisten tapahtumien seuraaminen voi antaa tietoa sairauden diagnosointia ja hoidon ennustamista varten. Solusyklin eri vaiheet voivat paljastaa muuttuneen DNA-pitoisuuden ja muita poikkeavuuksia, jotka viittaavat kasvaimen esiintymiseen tai merkkeihin pitkälle edenneestä solukuolemasta. Tietoilmaisut tallennetaan tietokoneelle virtaussytometriaan erikoistuneen ohjelmiston avulla, joka liittyy valitun laitteen käyttöön analyysin aikana. Virtaussytometriatiedot raportoidaan yleensä kahdella eri tavalla: histogrammina ja/tai pistekuviona2.
| G1-vaihe: | RNA:ta, ribosomeja ja proteiineja syntetisoidaan |
| S-vaihe: | DNA:ta monistetaan |
| G2-vaihe: | Kuvastaa DNA-synteesin ja mitoosin välistä vaihetta |
| M-vaihe: | solut jakautuvat kahteen tytärsoluun |
FACS
Fluoresenssiaktivoitu solulajittelu (FACS) on virtaussytometrian erikoistunut tyyppi. Se tarjoaa menetelmän, jolla heterogeeninen biologisten solujen seos voidaan lajitella kahteen tai useampaan säiliöön solu kerrallaan kunkin solun erityisten valonsironta- ja fluoresenssiominaisuuksien perusteella. Se eroaa virtaussytometriasta siten, että se tarjoaa ainutlaatuisen karakterisoinnin verrattuna pelkkään solujen laskemiseen ja lajitteluun. On tavallista, että nämä kaksi periaatetta toimivat rinnakkaiskarakterisointityyppisessä prosessissa, joka tarjoaa täydellisen laadullisen ja määrällisen lähestymistavan virtaussytometriseen analyysiin.
Virtaussytometrinen prosessi:
Solususpensio viedään kapean, nopeasti virtaavan nestevirran keskelle. Virtaus on järjestetty siten, että solujen välillä on suuri ero niiden halkaisijaan nähden. Värähtelevä mekanismi pakottaa soluvirran hajoamaan yksittäisiksi pisaroiksi. Järjestelmä on säädetty siten, että todennäköisyys, että yhtä pisaraa kohti on enemmän kuin yksi solu, on pieni. Juuri ennen kuin virta hajoaa pisaroiksi, virtaus kulkee fluoresenssimittausaseman läpi, jossa kunkin solun kiinnostava fluoresenssiominaisuus mitataan.
Sähköinen latausrengas sijoitetaan juuri siihen kohtaan, jossa virta hajoaa pisaroiksi. Renkaaseen asetetaan varaus välittömästi edeltävän fluoresenssin intensiteettimittauksen perusteella, ja vastakkainen varaus vangitaan pisaraan, kun se irtoaa virrasta. Varautuneet pisarat putoavat sitten sähköstaattisen poikkeutusjärjestelmän läpi, joka ohjaa pisarat säiliöihin niiden varauksen perusteella. Joissakin järjestelmissä varaus kohdistetaan suoraan virtaukseen, ja irtoavaan pisaraan jää samanmerkkinen varaus kuin virtaukseen. Virta palautetaan neutraaliksi pisaran irtoamisen jälkeen.
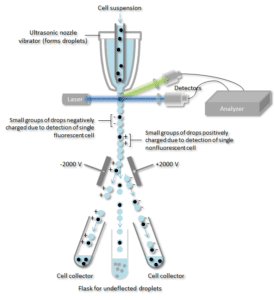
Tietylle solupintaproteiinille spesifinen vasta-aine yhdistetään fluoresoivaan molekyyliin ja lisätään sitten soluseokseen. Seuraava vaihe on fluoresenssiprosessi, kun taas, tietyt solut kulkevat lasersäteen läpi niitä seurataan. Yksittäistä solua sisältäville pisaroille annetaan positiivinen tai negatiivinen varaus sen perusteella, onko solulla fluoresenssilla merkitty vasta-aine. Yksittäistä solua sisältävät pisarat havaitaan sähkökentän avulla ja ohjataan erillisiin keräysputkiin niiden varauksen mukaan, jolloin fluoresoivalla vasta-aineella merkityt solut voidaan helposti erottaa toisistaan.
Monivärivirtaussytometria
Monivärivirtaussytometria on käyttökelpoinen tekniikka tutkittaessa sekoittuneita solupopulaatioita, kuten veri- ja kudossoluja ihmis- ja eläinnäytteissä. Yleensä tietty solutyyppi merkitään fluoresoivalla väriaineella (markkerilla), kuten fluorofoorilla tai propidiumjodidilla. Mahdollisuus käyttää useita fluoresoivia merkkiaineita samanaikaisesti mahdollistaa useiden solutyyppien tunnistamisen sekä toiminnalliset merkkiaineet, jotka kuvaavat kutakin näytettä tarkemmin. On olemassa erikoislaitteita, joilla voidaan mitata yli 12 väriä 3,4 . Näitä fluoresoivia väriaineita ja merkkiaineita mitataan laserista lähtevän valon eri aallonpituuksilla, jotta ne voidaan lajitella yksittäisen solutyypin mukaan. Kukin merkkiaine herätetään tietyllä valon aallonpituudella, jotta ne voidaan erottaa toisistaan, kun käytetään useita merkkiaineita.
Tyypillisen värjäyspaneelin mukauttaminen 4-6 väristä yli 12 väriin ei ole pelkkä ”plug and play” -kysymys, vaan sitä on lähestyttävä systemaattisesti, jotta värjäyspaneelissa saavutetaan onnistuneet parametrit. Paneelin suunnittelun perusperiaatteet toimivat parhaiten käyttöä edeltävän tutkimuksen perusteella. Toisin sanoen valmistautuminen on avainasemassa jo värjäysindeksiin viittaamisen alkuvaiheessa, kun on kyse fluorokromien tehokkaasta yhteensovittamisesta kirkkauden mukaan5.
Virtaussytometriavinkki:
Käytä hieman aikaa virtaussytometrisi hienovaraisen vivahteen ymmärtämiseen ennen primaarivasta-ainepaneelin suunnittelua. Keskity siihen, missä järjestelmässä voidaan tehdä herkimmät mittaukset. On muutakin kuin pelkkä fluoresenssin intensiteetti.
Harkitse vähemmän kirkkaan fluorokromin korvaamista kanavavirheiden välttämiseksi.
Virtaussytometriamenetelmien yleiset sovellukset
Virtaussytometria on olennainen osa useita kliinisiä alueita, mukaan lukien diagnoosit, hoitosuunnitelmat ja systeemiset sairaudet, olivatpa ne sitten staattisia tai eteneviä. Kun opimme lisää virtaussytometrian käytön käytännön sovelluksista, tietopohja laajenee entisestään. Nyt tutkijat ovat innostuneempia kuin koskaan aikaisemmin siitä, että he voivat oppia lisää tiettyjen sairauksien ja tilojen monimutkaisuudesta. Se on johtanut nopeaan muutokseen kuvioidussa diagnosoinnissa ja muuttanut radikaalisti lääketieteellisiä lähestymistapoja sairauksien, kuten syövän, hoidossa6.
Virtaussytometriamenetelmä liittyy usein muihin kattaviin testausmalleihin, kuten morfologiseen tutkimukseen. Monissa tapauksissa hematologiset kasvaimet kuvaavat erityisiä morfologisia muutoksia, ja virtaussytometria tarjoaa suuremman spesifisyyden ja auttaa patologeja laajentamaan kudospoikkeavuuksia tai muita pitkälle edenneitä sairauksia. Virtaussytometria voi joissakin tapauksissa ennalta määrittää syövän uusiutumisen ennen morfologisten muutosten havaitsemista7.
Muutamia tärkeimpiä sovelluksia, joita käytetään nykyaikaisissa kliinisissä sekä terapeuttisissa että tutkimussuuntautuneissa tilanteissa, ovat mm. seuraavat:
- Proteiinien ilmentyminen – koko solussa, jopa ytimessä
- Proteiinien translaation jälkeiset modifikaatiot – sisältää pilkotut ja fosforyloidut proteiinit
- RNA – mukaan lukien sekä miRNA, ja mRNA-transkriptiot
- Solun terveydentila – apoptoottisten solujen tai solukuoleman havaitseminen
- Solusyklin tila – tarjoaa tehokkaan työkalun G0/G1-vaiheessa olevien solujen arvioimiseksi verrattuna S-vaiheeseen, G2-vaiheeseen tai polyploidiaan, mukaan lukien solujen proliferaation ja aktivaation analysointi
- Erillisten solujoukkojen tunnistaminen ja luonnehdinta heterogeenisessa näytteessä – mukaan lukien keskushermoston muistisolujen erottaminen uupuneista T-soluista tai säätelytoimintaa harjoittavista T-soluista
Päättely
Virtaussytometrian perusperiaatteet eivät ole juurikaan muuttuneet viimeisen vuosikymmenen aikana, mutta tekniikan käyttösovellukset ovat kehittyneet paljon. Virtaussytometrian perusteet ovat olleet johdonmukaisia sen päätehtävän kanssa, joka on yksittäisten solujen tai hiukkasten tutkiminen virrassa laserilla, kun solut liikkuvat paikallaan olevien ilmaisimien ohi. Sytometreillä havaitaan yhä useampia fluoresenssivärejä sekä nopeaa lajittelua ja analyysitoimintoja8.
Virtaussytometrialla on keskeinen asema molekyylitutkimuksessa, ja se kehittyy edelleen nopeasti. Markkinoilla on useita kaupallisia virtaussytometrejä. Ne toimivat yleensä samalla perusperiaatteella, mutta niiden suunnittelussa sekä linjausta ja muiden komponenttien integrointia koskevissa käsitteissä on merkittäviä eroja.
Pian näköpiirissä on 3D-laitteisto, joka otetaan käyttöön ja sisällytetään NanoCellect Biomedicalin tuottamaan hybridiomisteiseen laitteeseen, WOLF Cell Sorteriin. Voimme myös odottaa kapeakirjoisten fluoresoivien koettimien kehittämistä, molekyylibiologisten tekniikoiden integrointia virtaussytometriaan ja soluvapaiden merkkiaineiden, kuten sytokiinien, arviointia, jotka ovat keskeisiä osatekijöitä virtaussytometrisen analyysin ja solumääritystekniikan jatkuvassa kehityksessä.
Lähteet:
1 http://clinchem.aaccjnls.org/content/46/8/1221
2 https://pubmed.ncbi.nlm.nih.gov/18615596-flow-cytometry-histograms-transformations-resolution-and-display/
3 https://onlinelibrary.wiley.com/doi/full/10.1002/cyto.a.20959
4 https://currentprotocols.onlinelibrary.wiley.com/doi/abs/10.1002/cpim.26
5 https://www.nature.com/articles/nprot.2006.250
6 https://pubmed.ncbi.nlm.nih.gov/19967915-immunophenotypic-analysis-of-bone-marrow-b-lymphocyte-precursors-hematogones-by-flow-cytometry/
7 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4803461/
8 https://link.springer.com/protocol/10.1385/0-89603-150-0:543