Generaattinen nimi: fluosinonidi
Dosoitusmuoto: Lidex-geeli: Geeli
Lääketieteellisesti tarkistanut Drugs.com. Päivitetty viimeksi 22. kesäkuuta 2020.
- Yleiskatsaus
- Haittavaikutukset
- Adostus
- Profiili
- Vuorovaikutukset
- Lisätiedot
Vastaanotto vain
Lidex-tavaramerkki Lidexin valmistusnimi on lopetettu Yhdysvalloissa.S. Jos FDA on hyväksynyt tämän valmisteen geneeriset versiot, saatavilla voi olla geneerisiä vastineita.
- Lidex Kuvaus
- Lidex – Kliininen farmakologia
- Farmakokinetiikka
- Lidexin käyttöaiheet ja käyttö
- Vasta-aiheet
- Varotoimet
- Yleistä
- Tietoa potilaalle
- Laboratoriokokeet
- Karsinogeneesi, mutageneesi ja hedelmällisyyden heikentyminen
- Raskausluokka C
- Imettävät äidit
- Pediatrinen käyttö
- Haittavaikutukset
- Yliannostus
- Lidexin annostus ja antotapa
- Miten Lidexiä annetaan
- Tiheästi kysyttyjä kysymyksiä
- Lisätietoa Lidexistä (fluosinonidi paikallisesti)
- Kuluttajan resurssit
- Ammattilaislähteet
- Hoito-oppaat
Lidex Kuvaus
Lidex® (fluosinonidi) geeli 0,05 % on tarkoitettu paikalliseen antoon. Vaikuttava aine on kortikosteroidi fluosinonidi, joka on fluosinoloniasetonidin 21-asetaattiesteri ja jolla on kemiallinen nimi pregna-1,4-dieeni-3,20-dioni,21-(asetyylioksi)-6,9-difluoro-11-hydroksi-16,17–,(6α,11β,16α)-. Sillä on seuraava kemiallinen rakenne:
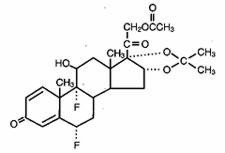
Lidex-geeli sisältää fluosinonidia 0,5 mg/g erikoisvalmisteisessa geelipohjassa, joka koostuu karbomeeri 940:stä, edetaattidinatriumista, popyyligallaatista, propyleeniglykolista, natriumhydroksidista ja/tai suolahaposta (pH:n säätöön) ja vedestä (puhdistettu). Tämä kirkas, väritön, tiksotrooppinen kantaja-aine on rasvaton, värjäämätön ja täysin veteen sekoittuva.
Tässä formulaatiossa vaikuttava aine on täysin liuoksena.
Lidex – Kliininen farmakologia
Topikaalisilla kortikosteroideilla on yhteisiä tulehdusta, kutinaa ja verisuonia supistavia vaikutuksia.
Topikaalisten kortikosteroidien tulehdusta estävän vaikutuksen mekanismi on epäselvä. Erilaisia laboratoriomenetelmiä, mukaan lukien vasokonstriktoriset määritykset, käytetään vertailemaan ja ennustamaan paikallisesti käytettävien kortikosteroidien tehoja ja/tai kliinistä tehoa. On jonkin verran näyttöä siitä, että verisuonia supistavan tehon ja terapeuttisen tehon välillä on tunnistettava korrelaatio ihmisellä.
Farmakokinetiikka
Topikaalisten kortikosteroidien perkutaanisen imeytymisen laajuus määräytyy monien tekijöiden mukaan, mukaan lukien kantaja-aine, epidermaalisen esteen eheys ja okklusiivisten sidosten käyttö.
Topikaaliset kortikosteroidit voivat imeytyä normaalista ehjästä ihosta. Tulehdus ja/tai muut sairausprosessit ihossa lisäävät perkutaanista imeytymistä. Oklusiiviset sidokset lisäävät merkittävästi ajankohtaisten kortikosteroidien perkutaanista imeytymistä. Näin ollen okklusiiviset sidokset voivat olla arvokas terapeuttinen lisä resistenttien dermatoosien hoidossa (ks. DOSAGE AND ADMINISTRATION).
Kun paikallisesti käytettävät kortikosteroidit ovat imeytyneet ihon läpi, ne kulkevat farmakokineettisiä reittejä pitkin, jotka ovat samanlaisia kuin systeemisesti annosteltavat kortikosteroidit. Kortikosteroidit sitoutuvat vaihtelevassa määrin plasman proteiineihin. Kortikosteroidit metaboloituvat pääasiassa maksassa ja erittyvät sitten munuaisten kautta. Osa paikallisesti käytettävistä kortikosteroideista ja niiden metaboliiteista erittyy myös sappeen.
Lidexin käyttöaiheet ja käyttö
Lidex-geeli on tarkoitettu kortikosteroidiin reagoivien ihottumien tulehduksellisten ja kutisevien ilmenemismuotojen lievittämiseen.
Vasta-aiheet
Topikaaliset kortikosteroidit ovat vasta-aiheisia niille potilaille, joilla on todettu yliherkkyyttä valmisteen jollekin aineosalle.
Varotoimet
Yleistä
Topikaalisten kortikosteroidien systeeminen imeytyminen on joillakin potilailla aiheuttanut palautuvaa hypotalamus-aivolisäke-lisämunuais-akselin (HPA-akselin) suppressiota, Cushingin oireyhtymän ilmenemismuotoja, hyperglykemiaa ja glukosuriaa.
Edellytyksiä, jotka lisäävät systeemistä imeytymistä, ovat voimakkaampien steroidien levittäminen, käyttö suurille pinta-aloille, pitkäaikainen käyttö ja okklusiivisten sidosten lisääminen.
Potilaita, jotka saavat suuren annoksen voimakasta paikallista steroidia, jota levitetään suurelle pinta-alalle tai okklusiivisen sidoksen alle, on siksi arvioitava määräajoin sen varalta, että on viitteitä HPA-akselin suppressiivisesta vaikutuksesta virtsan vapaan kortisolin ja ACTH:n stimulaatiokokeiden avulla. Jos HPA-akselin suppressiota havaitaan, lääke on yritettävä vetää pois, annostelutiheyttä on vähennettävä tai tilalle on vaihdettava vähemmän voimakas steroidi.
HPA-akselin toiminta palautuu yleensä nopeasti ja täydellisesti, kun lääke lopetetaan. Harvoin voi esiintyä steroidien vieroitusoireita, jolloin tarvitaan täydentävää systeemistä kortikosteroidia.
Lapset saattavat imeä suhteellisesti suurempia määriä paikallisia kortikosteroideja ja ovat siten alttiimpia systeemiselle toksisuudelle (ks. VAROITUKSET-Lasten käyttö). Jos ärsytystä kehittyy, paikallisesti käytettävät kortikosteroidit on lopetettava ja aloitettava asianmukainen hoito.
Kuten minkä tahansa paikallisesti käytettävän kortikosteroidivalmisteen kohdalla, pitkäaikainen käyttö voi aiheuttaa ihon ja ihonalaisten kudosten surkastumista. Kun sitä käytetään intertriginoosi- tai fleksioalueilla tai kasvoilla, tätä voi esiintyä jopa lyhytaikaisessa käytössä.
Jos esiintyy dermatologisia infektioita, on aloitettava asianmukaisen sienilääkkeen tai antibakteerisen aineen käyttö. Jos suotuisaa vastetta ei ilmene nopeasti, kortikosteroidin käyttö on lopetettava, kunnes infektio on saatu riittävästi hallintaan.
Tietoa potilaalle
Potilaille, jotka käyttävät paikallisesti käytettäviä kortikosteroideja, on annettava seuraavat tiedot ja ohjeet:
- Tätä lääkettä on käytettävä lääkärin ohjeiden mukaisesti. Se on tarkoitettu vain ulkoiseen käyttöön. Vältä kosketusta silmien kanssa.
- Potilaita on neuvottava olemaan käyttämättä tätä lääkettä muuhun sairauteen kuin siihen, johon se on määrätty.
- Hoitoa saavaa ihoaluetta ei saa sitoa tai muulla tavoin peittää tai kääriä okklusiiviseksi, ellei lääkäri ole määrännyt.
- Potilaiden tulee ilmoittaa kaikista merkkeistä paikallisista haittavaikutuksista, erityisesti okklusiivisen sidoksen alla.
- Pediatristen potilaiden vanhempia tulee neuvoa olemaan käyttämättä tiukasti istuvia vaippoja tai muovihousuja lapselle, jota hoidetaan vaippa-alueella, koska nämä vaatteet voivat olla okklusiivisia sidoksia.
Laboratoriokokeet
Seuraavista kokeista voi olla apua HPA-akselin suppression arvioinnissa:
Virtsan vapaan kortisolin testi
ACTH-stimulaatiotesti
Karsinogeneesi, mutageneesi ja hedelmällisyyden heikentyminen
Pitkäkestoisia eläinkokeita ei ole tehty paikallisesti käytettävien kortikosteroidien karsinogeenisen potentiaalin tai hedelmällisyyteen kohdistuvan vaikutuksen arvioimiseksi.
Tutkimukset mutageenisuuden määrittämiseksi prednisolonilla ja hydrokortisonilla ovat antaneet negatiivisia tuloksia.
Raskausluokka C
Kortikosteroidit ovat yleensä teratogeenisia koe-eläimillä, kun niitä annetaan systeemisesti suhteellisen pieninä annoksina. Voimakkaampien kortikosteroidien on osoitettu olevan teratogeenisia iholle annostelun jälkeen koe-eläimillä. Raskaana olevilla naisilla ei ole riittäviä ja hyvin kontrolloituja tutkimuksia paikallisesti käytettyjen kortikosteroidien teratogeenisistä vaikutuksista. Tämän vuoksi paikallisesti käytettäviä kortikosteroideja saa käyttää raskauden aikana vain, jos mahdollinen hyöty oikeuttaa sikiölle mahdollisesti aiheutuvan riskin. Tämän luokan lääkkeitä ei tule käyttää laajasti raskaana oleville potilaille, suuria määriä tai pitkiä aikoja.
Imettävät äidit
Ei tiedetä, voisiko kortikosteroidien paikallinen anto johtaa riittävään systeemiseen imeytymiseen, joka tuottaisi havaittavia määriä rintamaitoon. Systeemisesti annetut kortikosteroidit erittyvät rintamaitoon määriä, joilla ei todennäköisesti ole haitallisia vaikutuksia imeväiseen. Varovaisuutta on kuitenkin noudatettava, kun paikallisesti käytettäviä kortikosteroideja annetaan imettävälle naiselle.
Pediatrinen käyttö
Pediatriset potilaat saattavat osoittaa suurempaa alttiutta paikallisesti käytettävien kortikosteroidien aiheuttamalle HPA-akselin suppressiolle ja Cushingin oireyhtymälle kuin varttuneemmilla potilailla suuremman ihopinta-alan ja ruumiinpainon välisen suhteen vuoksi.
Hypotalamus-aivolisäke-lisämunuaisen (HPA) akselin suppressiota, Cushingin oireyhtymää ja kallonsisäistä hypertensiota on raportoitu lapsilla, jotka saavat paikallisia kortikosteroideja. Lisämunuaisen suppression ilmenemismuotoja lapsilla ovat lineaarinen kasvun hidastuminen, viivästynyt painonnousu, alhaiset plasman kortisolipitoisuudet ja ACTH-stimulaatiovasteen puuttuminen. Kallonsisäisen hypertension ilmenemismuotoja ovat fontanellien pullistuminen, päänsärky ja molemminpuolinen papillödeema.
Topikaalisten kortikosteroidien antaminen lapsille on rajoitettava pienimpään määrään, joka sopii yhteen tehokkaan hoito-ohjelman kanssa. Krooninen kortikosteroidihoito voi haitata lasten kasvua ja kehitystä.
Haittavaikutukset
Seuraavia paikallisia haittavaikutuksia on raportoitu harvoin paikallisesti käytettävien kortikosteroidien yhteydessä, mutta niitä voi esiintyä useammin okklusiivisten sidosten käytön yhteydessä. Nämä reaktiot on lueteltu likimääräisesti vähenevässä esiintymisjärjestyksessä:
| Palaminen | Perioraalinen ihottuma | |
| Kutina | Allerginen kosketusihottuma | |
| Irrotus | Ihon maseroituminen | |
| Kuivuus | Sekundaarinen infektio | |
| Follikuliitti | Ihon atrofia | |
| Hypertrichosis | Striae | |
| Acneiform eruptions | Miliaria | |
| Hypopigmentaatio |
Yliannostus
Topikaalisesti käytettävät kortikosteroidit voivat imeytyä riittävinä määrinä tuottamaan systeemisiä vaikutuksia (ks. VAROITUKSET).
Lidexin annostus ja antotapa
Lidex-geeliä levitetään yleensä ohuena kalvona sairastuneelle alueelle kahdesta neljään kertaan vuorokaudessa tilan vaikeusasteesta riippuen.
Okklusiivista sidosta voidaan käyttää psoriasiksen hoidossa tai uusiutuvien tilojen hoidossa.
Jos infektio kehittyy, okklusiivisten sidosten käyttö tulee lopettaa ja aloittaa asianmukainen mikrobilääkitys.
Miten Lidexiä annetaan
Lidex® (fluosinonidi) geeli 0.05 % toimitetaan
15 g:n tuubissa – NDC 99207-507-13
30 g:n tuubissa – NDC 99207-507-14
60 g:n tuubissa – NDC 99207-507-17
Varastoidaan huoneenlämmössä 15°-30°C (59°-86°F).
Valmistettu:
MEDICIS, The Dermatology Company®
Scottsdale, AZ 85258
Huhtikuu 2001
IN…5071/S
| Lidex fluosinonidigeeli |
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
.
| Pakkaus | |||
| # | Erätekoodi | Pakkauksen kuvaus | |
| 1 | NDC:99207-507-13 | 15 g (15 GRAM) 1 PUTKISSA | |
| 2 | NDC:99207-507-14 | 30 g (30 GRAM) 1 PUTKISSA | |
| 3 | NDC:99207-507-17 | 60 g (60 GRAM) 1 PUTKISSA | |
Etiketöijä:
Etiketöijä. MEDICIS
Tiheästi kysyttyjä kysymyksiä
- Käytetäänkö sitä hiustenlähtöön?
- Mikä on fluosinonidivoiteen korvike?
- Onko fluosinonidi sienilääkevoide?
- Kuinka kauan fluosinonidia tulisi käyttää?
- Mihin fluosinonidivoide sopii?
- Voidaanko fluosinonidia käyttää myrkkyihottuman hoitoon?
- Onko se steroidi?
- Onko se antibiootti?
Lisätietoa Lidexistä (fluosinonidi paikallisesti)
- Haittavaikutukset
- Raskauden tai imetyksen aikana
- Asietiedot
- Lääkkeiden yhteisvaikutukset
- 8 Arvostelua
- Lääkevalmisteen saatavuus
- Lääkevalmisteluokka:
Kuluttajan resurssit
- Lukemisto
- Lidex Mild (syventävä lukemisto)
- Lidex Regular (syventävä lukemisto)
- Lidex Regular (syventävä lukemisto)
Ammattilaislähteet
- Reseptitiedot
- Lidex ajankohtainen liuos (FDA)
- Lidex voide (FDA)
Muut merkit Vanos, Lidex-E
Hoito-oppaat
- Atopic Dermatitis
- Eczema
- Dermatiitti
- Psoriaasi
Lääketieteellinen vastuuvapauslauseke