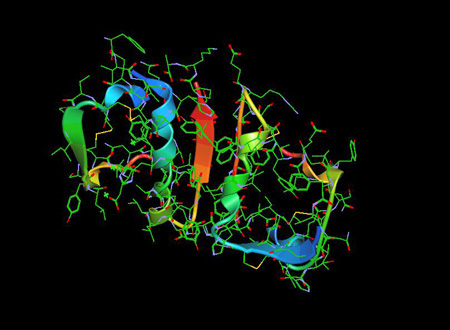
Insuliinimolekyyli 1ZNI PDB on haimahormoni, jolla on olennainen rooli verensokerin sekä rasva- ja hiilihydraattiaineenvaihdunnan säätelyssä.
Insuliinimolekyylin kolmiulotteisen rakenteen saamiseksi Jsmol-ohjelmalla klikkaa
Yleiskatsaus
Insuliini on haiman saarekkeen β-solujen tuottama polypeptidihormoni, joka vastaa ensisijaisesti veren glukoosipitoisuuden säätelystä sekä hiilihydraattien ja lipidien varastoinnista. Tyypin 1 diabetes johtuu insuliinin riittämättömästä tuotannosta, joka johtuu insuliinia tuottavien haiman saarekkeiden β-solujen tuhoutumisesta ja häviämisestä. Tyypin 2 diabetes johtuu suhteellisesta insuliiniresistenssistä. Sitä pidetään elimistön tärkeimpänä anabolisena hormonina. (1)
Proteiinin rakenne
Insuliinin todettiin olevan polypeptidi vuonna 1928 ja sen aminohapposekvenssi tunnistettiin vuonna 1952. Se on itse asiassa dipeptidi, joka sisältää A- ja B-ketjuja, jotka ovat yhteydessä toisiinsa disulfidisilloilla, sisältää 51 aminohappoa ja sen molekyylipaino on 5802. Sen isosähköinen piste on pH 5,5,5. A-ketju koostuu 21 aminohaposta ja B-ketju 30 aminohaposta. A-ketjussa on N-terminaalinen spiraali, joka on yhdistetty antiparalleeliseen C-terminaaliseen spiraaliin; B-ketjussa on keskimmäinen spiraalisegmentti. Nämä kaksi ketjua on yhdistetty kahdella disulfidisidoksella, jotka yhdistävät A-ketjun N- ja C-terminaaliset kierteet B-ketjun keskuskierteeseen. Pro-insuliinissa yhdistävä peptidi yhdistää A-ketjun N-terminaalin B-ketjun C-terminaaliin.
Selkärankaisten keskuudessa insuliinin aminohapposekvenssi on vahvasti konservoitunut. Naudan insuliini eroaa ihmisen insuliinista vain kolmessa aminohappojäännöksessä ja sian insuliini yhdessä. Jopa joistakin kalalajeista peräisin oleva insuliini on riittävän samankaltainen ihmisen insuliinin kanssa, jotta se on kliinisesti tehokasta ihmisessä. Joidenkin selkärangattomien eläinten insuliini on järjestykseltään melko samanlainen kuin ihmisen insuliini, ja sillä on samanlaisia fysiologisia vaikutuksia. Erilaisten lajien insuliinisekvensseissä havaittu vahva homologia viittaa siihen, että se on säilynyt suuressa osassa eläinten evoluutiohistoriaa. Proinsuliinin C-peptidi eroaa kuitenkin paljon enemmän lajien välillä; sekin on hormoni, mutta toissijainen.
Insuliinia tuotetaan ja varastoidaan elimistössä heksameerina (kuuden insuliinimolekyylin yksikkö), kun taas aktiivinen muoto on monomeeri. Heksameeri on inaktiivinen muoto, jolla on pitkäaikainen stabiilisuus ja joka toimii keinona pitää erittäin reaktiivinen insuliini suojattuna, mutta silti helposti saatavilla. Heksaameri-monomeeri-muunnos on yksi injektiona käytettävien insuliinivalmisteiden keskeisistä tekijöistä. Heksaameeri on paljon vakaampi kuin monomeeri, mikä on toivottavaa käytännön syistä; monomeeri on kuitenkin paljon nopeammin reagoiva lääkeaine, koska diffuusionopeus on kääntäen verrannollinen hiukkaskokoon.
Insuliinin erityksen mekanismit
Insuliinia tuotetaan haimassa ja Brockmannin elimistössä (joillakin kaloilla), ja sitä vapautuu, kun mikä tahansa useista ärsykkeistä havaitaan. Näitä ärsykkeitä ovat esimerkiksi nautittu proteiini ja sulatetusta ruoasta veressä oleva glukoosi. Hiilihydraatit voivat olla yksinkertaisten sokerien polymeerejä tai itse yksinkertaisia sokereita. Jos hiilihydraatit sisältävät glukoosia, tuo glukoosi imeytyy verenkiertoon ja veren glukoosipitoisuus alkaa nousta. Kohdesoluissa insuliini käynnistää signaalinsiirron, jonka vaikutuksesta glukoosin otto ja varastointi lisääntyvät. Lopuksi insuliini hajoaa, jolloin vaste päättyy.
Nisäkkäillä insuliini syntetisoidaan haimassa beetasoluissa. Miljoonasta kolmeen miljoonaan haiman saareketta muodostavat haiman endokriinisen osan, joka on ensisijaisesti eksokriininen rauhanen. Endokriinisen osan osuus haiman kokonaismassasta on vain 2 %. Haiman saarekkeiden sisällä beetasolut muodostavat 65-80 % kaikista soluista.
Insuliinin vapautuminen
Verensokerin säätely Langerhansin saarekkeiden beetasolut vapauttavat insuliinia kahdessa vaiheessa. Ensimmäisen vaiheen vapautuminen käynnistyy nopeasti vastauksena kohonneeseen veren glukoosipitoisuuteen, ja se kestää noin 10 minuuttia. Toinen vaihe on jatkuva, hidas, sokerista riippumaton vapautuminen hiljattain muodostuneista rakkuloista, ja se on suurimmillaan 2-3 tunnin kuluttua. Vähentynyt ensimmäisen vaiheen insuliinin vapautuminen voi olla varhaisin havaittava beetasoluvika, joka ennustaa tyypin 2 diabeteksen puhkeamista. Ensimmäisen vaiheen vapautuminen ja insuliiniherkkyys ovat toisistaan riippumattomia diabeteksen ennustetekijöitä.
VEREN INSULIINIPITOISUUS
Veren insuliinipitoisuus voidaan mitata kansainvälisinä yksikköinä, kuten µIU/ml, tai molaarisina pitoisuuksina, kuten pmol/l, jolloin 1 µIU/ml vastaa 6,945 pmol/l. Tyypillinen veren insuliinipitoisuus aterioiden välillä on 8-11 μIU/ml (57-79 pmol/L).
Vaikutusmekanismi – Insuliinin signaalinsiirto
Signaalinsiirto Insuliinin vaikutukset alkavat sen sitoutumisesta solukalvolla olevaan reseptoriin. Reseptorimolekyyli sisältää α- ja β-alayksikön. Kaksi molekyyliä yhdistyy muodostaen niin sanotun homodimeerin. Insuliini sitoutuu homodimeerin α-alayksiköihin, jotka ovat kohti solunulkoista puolta. β-alayksiköillä on tyrosiinikinaasientsyymiaktiivisuus, joka käynnistyy insuliinin sitoutumisen seurauksena. Tämä aktiivisuus saa aikaan β-alayksiköiden autofosforylaation ja sen jälkeen solun sisällä olevien proteiinien, joita kutsutaan insuliinireseptorin substraateiksi (IRS), fosforylaation. IRS:n fosforylaatio aktivoi signaalinsiirtokaskadin, joka johtaa muiden kinaasien sekä transkriptiotekijöiden aktivoitumiseen, jotka välittävät insuliinin solunsisäisiä vaikutuksia.
Insuliinin fysiologiset vaikutukset
Insuliinin vaikutuksia ihmisen aineenvaihdunnan globaalilla tasolla ovat muun muassa: Tiettyjen aineiden, merkittävimmin glukoosin, solujen saannin lisääntyminen lihaksissa ja rasvakudoksessa (noin kaksi kolmasosaa kehon soluista) DNA:n replikaation ja proteiinisynteesin lisääntyminen aminohappojen saannin ohjauksen kautta Lukuisten entsyymien aktiivisuuden muuttuminen.
Endokannabinoidiaineenvaihdunnan säätelijä. Insuliini on merkittävä endokannabinoidien (EC) aineenvaihdunnan säätelijä, ja insuliinihoidon on osoitettu vähentävän solunsisäisiä EC:itä, 2-arakidonyyliglyserolia (2-AG) ja anandamidia (AEA), mikä vastaa insuliinille herkkiä ilmentymismuutoksia EC-aineenvaihdunnan entsyymeissä. Insuliiniresistenteissä adiposyyteissä insuliinin indusoimien entsyymien ilmentymismallit häiriintyvät tavalla, joka vastaa kohonnutta EC-synteesiä ja vähentynyttä EC:n hajoamista. Tulokset viittaavat siihen, että insuliiniresistentit adiposyytit eivät pysty säätelemään EC-aineenvaihduntaa ja vähentämään solunsisäisiä EC-pitoisuuksia vasteena insuliinistimulaatiolle, jolloin lihavilla insuliiniresistenteillä yksilöillä esiintyy lisääntyneitä EC-pitoisuuksia. Tämä säätelyhäiriö edistää liiallista viskeraalisen rasvan kertymistä ja vähentynyttä adiponektiinin vapautumista vatsan rasvakudoksesta ja edelleen useiden kardiometabolisten riskitekijöiden puhkeamista, jotka liittyvät liikalihavuuteen ja tyypin 2 diabetekseen.
1- Voet D, Voet JG (2011). Biokemia (4. painos). New York: Wiley.
2-Gisela Wilcox (2005) Insulin and Insulin Resistance, Clin Biochem Rev. 2005 May; 26(2): 19-39.
3- Rhoades RA, Bell DR (2009). Lääketieteellinen fysiologia : kliinisen lääketieteen periaatteet (3. painos). Philadelphia: Lippincott Williams & Wilkins. pp. 644-47.
4-Gerich JE (February 2002). ”Onko vähentynyt ensimmäisen vaiheen insuliinin vapautuminen varhaisin havaittava poikkeavuus henkilöillä, joiden kohtalona on kehittää tyypin 2 diabetes?”. Diabetes. 51 (Suppl 1): S117–21. doi:10.2337/diabetes.51.2007.s117. PMID 11815469.
5- Lorenzo C, Wagenknecht LE, Rewers MJ, Karter AJ, Bergman RN, Hanley AJ, Haffner SM (syyskuu 2010). ”Dispositioindeksi, glukoosin tehokkuus ja muuntuminen tyypin 2 diabetekseksi: Insuliiniresistenssin ateroskleroositutkimus (IRAS)”. Diabetes
6- A Dictionary of Units of Measurement Archived 2013-10-28 at the Wayback Machine. Kirjoittanut Russ Rowlett, Pohjois-Carolinan yliopisto Chapel Hillissä. June 13, 2001
7- Iwase H, Kobayashi M, Nakajima M, Takatori T (January 2001). ”Insuliinin ja C-peptidin suhdetta voidaan käyttää eksogeenisen insuliinin yliannostuksen oikeuslääketieteelliseen diagnoosiin”. Forensic Science International. 115 (1-2): 123-27. doi:10.1016/S0379-0738(00)00298-X. PMID 11056282.
8- Xiang Z (kesäkuu 2006). ”Homologisen proteiinirakenteen mallintamisen edistysaskeleet”. Current Protein & Peptide Science. 7 (3): 217-27. doi:10.2174/138920306777452312. PMC 1839925. PMID 16787261.
9- Zagrovic B, Snow CD, Shirts MR, Pande VS (marraskuu 2002). ”Pienen alfa-helikaalisen proteiinin taittumisen simulointi atomistisella tarkkuudella käyttäen maailmanlaajuisesti hajautettua laskentaa”. Journal of Molecular Biology. 323 (5): 927-37.
10-D’Eon TM, Pierce KA, Roix JJ, Tyler A, Chen H, Teixeira SR (May 2008). ”Adiposyyttien insuliiniresistenssin rooli lihavuuteen liittyvien endokannabinoidien nousujen patogeneesissä”. Diabetes. 57 (5): 1262-68.
11- Di Marzo V (elokuu 2008). ”Endokannabinoidijärjestelmä lihavuudessa ja tyypin 2 diabeteksessa”. Diabetologia. 51 (8): 1356-67. doi:10.1007/s00125-008-1048-2. PMID 18563385.