Kutaaninen angiosarkooma on yksi huonoimmista ennusteista kaikista ihokasvaimista. Se on hyvin aggressiivinen, ja sen paikallinen uusiutumisaste on korkea. Viiden vuoden eloonjäämisprosentti on useimpien tutkimusten mukaan 12-34 %,1,2 mutta se voi olla jopa 62 %.3 Toisin kuin muissa sarkoomissa, erilaistumisasteen ei ole todettu olevan yhteydessä cutaanisen angiosarkooman ennusteeseen.4
Kutaanisen angiosarkooman klassinen muoto on huonosti määritelty mustelman kaltainen ödeemaattinen leesio, jolla on varhaisessa vaiheessa pitkälti indolentti kliininen kuva. Sitä esiintyy iäkkäiden potilaiden kasvoissa tai päänahassa (Wilson-Jonesin angiosarkooma), ja se muodostaa noin 50 % kaikista primaarisista ihon angiosarkoomista.5-8 Kaksi muuta tyypillistä angiosarkooman muotoa ovat Stewart-Trevesin oireyhtymä, joka kehittyy pitkään jatkuneen lymfaturvotuksen alueille ja on erityisen yleinen radikaalin mastektomian läpikäyneillä naisilla,9-11ja sädehoidon jälkeinen angiosarkooma, joka kehittyy sädehoidetun ihon alueille, erityisesti rintalihaksen seudulle niillä naisilla, joilla on aiemmin todettu sädehoidettu rintasyöpä.12 12-15
Kutaanisen angiosarkooman histopatologinen ulkonäkö vaihtelee suhteellisen erilaistuneista muodoista, joissa on tunnistettavia verisuonitiloja, jotka ovat näkyvien endoteelisolujen peittämiä ja joissa on jonkin verran epätyypillisyyttä ja kollageeninippuja pilkkova infiltraatiokuvio, kiinteämpiin, hyvin erilaistumattomiin muotoihin, jotka koostuvat spindeli- tai epiteelisoluista, joissa on huomattavasti enemmän epätyypillisyyttä ja pleomorfismia ja joissa mitoosien määrä on suurempi. Verisuonitilat ovat harvinaisia, ja kasvaimet voivat joskus jäljitellä karsinoomaa.
Kutaanisen angiosarkooman pääasiallinen hoito – ja ainoa hoito, joka on potentiaalisesti parantava, jos taudista vapaat marginaalit saavutetaan – on kirurginen poistoleikkaus, jossa on leveät marginaalit ja jota seuraa paikallinen sädehoito ja joidenkin kirjoittajien mielestä jopa alueellisten imusolmukkeiden sädehoito.6 Useimmissa tapauksissa taudista vapaiden marginaalien saavuttaminen ei olekaan kuitenkaan helppoa laajojen subkliinisten levinneisyystilojen vuoksi. Lisäksi nämä kasvaimet ovat usein multifokaalisia. Kemoterapialla on puhtaasti palliatiivinen merkitys ihon angiosarkooman hoidossa.
Vaikka ihon angiosarkooma on harvinainen (alle 1 % kaikista sarkoomista), useimmat angiosarkoomatapaukset ovat peräisin ihosta. Vähäisen esiintyvyytensä vuoksi ihon angiosarkoomat sisällytetään sarjoihin, joissa käsitellään viskeraalisia tai luun angiosarkoomia, joiden ennuste on vielä synkempi.1 Kirjallisuudessa on näin ollen vain vähän laajoja sarjoja ihon angiosarkoomista, koska pitkäaikaisia, yhtenäisiä tapauksia ei ole riittävästi.2,4,5,7,16 Angiosarkooman hoito on lisäksi usein masentavaa ennen kaikkea pitkälle edenneissä tautitapauksissa, joiden ennuste on erittäin huono, vaikka alusta alkaen käytetään aggressiivista hoitoa. Ihon angiosarkooman hoitoon liittyvien vaikeuksien ja saatavilla olevan kirjallisuuden vähäisyyden vuoksi tutkimme kaikki Valenciassa, Espanjassa sijaitsevassa Instituto Valenciano de Oncología (IVO) -laitoksessa hoidetut ihon angiosarkoomatapaukset selvittääksemme ennusteeseen mahdollisesti liittyviä kliinisiä, histologisia ja hoitoon liittyviä tekijöitä. Tätä varten kävimme läpi sairauskertomukset ja kliiniset löydökset etsiessämme eksploratiivisia tietoja, jotka voisivat toimia ohjenuorana varhaista diagnoosia varten, sillä potilailla, joilla tauti on varhaisessa vaiheessa ja joiden kasvaimet ovat pieniä, on huomattavasti paremmat eloonjäämismahdollisuudet.
Aineisto ja menetelmät
Toimme retrospektiivisen havainnointitutkimuksen kaikista IVO:ssa tammikuun 2000 ja joulukuun 2015 välisenä aikana käsitellyistä cutaanisen angiosarkooman tapauksista. Kaikki kootut tiedot poimittiin potilaiden sairauskertomuksista, patologian osaston biopsia-arkistosta ja osastomme valokuva-arkistosta. Alun perin tunnistetuista 20 tapauksesta neljä jouduttiin jättämään pois: Toinen, koska ei ollut riittävästi materiaalia sen määrittämiseksi, oliko kasvain hemangioendoteliooma vai angiosarkooma, ja kaksi, koska kasvaimet eivät olleet primaarisia angiosarkoomia. Nämä kaksi kasvainta oli alun perin luokiteltu ihon angiosarkoomaksi, koska kaikki histologiset objektilasit osoittivat, että rinta oli mukana iholla. Lohkoja tarkistettaessa havaitsimme kuitenkin, että molemmissa tapauksissa ihon osallistuminen oli toissijaista ja että primaarikasvain sijaitsi rintarauhasen parenkyymissä, josta se ulottui ihon yläpuolelle.
Tutkimuksen sisäänottokriteereinä olivat kliiniset löydökset, jotka viittasivat ihon angiosarkoomaan, ja diagnoosin histologinen varmistus biopsianäytteiden hematoksyliini-eosiinivärjäyksellä, jota tukivat immunohistokemialliset tutkimukset, joihin useimmissa tapauksissa sisältyi CD31-, CD34-, D240- ja Ki-67-värjäys.
Kustakin potilaasta tutkittiin seuraavat muuttujat: ikä, sukupuoli, kasvaimen sijainti ja koko, angiosarkooman tyyppi (primaarinen, sädehoidon jälkeinen, lymfedeemaan liittyvä), hoito (leikkaus, sädehoito, solunsalpaajahoito), uusiutuminen, etäpesäkkeet, eloonjääminen ja kuolema. Sädehoidon jälkeisten ja lymfaturvotukseen liittyvien kasvainten osalta kirjattiin myös edellisen kasvaimen tyyppi ja sädehoidon tai lymfaturvotuksen jälkeen kuluneiden vuosien lukumäärä. Histologiset muuttujat, joita analysoitiin, olivat marginaalitilanne, histopatologinen kuvio (vasoformatiivinen, solidi tai sekamuotoinen), vallitseva solutyyppi (epitelioidinen tai karasoluinen), nekroosin esiintyminen (kyllä, ei), invaasion taso (epidermis, dermis, hypodermis, lihakset, luusto), lymfosyyttinen reaktio, infiltraatiokuvio ja mitoosien lukumäärä 10 kenttää kohti.
Tulokset
Tutkimukseen otettiin mukaan 16 ihon angiosarkoomatapausta. Ne vastasivat 11 naista ja 5 miestä, jotka olivat iältään 35-83-vuotiaita (keskiarvo 67 vuotta, mediaani 71 vuotta). Tapauksista kymmenen oli sädehoidon jälkeistä angiosarkoomaa (10 tapausta), viisi oli Wilson-Jonesin angiosarkoomaa ja vain yksi oli imusolmukkeisiin liittyvä angiosarkooma. Yleisin sijaintipaikka oli vartalo (10 tapausta) ja seuraavaksi yleisin pään ja kaulan alue (5 tapausta). Yläraajat olivat mukana vain yhdessä tapauksessa. Pienin kasvaimen koko oli 1 senttimetri ja suurin 50 senttimetriä (keskiarvo 10 senttimetriä, mediaani 6,5 senttimetriä).
Seitsemällä potilaalla oli aiemmin ollut syöpä (rintasyöpä 10 tapauksessa ja seminooma 1 tapauksessa). Lukuun ottamatta yhtä tapausta, jossa oli invasiivinen lobulaarinen karsinooma, kaikki rintasyövät olivat invasiivisia duktaalisia karsinoomia.
Keskimääräinen aika sädehoidon ja angiosarkooman kehittymisen välillä sädehoidon jälkeisen angiosarkooman 10 tapauksessa oli 8,2 vuotta. Vain yksi tapauksista ilmaantui viiden vuoden kuluessa sädehoidosta; loput ilmaantuivat vähintään viisi vuotta myöhemmin.
Neljätoista tapausta hoidettiin kirurgisesti, ja neljässä näistä käytettiin adjuvanttia sädehoitoa. Kahdeksan potilasta sai solunsalpaajahoitoa, ja kahdelle potilaalle tämä oli ensimmäinen ja ainoa hoito.
Doksorubisiinia ja taksolia käytettiin kumpikin neljässä tapauksessa, ifosfamidia kolmessa tapauksessa ja paklitakselia ja dakarbatsiinia yhdessä tapauksessa. Vaste solunsalpaajahoitoon oli huono, ja vaikka lähes kaikki potilaat saivat osittaisen vasteen, tauti eteni kaikissa tapauksissa, ja potilaat kuolivat seurannan aikana (8/8).
Viidellä potilaalla oli etämetastaaseja, jotka useimmissa tapauksissa koskivat useita paikkoja. Yleisimmät paikat olivat keuhkot ja maksa.
Kymmenen potilasta 16:sta kuoli angiosarkoomaan seurannan aikana. Loput 6 potilasta ovat tällä hetkellä vapaita taudista. Keskimääräinen seuranta-aika oli 42,5 kuukautta (mediaani 26 kuukautta; vaihteluväli 7-188 kuukautta).
Histologisesti 8 tapauksella oli kiinteä kasvumalli, 4 tapauksella vasoformatiivinen malli ja 4 tapauksella sekamuotoinen malli. Vallitseva solutyyppi oli epitelioidinen 14 tapauksessa ja karainen vain kahdessa. 6 kasvaimessa havaittiin nekroosia, ja infiltraatiokuvio oli ihonalainen useimmissa tapauksissa (n=10). Neljä tapausta rajoittui dermikseen ja vain kaksi koski lihaksia. Leikkausrajat eivät olleet arvioitavissa kolmessa tapauksessa. Jäljelle jääneistä tapauksista 8:lla oli negatiiviset marginaalit ja 5:llä positiiviset marginaalit. Lymfosyyttinen reaktio oli lievä tai kohtalainen 10 tapauksessa, voimakas 2 tapauksessa ja olematon 4 tapauksessa. 14 tapauksessa, joissa oli lymfosyyttinen reaktio, infiltraatti oli peritumoraalinen 2 tapauksessa, intratumoraalinen 8 tapauksessa ja sekamuotoinen 2 tapauksessa. Keskimäärin 15 mitoosia 10:tä kenttää kohti (vaihteluväli 0-37 mitoosia).
Taulukkoon 1 on koottu keskeisimmät kliiniset ja patologiset tulokset. Taulukossa 2 on yhteenveto eloonjääneiden ja ei-eloonjääneiden vertailun tuloksista.
Kliinisten ja patologisten tulosten poiminta 16:sta ihon angiosarkoomasta.a
| Potilas | Aikä, v | Sukupuoli | Tyyppi | Lokaatio | Koko, cm | Aika Rx:stä lähtien, kk | annos, Gy | Edellinen kasvain | Rintasyöpätyyppi | ||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 78 | V | F | PR | Vasemmanpuoleinen rintasyöpä | 18 | 60 | 46 | Rinta | IDC | |
| 2 | 71 | F | ST | ST | Vasen käsivarsi | 12 | – | – | Rinta | IDC | |
| 3 | 51 | F | PR | Oikea rintalastan alapuolinen alue | 1 | 57 | 50 | Rinta. | IDC | ||
| 4 | 76 | F | F | WJ | Pään ja kaulan alue | 3 | – | – | Ei | . | |
| 5 | 77 | F | PR | Oikea rinta | 1 | 94 | 46 | Rinta | IDC | ||
| 6 | 71 | F | PR | Vasen rinta | 50 | 171 | 48 | Rinta | IDC | ||
| 7 | 48 | 48 | M | PR | Vatsaontelon seinämä | 2 | 96 | 26 | Seminoma | – | |
| 8 | 55 | F | PR | Vasen rinta | 10 | 88 | 46 | Rinta | ILC | ||
| 9 | 69 | F | PR | Vasen rinta | 8 | 143 | 46 | Rinta | IDC | ||
| 10 | 76 | M | WJ | Oikea poski | 6 | – | – | Ei | – | ||
| 11 | 35 | F | PR | Oikea rinta | 12 | 66 | 50 | Rinta | IDC | ||
| 12 | 57 | F | PR | Oikea rinta | 8 | 108 | 50 | Rinta | IDC | ||
| 13 | 68 | M | WJ | Pään ja kaulan alue | 2 | – | – | – | Ei | – | – |
| 14 | 80 | M | M | WJ | Pää ja kaula | 15 | – | – | Ei | – | |
| 15 | 79 | M | WJ | Pää ja kaula | 2 | – | – | – | – Ei | – | |
| 16 | 83 | F | PR | Vasen rinta | 3 | 110 | 50 | Rinta | IDC | ||
| X=67.1 | 11W, 5M | 10 RI, 5 WJ, 1 ST | 9 rinta, 5 pää ja kaula, 1 vatsa, 1 yläraaja | X=10 | X=100.3 | X=45.8 | 10 rintasyöpää, 1 seminooma |
10 rintasyöpää: 9 IDC, 1 ILC |
| Potilas | Kirurg, cm | Hoitona | Kuolema | HP-kuvio | Solutyyppi | Nekroosi | DoI | Mitoosit/mm2 | Selviytyminen, mo | |||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | Kyllä | 0.2 | 13 | Kyllä | 1 | E | Ei | 3 | 7 | 24 | ||
| 2 | Ei | Ei | ns | 3 | Kyllä | 2 | E | Ei | 3 | 3 | 37 | 8 |
| 3 | Ja | 3.5 | 1 | Ei | 1 | E | Ei | 3 | 2 | 29 | ||
| 4 | Kyllä | 2 | 123 | Kyllä | 2 | E | Ei | 3 | 28 | 26 | ||
| 5 | Kyllä | ns. | 1 | Kyllä | 2 | E | Ei | 2 | 14 | 8 | ||
| 6 | Ei | ns. | 3 | Kyllä | 1 | E | Ei | 2 | 0 | 19 | ||
| 7 | Kyllä | ns | 1 | Ei | 3 | E | E | Ei | 3 | 6 | 187 | |
| 8 | Kyllä | ns | 13 | Kyllä | 2 | E | Kyllä | 4 | 6 | 28 | ||
| 9 | Yes | ns | 13 | Kyllä | 3 | E | Kyllä | 3 | 22 | 24 | ||
| 10 | Kyllä | ns | 12 | Kyllä | 2 | E | Kyllä | 3 | 16 | 7 | ||
| 11 | Kyllä | 0.5 | 1 | Ei | 2 | SC | Ei | 3 | 18 | 76 | ||
| 12 | Kyllä | 0 | 13 | Kyllä | 3 | E | Kyllä | 3 | 36 | 26 | ||
| 13 | Kyllä | 2 | 12 | Ei | Ei | 3 | E | Ei | 3 | 3 | 5 | 95 |
| 14 | Kyllä | 2 | 123 | Kyllä | 2 | E | Kyllä | 4 | 17 | 24 | ||
| 15 | Kyllä | 2 | 1 | Ei | Nei | 2 | E | Ja | 2 | 6 | 53 | |
| 16 | Kyllä | 3 | 1 | Ei ole. | 1 | SC | Ei | 2 | 23 | 51 | ||
| 14 kyllä, 2 ei | 1.68 | 14: Qx 4: Rt 8: Qt |
10 kyllä 6 ei |
4 vasof 8 solid 4 mixed |
14 E, 2 SC | 6 kyllä 10 ei |
4 dermis 10 hypodermis 2 lihakset |
X=15 | X=42.8 |
Kuolleet potilaat on lihavoitu.
AS-hoito, angiosarkooman hoito (1, leikkaus ; 2, sädehoito ; 3, solunsalpaajahoito ); DoI, invaasion syvyys (2, dermis; 3, hypodermis; 4, lihas); E, epitelioidinen; HP, histopatologinen (1, verisuontenmuodostuksellinen ; 2,solid; 3, sekamuotoinen); IDC, invasiivinen duktaalinen karsinooma; ILC, invasiivinen lobulaarinen karsinooma; M, mies; ns, ei määritelty; PR, sädehoidon jälkeinen angiosarkooma; Rx, sädehoito; SC, spindlisolu; ST, Stewart-Treves-angiosarkooma; W, nainen; WJ, Wilson-Jones-angiosarkooma: X, keskiarvo.
Muuttujien vertailu eloonjääneiden ja ihon angiosarkoomaan kuolleiden potilaiden välillä.
| Muuttuja | elossa (n=6) | kuollut (n=10) | |
|---|---|---|---|
| Ikä, keskiarvo, v | 61 | 71 | |
| Naiset | 3 | 8 | |
| Miehet | 3 | 2 | 2 |
| Postradiation | 4 | 6 | |
| Idiopaattinen | 2 | 3 | |
| Lymfedeema-assosioitunut | 0 | 1 | |
| Runko | 4 | 6 | |
| Pään ja kaulan | 2 | 3 | |
| Yläraajat | 0 | 1 | |
| Koko, cm | 3.6 | 13.1 | |
| Aika sädehoidon jälkeen, mo | 82.25 | 110.6 | |
| Säteilyannos, Gy | 44 | 47 | |
| Rinta | 3 | 7 | |
| Seminoma | 1 | ||
| Leikkaus | 6 | 8 | |
| Sädehoito | 1 | 3 | |
| Sädehoito | Kemoterapia | 0 | 8 |
| Vasoformatiivinen | 2 | 2 | |
| Kiinteä | 2 | 6 | |
| Sekoitettu | 2 | 2 | |
| Nekroosi | 1 | 5 | |
| Dermis | 2 | 2 | |
| Ihonalainen | 4 | 6 | |
| Lihakset | 0 | 2 | |
| Mitoosit | 10 | 18.3 | |
| Eloonjääminen, mo | 81.8 | 19.4 | |
Keskustelu
Kutaaninen angiosarkooma on hyvin harvinainen kasvain, mistä on osoituksena se, että pystyimme keräämään tiedot vain 16 kasvaimesta, jotka oli diagnosoitu 14 vuoden aikana eräässä onkologisessa sairaalassa. Kaiken kaikkiaan ihon angiosarkooma on hieman yleisempi iäkkäillä miehillä. Tämä johtuu siitä, että yleisin ihon angiosarkooman muoto väestössä on primaarinen pään ja kaulan alueen angiosarkooma (tunnetaan myös idiopaattisena tai Wilson-Jonesin angiosarkoomana) (kuva 1), jolla on taipumus esiintyä iäkkäillä miehillä.5,7,17 Sädehoidon jälkeinen angiosarkooma (kuva 2) on nykyään toiseksi yleisin ihon angiosarkooman muoto, koska rintasyövän hoidossa käytetään yhä useammin sädehoitoa radikaalin mastektomian sijaan.2,13,18 Tämä muutos on johtanut myös imusolmukkeisiin liittyvän angiosarkooman esiintyvyyden vähenemiseen, sillä se on tällä hetkellä tämän kasvaimen harvinaisin muoto. Ihon angiosarkooman eri muotojen esiintyvyys sarjassamme ei vastaa kirjallisuudessa esitettyjä raportteja, koska sairaalassamme hoidetaan suuri määrä rintasyöpään sairastuneita naisia, mikä selittää, miksi sairaalassamme yleisin ihon angiosarkooman muoto oli sädehoidon jälkeinen angiosarkooma. Tämä rintasyöpätapausten yleisyys selittää myös sen, miksi 16 potilaasta 11 oli naisia. Lymfedeemaan liittyvää angiosarkoomaa oli vain yksi tapaus (kuva 3), mikä vastaa muualla raportoituja esiintyvyyslukuja. Potilaalla oli vasemman käden krooninen lymfaturvotus, joka oli seurausta rintasyövän hoidon yhteydessä 22 vuotta aiemmin tehdystä kainalon imusolmukkeiden poistosta.
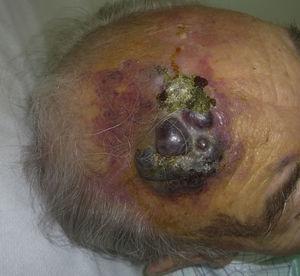
Punertavan-violettimainen plakki, jossa on kyhmymäisiä alueita iäkkään miehen otsassa.
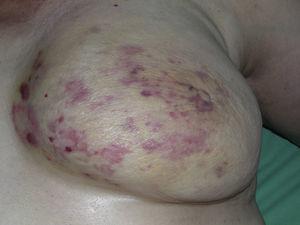
Lukuisia makuloita ja erytemaattisia laikkuja sekä useita punertavia papuloita kellertävällä iholla syövän vuoksi säteilytetyssä rinnassa.
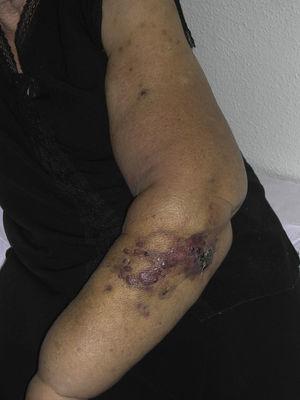


Punertavia-violettimaisia papuloita ja kyhmyjä mustelmamaisine alueineen käsivarressa, jolla on rintasyöpäleikkauksen jälkeinen lymfedeema.
Olkoon ottamatta yhtä naista, jolla oli idiopaattinen tai Wilson-Jonesin angiosarkooma, muilla sarjassamme mukana olleilla naisilla (n=10) oli aiemmin todettu rintasyöpä. Yhdeksän näistä syövistä oli invasiivisia duktaalikarsinoomia. Koska 80 prosenttia rintasyövistä väestössä on invasiivisia duktaalisia karsinoomia ja vain 10 prosenttia lobulaarisia karsinoomia, invasiivisen duktaalisen karsinooman suuri esiintyvyys tutkimuksessamme kuvastaa todennäköisesti tämän syövän suurta esiintyvyyttä väestössä eikä niinkään erityistä yhteyttä sädehoidon jälkeisen ihon angiosarkooman ja invasiivisen duktaalisen karsinooman välillä, kuten tuloksemme näyttäisivät viittaavan. Toisin sanoen sarjassamme havaitut osuudet ovat sopusoinnussa yleisväestön eri rintasyöpien osalta kuvattujen osuuksien kanssa. Tutkimuksessamme oli alun perin mukana kaksi rintojen angiosarkoomatapausta, jotka on syytä mainita. On raportoitu, että rinnan angiosarkoomalla on taipumus olla ihonalainen, kun se on sädehoidon aiheuttama, ja parenkymaalinen, kun se ei ole sädehoidon aiheuttama.19 Sarjassamme oli 18 alun perin todetusta ihonalaisen angiosarkooman tapauksesta 2 rinnan angiosarkoomatapausta, jotka eivät olleet sädehoidon aiheuttamia. Tarkastellessamme näitä tapauksia havaitsimme, että kasvaimen ensisijainen sijaintipaikka oli rintarauhasen parenchyma eikä iho. Kasvaimet jätettiin siksi tutkimuksen ulkopuolelle, koska ne olivat sekundaarisia eivätkä primaarisia. Jäljelle jääneet tapaukset olivat kaikki sädehoidon aiheuttamia primaarisia rinnan angiosarkoomia, mikä vastaa kirjallisuudessa esitettyjä raportteja.
Angiosarkooman yleisin sijaintipaikkakunta sarjassamme oli rinta (10 tapausta) eikä kasvot tai päänahka, kuten olisi odotettavissa. Ainoa raajoja koskettanut tapaus oli lymfedeemaan liittyvä angiosarkooma. Jälleen kerran se, että yleisin kasvainpaikka oli rinta, selittyy säteilyn aiheuttamien kasvainten vallitsevuudella sarjassamme.
Vaikka latenssiaika sädehoitoaltistuksen ja angiosarkooman kehittymisen välillä vaihtelee kirjallisuudessa esitettyjen raporttien mukaan suuresti (3-50 vuotta), se on yleensä pidempi (keskimäärin 25 vuotta), kun säteilyllä hoidettu tauti on hyvänlaatuinen. Pahanlaatuisten tautien osalta raportoidut latenssiajat ovat lyhyempiä (noin 10-15 vuotta), lukuun ottamatta rintojen angiosarkoomaa, jonka keskimääräiseksi latenssiajaksi on kuvattu noin 5 vuotta12 . Rinnan angiosarkooman lyhyemmän latenssiajan syy on epäselvä, vaikka useita teorioita on esitetty, mukaan lukien säteilytetyn ihon suuri määrä, siihen liittyvä lymfaturvotus, rinnan sisäiset tekijät ja mahdollinen synerginen vaikutus solunsalpaajahoitoon.13,14 Kymmenessä sädehoidon jälkeisessä tapauksessamme angiosarkooma diagnosoitiin keskimärin 8,2 vuoden kuluttua, ja 90 prosentissa tapauksista oli kulunut vähintään viisi vuotta. Angiosarkooman latenssiajan ja ennusteen välillä ei ole raportoitu yhteyttä. Sarjassamme keskimääräinen aika sädehoidosta angiosarkooman kehittymiseen oli jonkin verran pidempi kuolleilla potilailla (110,6 kuukautta) kuin elossa olevilla (82,25 kuukautta). Ainoassa Stewart-Trevesin oireyhtymän tapauksessa potilaalle oli tehty imusolmukkeen poisto 22 vuotta aiemmin. Lymfedeemaan liittyvän angiosarkooman latenssiaika on hyvin vaihteleva, vaihteluväli on 1-30 vuotta ja keskiarvo 10 vuotta. Stewart-Trevesin oireyhtymä muodostaa 90 prosenttia kaikista lymfedeemaan liittyvän angiosarkooman tapauksista.9,11 Angiosarkooma voi kuitenkin syntyä myös muissa lymfedeeman muodoissa, kuten synnynnäisessä lymfedeemassa, filaria-lymfedeemassa ja lymfedeemassa, joka on sekundaarinen lymfasolmukkeen poiston jälkeen muissa kehon osissa.10
Tuumorin koko on tällä hetkellä laajimmin hyväksytty ennusteellinen markkeri ihon angiosarkoomassa, ja usein on raportoitu, että vähintään 5 cm:n mittaisilla angiosarkoomilla on huonompi ennuste kuin pienemmillä kasvaimilla.5,17 Sarjassamme havaitsimme eroja kasvaimen keskimääräisessä koossa eloonjääneiden ja ei-eloonjääneiden välillä. Eloonjääneiden keskimääräinen kasvaimen koko oli 3,6 cm, mikä oli yli kolme kertaa pienempi kuin keskikoko (13,1 cm) kuolleiden potilaiden ryhmässä. Tuloksemme siis tukevat käsitystä, jonka mukaan suuremmat kasvaimet ovat yhteydessä angiosarkooman huonompaan hoitotulokseen, ja korostavat, että kasvaimen diagnosointi on tärkeää jo silloin, kun se alkaa mustelman kaltaisena leesiona, vaikka tämä on erityisen vaikeaa päänahan angiosarkoomassa ja varsinkin silloin, kun potilaalla on vielä hiuksia (kuva 4). Rintojen sädehoidon jälkeinen angiosarkooma on helpompi diagnosoida, sillä kaikki tällä alueella olevat pysyvät vauriot, jotka näyttävät verisuonilta tai mustelmilta, olisi tutkittava biopsiassa. Yksi mahdollisesti hyödyllinen diagnostinen vihje on kellertävä halo (joka vastaa hemosideriiniä) epäilyttävän leesion ympärillä (kuva 5), sillä emme ole koskaan havainneet tätä merkkiä säteilytetyn ihon hyvänlaatuisissa verisuonikasvaimissa. Säteilytyksen jälkeinen angiosarkooma ja epätyypilliset verisuonikasvaimet säteilytetyllä iholla on erotettava toisistaan histologisesti, mutta kliiniset piirteet voivat auttaa. Epätyypilliset verisuonten proliferaatiot ovat yleensä paljon pienempiä kuin angiosarkoomat, ja niiden latenssiaika on yleensä lyhyempi.20 Toisin kuin angiosarkoomat, nämä proliferaatiot rajoittuvat pinnalliseen ja keskimmäiseen dermikseen eivätkä tunkeudu ihonalaiskudokseen. Histologiassa ei myöskään ole havaittavissa angiosarkoomalle ominaista ydinatypiaa, endoteelisolujen monikerroksisuutta tai mitoosilukuja. Joskus voi kuitenkin olla vaikeaa erottaa näitä kahta kasvainta toisistaan, ja on raportoitu, että nämä kaksi leesiota esiintyvät rinnakkain samassa säteilytetyssä rintarauhasessa. On jopa ollut tapauksia, joissa säteilyn aiheuttamat epätyypilliset verisuonten proliferaatiot ovat edenneet angiosarkoomaksi.21 Hyvin monimutkaisissa tapauksissa voi olla hyödyllistä etsiä MYC-geenin yliekspressiota, jos tehdään immunohistokemiallinen tutkimus, tai amplifikaatiota, jos käytetään fluoresoivaa in situ -hybridisaatiota. MYC:n monistuminen on melko yleistä sekundaarisissa angiosarkoomissa, mutta sitä ei näytä esiintyvän epätyypillisissä verisuonten proliferaatioissa säteilytetyllä iholla.22
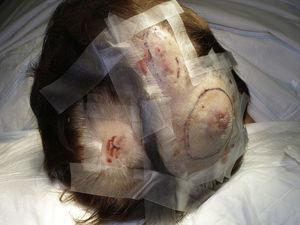
Multifokaaliset erytemaattiset kyhmyt päänahassa.
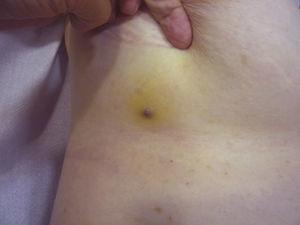
Punertavan-violettimainen, alle 1 cm:n kokoinen papula, jota ympäröi kellertävä ihoalue.
Toinen laajimmin hyväksytty ennustemerkkiaine angiosarkoomassa on ikä. Sarjassamme eloonjääneet potilaat olivat keskimäärin nuorempia kuin kuolleet (62 vs. 71 vuotta). Tästä huolimatta sarjamme 16 potilaasta 10 oli kuollut tutkimuksen loppuun mennessä, mikä vahvistaa angiosarkoomaan yleisesti liitetyn huonon ennusteen.
Toisin kuin muiden sarkoomien kohdalla, American Joint Committee on Cancer ei pidä histologista luokkaa angiosarkoomassa merkityksellisenä ennustemerkkinä. Useat kirjoittajat ovat kuitenkin esittäneet, että tietyillä histopatologisilla piirteillä saattaa olla merkitystä ennusteen kannalta. Joissakin viimeaikaisissa tutkimuksissa on esimerkiksi väitetty, että vallitseva solide kuvio saattaa olla suhteellisen hyvä ennusteellinen merkki pään ja kaulan angiosarkoomassa.3,16 Näin ei ollut sarjassamme, sillä 10:stä kuolleesta potilaasta 6:lla oli tämä kuvio, kun taas 6:sta tutkimuksen lopussa elossa olleesta potilaasta vain 2:lla oli tämä kuvio (kuvat 6 ja 7).
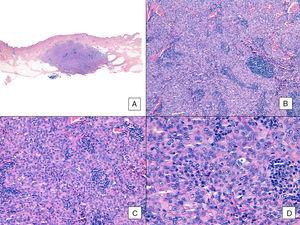
Angiosarkooma, jossa on vallitseva kiinteä kuvio. A, Panoraamakuvassa näkyy invasiota keski- ja syvään retikulaariseen dermikseen ja hypodermikseen (hematoksyliini-eosiini, alkuperäinen suurennos ×10). B, Tiheäsoluinen kasvain, joka on tuhonnut olemassa olevia rakenteita ja johon liittyy nodulaarisia lymfaattisia infiltraatteja (hematoksyliini-eosiini, alkuperäinen suurennos ×100). C ja D, Yksityiskohtainen näkymä, jossa vallitsevat epiteelisolut, joihin liittyy lymfosyyttinen infiltraatti (hematoksyliini-eosiini ×200 ja ×400, vastaavasti).
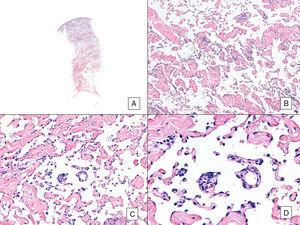
Angiosarkooma, jossa on vallitseva vasoformatiivinen kuvio. A, Panoraamakuva, jossa näkyy dermiksen infiltraatio hypodermikseen asti (hematoksyliini-eosiini, alkuperäinen suurennos ×10). B, Neoplastiset verisuonitilat, joissa on selvä kollageenin dissekaatio (hematoksyliini-eosiini, alkuperäinen suurennos ×100). C ja D, Neoplastisten endoteelisolujen dissektoimat ei-neoplastiset verisuonet, jotka jäävät ”kellumaan” dermikseen (promontory-merkki) (hematoksyliini-eosiini, alkuperäinen suurennos ×200 ja ×400).
Muita kirjallisuudessa ehdotettuja potentiaalisesti korkean riskin histologisia tekijöitä ovat nekroosin esiintyminen, epitelioidinen morfologia ja invaasion suurempi syvyys.5,7 Tuloksemme tukevat näitä mahdollisia merkkiaineita, sillä kaikki kolme muuttujaa olivat yleisempiä ryhmässä, joka ei ollut elossa. Nekroosia havaittiin viidellä kymmenestä kuolleesta potilaasta ja vain yhdellä kuudesta eloonjääneestä potilaasta. Samoin vain 2 potilasta, joilla oli vallitseva karasolukuvio, olivat vielä elossa tutkimuksen lopussa. Sitä vastoin yhdelläkään kuolleista potilaista ei ollut tätä mallia. Lopuksi ainoat kaksi potilasta, joilla oli mukana lihastasoja, kuolivat. Keskimääräinen mitoosien määrä oli myös suurempi ryhmässä, joka ei ollut elossa (18,3 vs. 10).
Kutaanisen angiosarkooman ensisijainen hoitomuoto on kirurginen poistoleikkaus levein marginaalein, jota seuraa sädehoito.6 Angiosarkooman usein multifokaalinen luonne ja taipumus subkliiniseen levinneisyyteen hankaloittavat usein selkeiden marginaalien saavuttamista. Lisäksi ei ole yleistä yhteisymmärrystä siitä, mikä on riittävä marginaali, ja useimmissa tutkimuksissa annetaan epätarkkoja tietoja, kuten leikkaus ”leveällä marginaalilla”. Sarjassamme leikkaushoito oli ensisijainen hoitomuoto 14 potilaalle 16:sta. 3 cm:n marginaaleja käytettiin silloin, kun se oli teknisesti mahdollista, ja muissa tapauksissa leikkaus yritettiin tehdä 2 cm:n marginaaleilla. Näille 14 potilaalle tehtiin radikaalileikkaus. Kahta muuta potilasta ei pidetty ehdokkaina leikkaukseen, ja he saivat palliatiivista kemoterapiaa. He kuolivat seurannan aikana. Vain neljällä potilaalla käytettiin leikkausvuoteen kohdistuvaa liitännäissädehoitoa. Sädehoidon vähäinen käyttö angiosarkooman hoidossa sarjassamme selittyy todennäköisesti sillä, että sarjassamme esiintyi paljon sädehoidon jälkeisiä angiosarkoomia. Toisin sanoen siihen vaikutti todennäköisesti tietty vastustus säteilyn käyttöä kohtaan näissä tapauksissa. Sädehoidon käyttö sädehoidon jälkeisessä angiosarkoomassa saa kuitenkin tukea kirjallisuudessa, ja sitä annetaan joskus jopa monoterapiana ilman leikkausta.23,24 Kemoterapiaa käytettiin puolella potilaista. Kuten jo mainittiin, sillä oli pelkästään palliatiivinen merkitys, ja se oli kaikissa tapauksissa yhteydessä huonoon lopputulokseen. Vaikka paklitakseli-monoterapia ei ollut käytetyin kemoterapiaohjelma sarjassamme (koska tapaukset oli diagnosoitu jo jonkin aikaa sitten), tätä hoitoa käytetään nykyään ensisijaisena vaihtoehtona useimmissa tapauksissa. Alkuperäisistä odotuksista huolimatta angiogeenisiä lääkkeitä (sunitinibi, sorafenibi, bevasitsumabi, talidomidi) ei käytetä tässä tilanteessa, koska niiden tulokset ovat olleet pettymyksiä.
Huolimatta tapausten pienestä lukumäärästä sarjassamme, jossa oli kyse ihon angiosarkoomasta, mikä esti meitä tekemästä tilastollisia analyysejä, havaitsimme, että kasvaimen suurempi koko ja vanhempi ikä liittyivät molemmat huonompaan ennusteeseen. Vähemmän selvä yhteys havaittiin myös huonon ennusteen ja seuraavien histologisten piirteiden välillä: nekroosin esiintyminen, epiteelisolujen vallitsevuus, syvempien kerrosten invaasio ja mitoosien suurempi määrä.
Eettiset paljastuksetIhmisten ja eläinten suojelu
Tekijät ilmoittavat, että tätä tutkimusta varten ei tehty kokeita ihmisillä tai eläimillä.
Tietojen luottamuksellisuus
Tekijät ilmoittavat, että he ovat noudattaneet sairaalansa protokollaa potilaita koskevien tietojen julkaisemisesta.
Oikeus yksityisyyteen ja tietoon perustuva suostumus
Tekijät ilmoittavat, että tässä artikkelissa ei esiinny yksityisiä potilastietoja.
Erityisintressiristiriidat
Tekijät ilmoittavat, että heillä ei ole eturistiriitoja.