Org 2:n ”amiinien” kattavuudessa on yksi juttu: siitä ei kerrota mitään.
Ei se, toisin kuin useimmat luvut, aloita joukolla käsitteitä ja rakenna sitten sarjaa esimerkkejä, joihin voit sitten soveltaa näitä käsitteitä.
Ei. Tyypillinen amiineja käsittelevä luku johdanto-oppikirjassa on pohjimmiltaan vain sekamelska näennäisen satunnaisesti kasaan heitettyjä aiheita, jotka eivät sopineet muualle. Ainoa yhdistävä tekijä on se, että ne sisältävät typpeä jollakin tavalla.
Tässä esimerkissä: tämän päivän satunnainen amiinipostaus käsittelee Hofmannin ja Curtiuksen uudelleenjärjestelyjä.
Miten tämä johtuu, saatat kysyä? Siihen ei ole hyvää vastausta. Useimmat kurssit käsittelevät niitä jossain vaiheessa, ja niiden on pakko mahtua jonnekin. Joten mitä helvettiä. Miksi ei nyt?
Sisällysluettelo
- Hofmannin ja Curtiuksen uudelleenjärjestelyt
- Hofmannin ja Curtiuksen uudelleenjärjestelyjen mekanismi, ensimmäinen osa – uudelleenjärjestelyn asettaminen
- Kakkososa: Keskeinen uudelleenjärjestelyvaihe Hofmannin ja Curtiuksen uudelleenjärjestelyissä
- Kolmas osa: Isosyanaatin muodostuminen
- Vaiheiden yhdistäminen
- Isosyanaatin kohtalo: Formation of Carbamates, Amines, And Ureas
- Yhteenveto: Hofmannin ja Curtiuksen uudelleenjärjestelyt
- Huomautukset
- (Edistyneemmät) Viitteet ja lisälukemisto
- Hofmannin ja Curtiuksen uudelleenjärjestelyt
- Hofmannin ja Curtiuksen uudelleenjärjestelyjen mekanismi, osa 1: uudelleenjärjestelyn asettaminen
- 1. osa: Alkusoitto
- 3. Keskeinen uudelleenjärjestelyvaihe Hofmannissa ja Curtiuksessa
- Isosyanaatin muodostuminen
- Vaiheiden yhdistäminen
- Isosyanaatin kohtalo
- Yhteenveto: Hofmannin ja Curtiuksen uudelleenjärjestelyt
- Muistiinpanot
- (Edistyneempi) Lähdeviitteet ja lisälukemisto
Hofmannin ja Curtiuksen uudelleenjärjestelyt
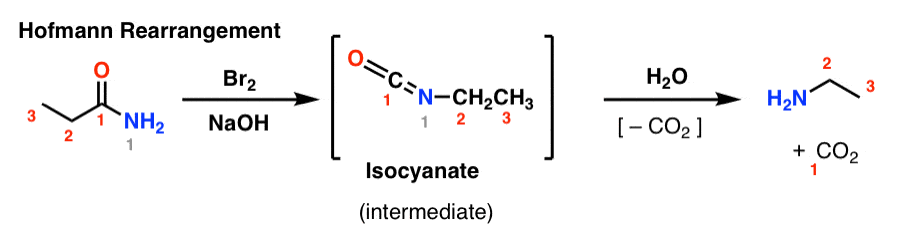
Hofmannin ja Curtiuksen uudelleenjärjestelyt ovat kaksi esimerkkiä kokonaisesta perheestä uudelleenjärjestelyreaktioita, jotka jakavat saman mekanistisen vaiheen.
Hofmannin uudelleenjärjestelyssä amidia käsitellään bromilla ja emäksellä (yleensä NaOH tai KOH). Kuumennettaessa muodostuu välituotteena isosyanaatti, jota ei eristetä. Veden läsnä ollessa isosyanaatti menettää hiilidioksidia (”dekarboksyloituu”) antaen amiinin.
Keskeinen sidos, joka muodostuu Hofmann-järjestelyssä, on C2-N-sidos. Huomaa, kuinka karbonyyliryhmä (C1) häviää muodostaen hiilidioksidia (CO2). (huom. tämä ei ole IUPAC-numerointi, vain numerointi keskustelun helpottamiseksi)
Curtiuksen uudelleenjärjestelyssä asyyliatsidia kuumennetaan, jolloin muodostuu isosyanaatti. Curtius-järjestelyssä isosyanaatti voidaan eristää, mutta se muunnetaan yleensä edelleen muiksi lajeiksi, kuten karbamaatiksi, ureaksi tai (dekarboksylaation kautta, kuten Hofmannissa) amiiniksi (näistä lisää jäljempänä).
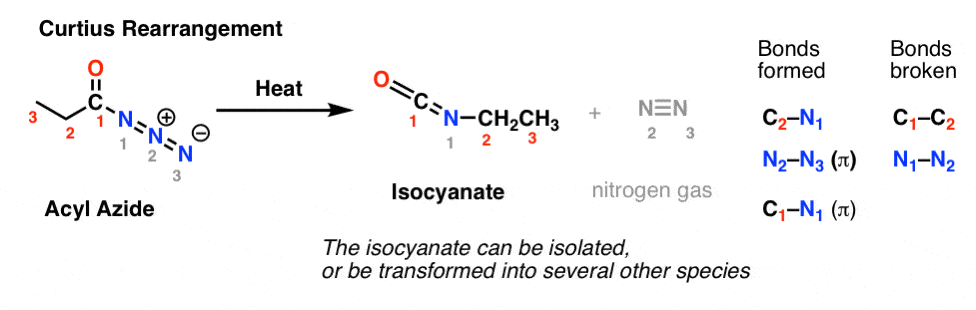
Keskeinen havainto molemmissa tapauksissa on se, että C1-C2-sidos on katkennut ja uusi C2-N-sidos on muodostunut.
Kysymys on MITEN?
Hofmannin ja Curtiuksen uudelleenjärjestelyjen mekanismi, osa 1: uudelleenjärjestelyn asettaminen
Curtiuksen ja Hofmannin uudelleenjärjestelyjen mekanismissa on neljä tärkeää osaa, ja käymme ne kaikki läpi.
- Ensimmäinen vaihe (suoraviivainen)
- Keskeinen siirtymisvaihe (hankala, mutta vähemmän hankala, jos tajuat nähneesi sen muunnoksen Org 1:ssä !).
- Isosyanaatin muodostuminen (suoraviivaista)
4. Epilogi: Isosyanaatin muunnokset
1. osa: Alkusoitto
- Hofmannin uudelleenjärjestely tapahtuu amidin kanssa.
- Curtiuksen uudelleenjärjestely tapahtuu asyyliatsidilla.
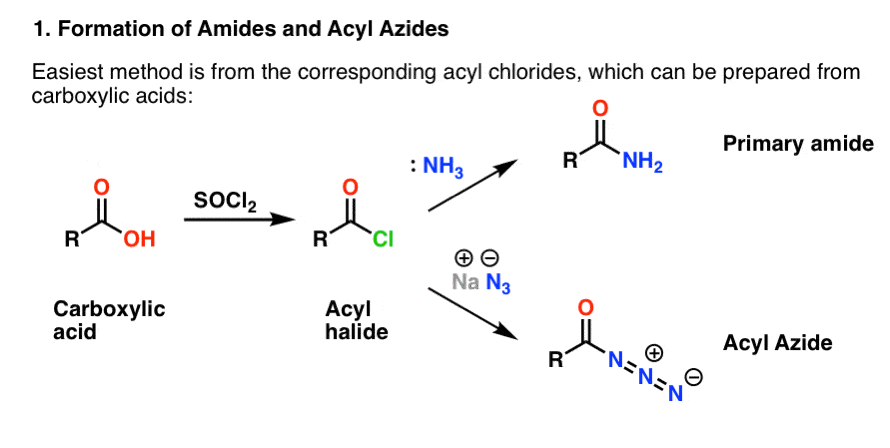
Kumpikin valmistetaan kätevästi asyylihalogenideista additio-eliminaatioreaktion avulla. Jos käsittelette nyt amiineja, niin karbonyylireaktiot ovat todennäköisesti tuttua aluetta. Asyylihalogenidit voidaan valmistaa karboksyylihapoista käyttämällä reagenssia, kuten tionyylikloridia (SOCl2) tai fosforipentakloridia (PCl5).
Hofmannin
Rakentaminen
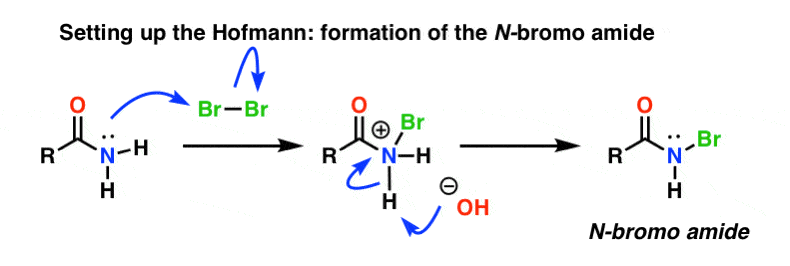
Hofmannin uudelleenjärjestelyssä amidia käsitellään bromilla (Br2) ja emäksellä, kuten NaOH:lla. Tämä johtaa N-H:n katkeamiseen ja N-Br:n muodostumiseen, jolloin typelle asennetaan hyvä poistuva ryhmä. Kutsumme tätä ”N-bromiamidiksi”.
Curtius ei tarvitse ”perustaa”, koska asyyliatsidilla on jo upea sisäänrakennettu poistuva ryhmä: N2. Tämän vuoksi orgaanisia atsideja on käsiteltävä varovasti, sillä karkea käsittely voi johtaa räjähdyksiin.
3. Keskeinen uudelleenjärjestelyvaihe Hofmannissa ja Curtiuksessa
Nyt päästään asiaan.
Keskeinen vaihe Hofmannin ja Curtiuksen uudelleenjärjestelyissä on hiiliatomin siirtyminen syrjäyttämään viereisen typen poistuvaa ryhmää.
Tämä edellyttää kahden kaarevan nuolen piirtämistä, jotka näkyvät rakenteessa aivan vasemmalla (alla).
- Ensimmäisessä kaarevassa nuolessa C-C-sidos katkeaa ja uusi C-N-sidos muodostuu.
- Toisessa kaarevassa nuolessa N-LG-sidos (poistuva ryhmä) katkeaa.
Aina ei kuitenkaan ole helppoa siirtyä suoraan äärimmäisenä vasemmalla olevasta rakenteesta äärimmäisenä oikealla olevaan rakenteeseen (joka on piirretty kauniisti ja siististi! ).
Lukemattomia pisteitä menetetään joka vuosi turhaan kokeissa opiskelijoiden toimesta, jotka saavat kaarevat nuolet oikein, mutta päätyvät piirtämään väärän rakenteen! Siksi kannustan opiskelijoita piirtämään ensin ”ruman version”, joka näyttää paskalta, mutta jossa ainakin kaikki sidokset ovat oikeilla paikoillaan. Aina on aikaa piirtää se uudelleen ja saada se näyttämään kauniilta myöhemmin.
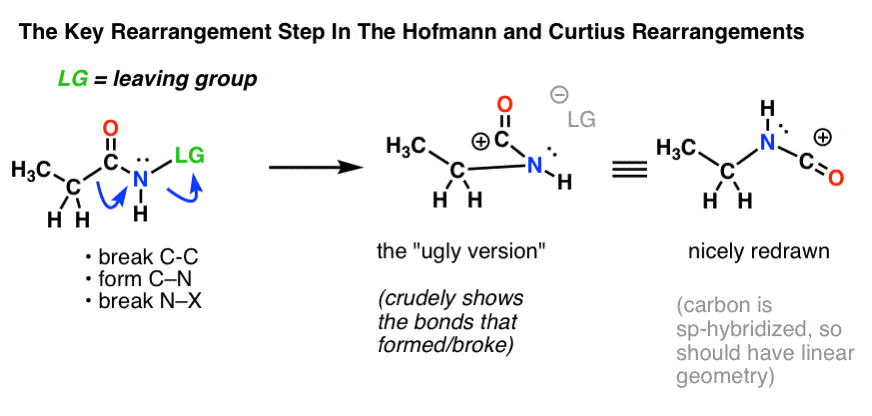
Aluksi tämä uudelleenjärjestely näyttää luultavasti… oudolta. Mutta se on itse asiassa reaktio, jonka olet nähnyt ennenkin! (mutta naamioidussa muodossa).
Muistaako kukaan hydroboraatio-oksidaation ”hapetus”-vaiheen mekanismia?
Se on periaatteessa sama juttu!
Tässä on kertausta:
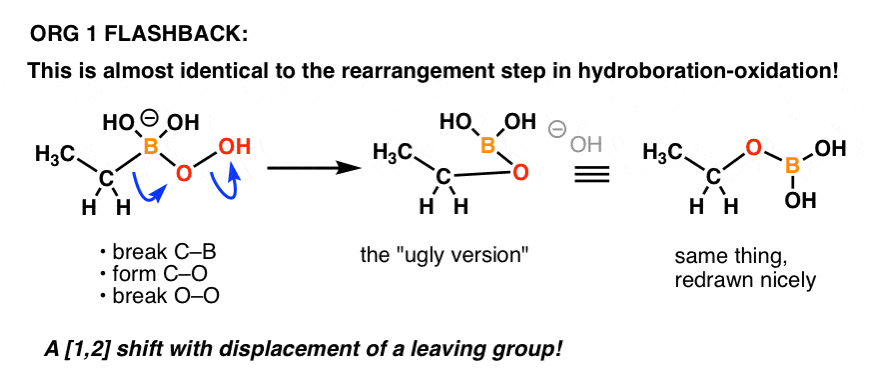
Jälleen yksi esimerkki siitä, miten orgaanisen kemian aikaisemmassa osassa opitut asiat voivat palata kurssin myöhemmässä osassa!
Käydään konkreettisin esimerkein läpi Hofmannin ja Curtiuksen uudelleenjärjestelyjen tietty uudelleenjärjestelyvaihe.
Tässä on Hofmannin keskeinen vaihe, jossa kuumentaminen johtaa C-C:n katkeamiseen , C-N:n muodostumiseen ja N-Br:n katkeamiseen.
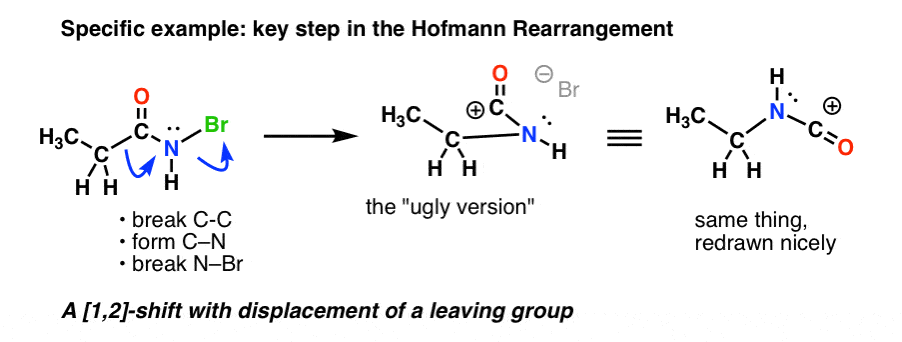
Jos seuraat kaikkia nuolia, sinun pitäisi päätyä oudon näköiseen karbokationiin (yllä oikealla), jota käsittelemme hetken kuluttua.
Curtiuksessa asyyliasidin kuumentaminen johtaa uudelleenjärjestelyyn. Poistuva ryhmä on typpikaasu (N2).
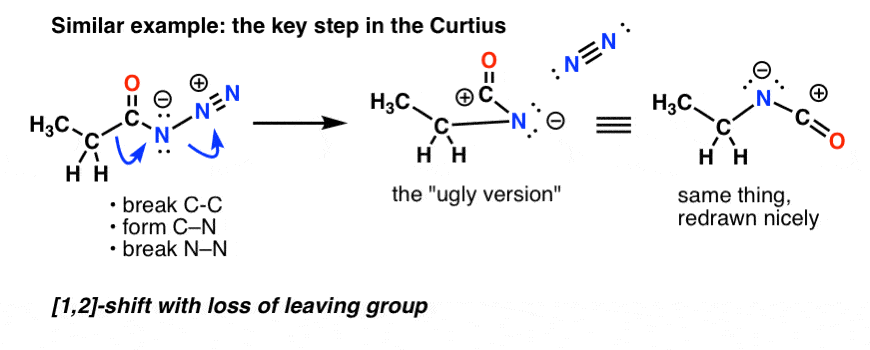
(Hienovarainen ero Curtiuksen ja Hofmannin välillä on se, että Curtiuksessa N:ään ei ole kiinnittynyt vetyä, joten päädymme negatiiviseen varaukseen typessä uudelleenjärjestäytyneessä lajissa.)
Isosyanaatin muodostuminen
Seuraavaksi siirrymme uudelleenjärjestäytyneestä lajistamme isosyanaattiin. Kenelle tahansa, joka on tottunut piirtämään resonanssimuotoja, tämän ei pitäisi olla liian vaikeaa.
(Kuten käsittelemme jäljempänä, tutkimuksissa on todettu, että isosyanaatin muodostuminen tapahtuu samaan aikaan kuin migraatio. Mutta opetustarkoituksiamme varten on mielestäni hyödyllistä käsitellä tätä vaihetta erillään. Voimme koota kaiken yhteen hetken kuluttua).
Kuten ehkä muistatte Org 1:stä, resonanssimuoto, jossa on täydet oktetit, on parempi kuin sellainen, jossa ei ole oktetteja (nopea kertaus). Meidän oudon näköisessä uudelleenjärjestäytymistuotteessamme on karbokationi vieressä typen vieressä, joka sisältää yksinäisen parin. Ensimmäinen askel on siis piirtää uuden C-N-pi-sidoksen muodostuminen. Tämä on pohjimmiltaan vain resonanssimuoto.
Hofmannin uudelleenjärjestely tapahtuu emäksen läsnäollessa. Resonanssimuodon piirtämisen jälkeen seuraava vaihe on siis N-H-sidoksen deprotonointi, jolloin saadaan neutraali isosyanaatti.
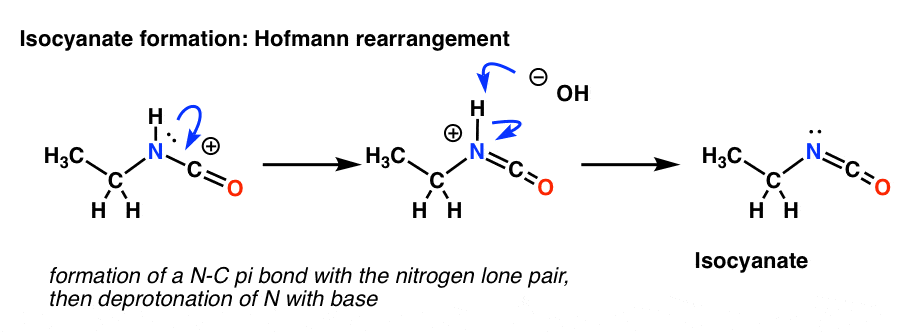
Curtiuksen typessä ei ole vetyä. Isosyanaatin muodostuminen tapahtuu siis pelkästään luovuttamalla yksinäinen pari typeltä karbokationille. Sitä voi tarkastella vain resonanssimuodon piirtämisenä.
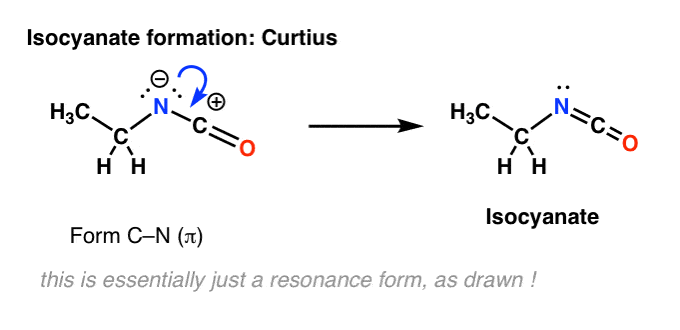
Vaiheiden yhdistäminen
Hofmannin ja Curtiuksen uudelleenjärjestelyjen mekanismia koskevissa tutkimuksissa on todettu, että nämä kaksi vaihetta eivät tapahdu peräkkäin, vaan ne tapahtuvat itse asiassa samaan aikaan! (mistä tiedämme tämän? ks. huomautus 1 )
Tämä tarkoittaa, että migraatio tapahtuu samanaikaisesti isosyanaatin muodostumisen kanssa.
Meidän on piirrettävä Hofmannin ja Curtiuksen mekanismit uudelleen, jotta ne heijastavat tätä ja sisältävät molemmat vaiheet.
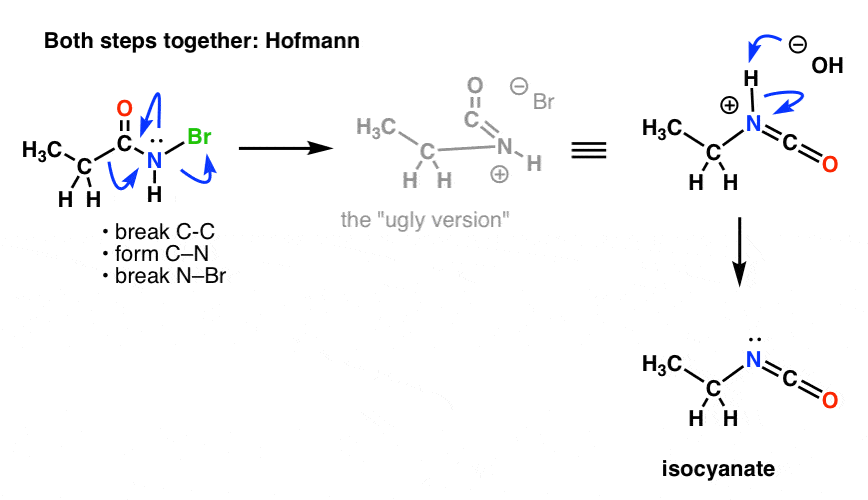
Tässä on Hofmannin mekanismi (huomaa, että deprotonointitapahtuma on itse asiassa erillinen).
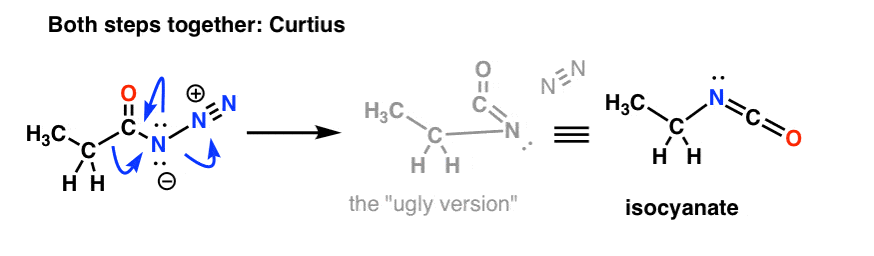
Ja Curtius:
Isosyanaatin kohtalo
Kummassakin Hofmannissa ja Curtiuksessa syntyy isosyanaatti. Et todennäköisesti ole aiemmin törmännyt isosyanaatteihin. Ensisilmäyksellä ne ovat melko oudon näköisiä lajeja, mutta niiden kemia ei eroa kovin paljon muiden karbonyylilajien, kuten esterien, amidien ja asyylihalogenidien kemiasta.
Isosyanaatin rakenne muistuttaa läheisesti hiilidioksidin, CO2, rakennetta. Hiili on pi-sidoksissa kahteen voimakkaasti elektronegatiiviseen atomiin. Tämä tekee hiilestä erinomaisen elektrofiilin.
Lisäämällä erilaisia nukleofiilejä isosyanaatit voidaan muuttaa muiksi käyttökelpoisiksi lajeiksi.
– Alkoholin lisääminen johtaa karbamaatin muodostumiseen
– Amiinin lisääminen johtaa urean muodostumiseen
– Veden lisääminen johtaa karbamiinihapon muodostumiseen, joka on epävakaa. Karbamiinihapot menettävät nopeasti hiilidioksidia antaen amiinin.
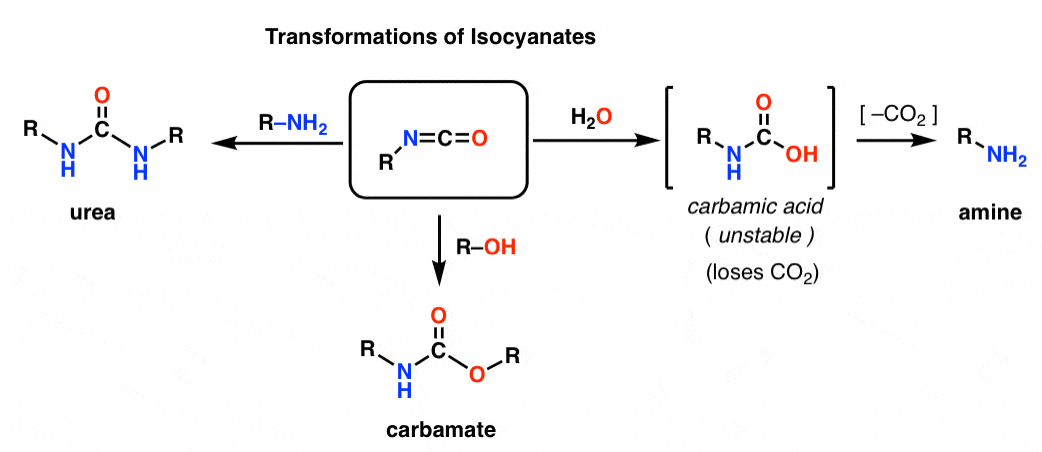
Erityisesti dekarboksylaatiopolku tarjoaa näppärän tavan tehdä amiineja. Olemme oppineet tonneittain tapoja tehdä karboksyylihappoja, mutta emme kovin montaa tapaa tehdä amiineja (nukleofiilisen substituution ja reduktiivisen aminoitumisen lisäksi). Hofmann on hyvä kikka takataskussa tilanteissa, joissa kumpikaan näistä tilanteista ei välttämättä sovellu – kuten esimerkiksi substituoitujen anilliinien valmistaminen.
Mekanismit? Okei, hyvä on. Katso bonusaihe 1.
Yhteenveto: Hofmannin ja Curtiuksen uudelleenjärjestelyt
Tämän uudelleenjärjestelyn mekanismi on ensisilmäyksellä hankala, mutta se helpottuu huomattavasti, kun tajuaa, että on nähnyt migraatioreaktion muunnoksen jo aiemmin (esim.esim. hydroboraatio-oksidaatiossa).
Suosittelen ehdottomasti piirtämään ensin ruman version, koska se auttaa sinua keskittymään muodostuvien ja katkeavien sidosten näkemiseen, ennen kuin yrität piirtää sen uudelleen esteettisesti miellyttävämmäksi rakenteeksi. Tämä pätee myös Beckmannin ja Wolffin uudelleenjärjestelyihin, joissa on samanlainen vaihe (ks. alla)
Muistiinpanot
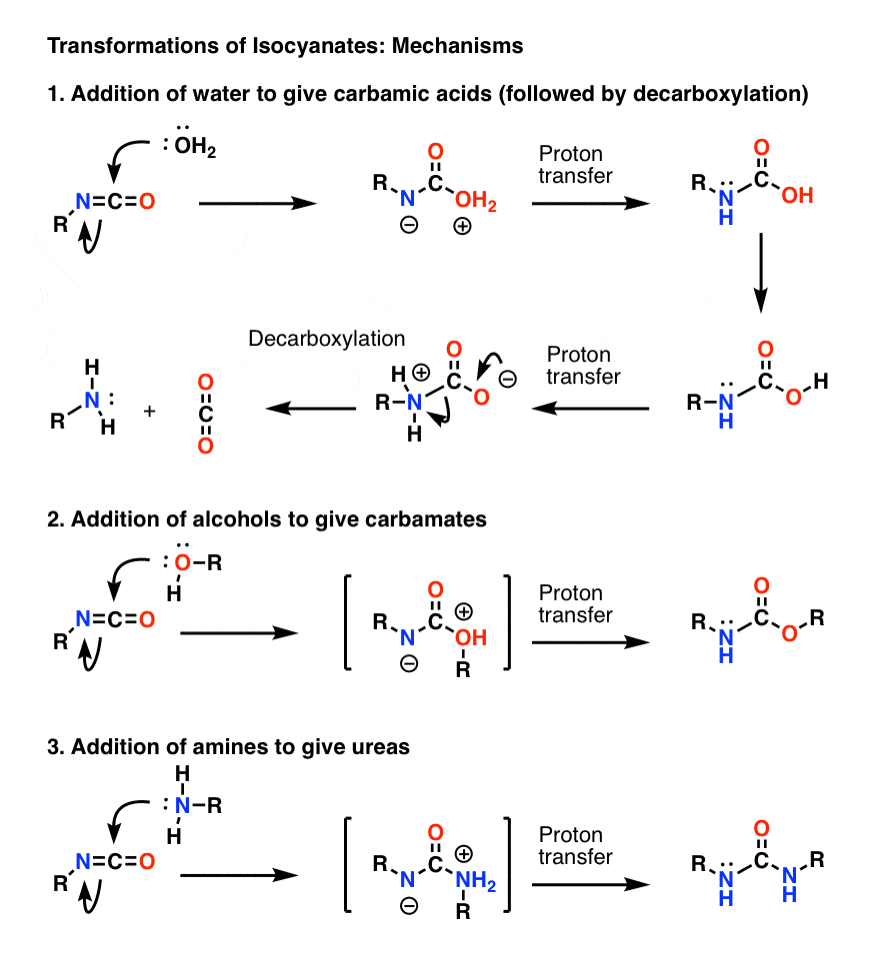
Bonusaihe 1: Isosyanaatit
Isosyanaattien tärkein mekanismi on elektrofiilinen additio (eli nukleofiilin lisääminen keskeiseen, elektrofiiliseen hiileen). Alla olevassa mekanismissa näytin nukleofiilin lisäävän hiileen niin, että typelle muodostuu anioni, vaikka tämä ei todennäköisesti ole paras resonanssimuoto (happi stabiloi negatiivista varausta paremmin kuin typpi). Protonin siirtyminen hapesta typelle johtaa neutraaliin lajiin. (Käytin tässä protoninsiirron taikasauvaa, koska se on nopeampi).
Huomaa, että dekarboksylaatiovaihetta kohdassa 1) ei tarvitse edeltää hapen deportoituminen, vaikka sen on ehdottomasti tapahduttava siten, että typpi protonoituu vaiheen aikana (et halua muodostaa esimerkiksi voimakkaasti emäksistä amidi-ionia).
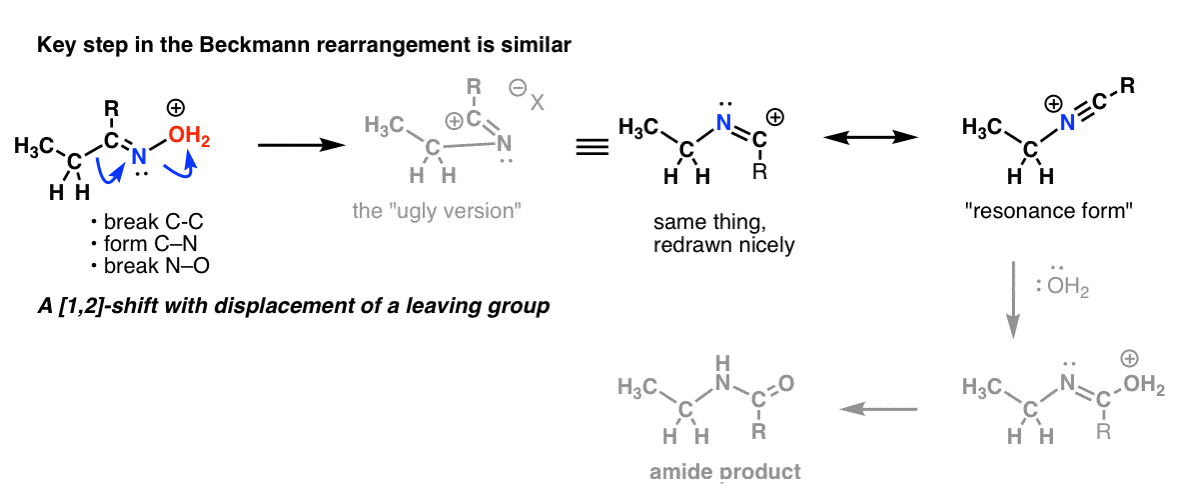
Bonusaihe 2: Beckmann-, Wolff- ja muilla uudelleenjärjestelyillä on samankaltainen vaihe
Mutta odottakaa, on vielä muutakin!
Beckmannin uudelleenjärjestelyssä on 1,2-siirto, jossa poistuva ryhmä menetetään. Avainaskel on periaatteessa sama, jonka näimme Hofmannin ja Curtiuksen uudelleenjärjestelyssä.
Ja Wolffin uudelleenjärjestelyssä, jota yleisesti myös käsitellään, saatat myös tunnistaa saman avainaskeleen.
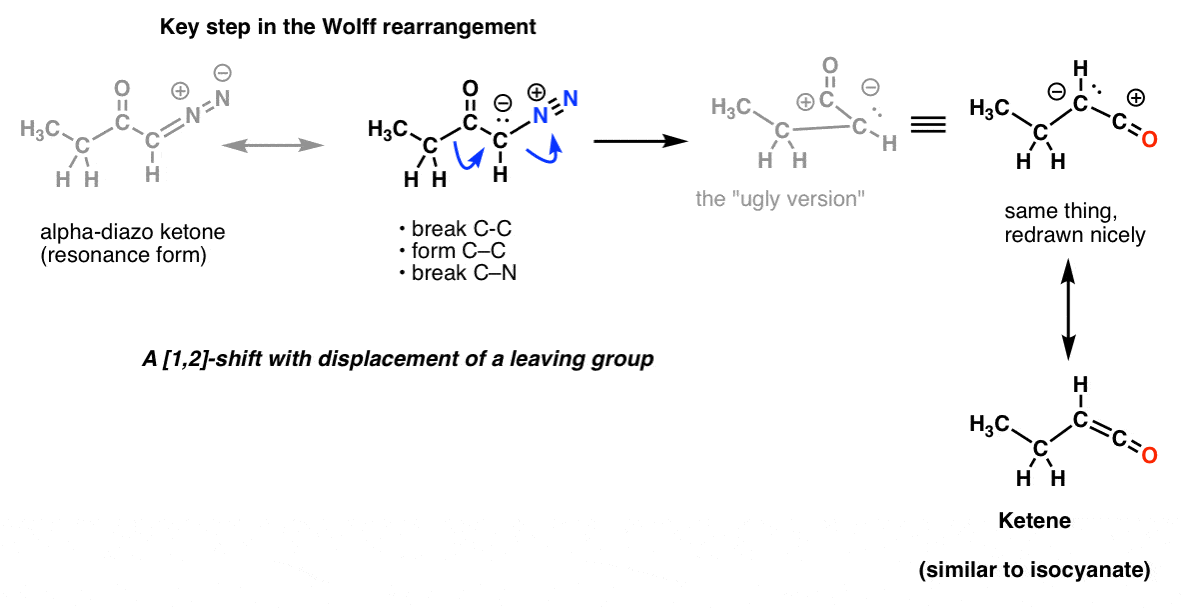
Eikä siinä kaikki! On olemassa reaktio nimeltä Schmidtin uudelleenjärjestely, joka on samanlainen kuin Curtius-reaktio, mutta syntyy lisäämällä HN3 asyylikloridiin (tai karboksyylihappoon). On myös toinen reaktio nimeltä Lossenin uudelleenjärjestäytyminen, joka tapahtuu hydroksiamihappojen kanssa. Näiden kahden prosessin avainvaihetta ei voi arvata. Emmekä ole edes maininneet Baeyer-Villigeria, johon ei liity typpeä, mutta joka on melko samantyyppinen prosessi.
Kun opettelin Org 1:ssä olevan hydroboraatio-oksidaatiovaiheen monta kuuta sitten, en todellakaan odottanut, että näkisin saman reaktiokaavion toistuvan niin monissa eri muodoissa.
Johtopäätöksenä on se, että on olemassa paljon reaktioita, jotka kulkevat samassa mekanistisessa prosessissa ja jotka kulkevat samalla tavalla. Tämä korostaa orgaanisen kemian keskeisten mallien oppimisen tärkeyttä, koska ne tosiaan toistavat itseään paljon.
Loppuviite. Concerted, not separate?
Jos Curtius olisi vaiheittainen, typen menetys johtaisi nitreeniin. Nitreeneissä tapahtuu monia mielenkiintoisia reaktioita, kuten insertio C-H-sidoksiin (!). Voidaan siis suunnitella koe tämän testaamiseksi: jos kokeiltaisiin seuraavaa Curtiuksen uudelleenjärjestelyä, voitaisiin etsiä todisteita viisirenkaisen renkaan muodostumisesta.
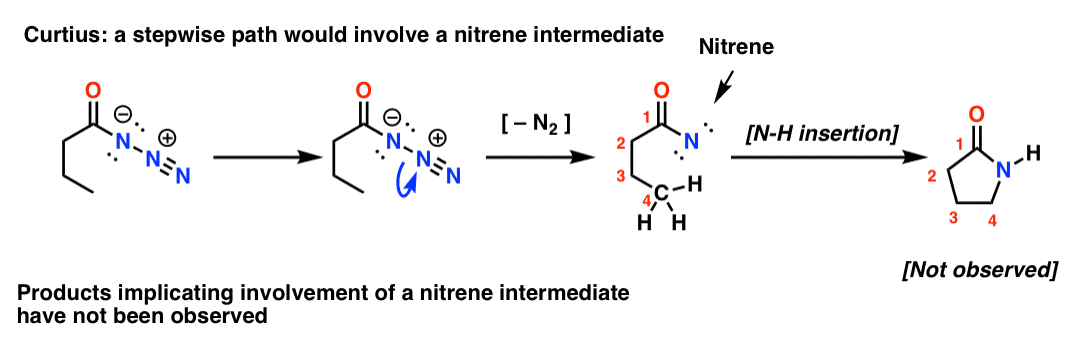
Tällaisten tuotteiden puuttuminen yhdessä muiden todisteiden kanssa viittaa yhteen sovitettuun mekanismiin.
(Edistyneempi) Lähdeviitteet ja lisälukemisto
- Ueber die Einwirkung des Broms in alkalischer Lösung auf Amide
W. Hofmann
Chem. Ber. 1881, 14, 2725-2736
DOI: 10.1002/cber.188101402242
A. W. Hofmannin (joka oli erittäin tuottelias kemisti ja jonka nimiin on liitetty monia muitakin muunnoksia) alkuperäinen artikkeli amidien hajottamisesta primaarisiksi amiineiksi. - A Mild and Efficient Modified Hofmann Rearrangement
Xicai Huang, Mehran Seid, and Jeffrey W. Keillor
The Journal of Organic Chemistry 1997, 62 (21), 7495-7496
DOI:10.1021/jo9708553
Tämä on modifioitu Hofmannin uudelleenjärjestely, joka suoritetaan metanolissa – tässä tapauksessa karbamiinihapon välituote voi reagoida metanoliliuottimen kanssa tuottaen metyylikarbamaatteja hyvällä saannolla. - METYYLIKARBAMAATTIEN MUODOSTUMINEN MODIFIOITUJEN HOFMANNIN UUDELLEENJÄRJESTÄMISTOIMENPITEIDEN KAUTTA: METHYL N-(p-METHOXYPHENYL)CARBAMATE
Jeffrey W. Keillor and Xicai Huang
Org. Synth. 2002, 78, 234
DOI: 10.15227/orgsyn.078.0234
Luotettava ja riippumattomasti testattu menettely muunnetulle Hofmannin uudelleenjärjestelylle Ref #2. - The Hofmann Reaction
Wallis, Everett L.; Lane, John F.
Org. React. 1946, 3, 267-306
DOI: 10.1002/0471264180.or003.07
Vanha, mutta (aikakauteensa nähden) kattava katsaus Hofmannin reaktiosta (amidista amiiniksi -reaktio, jota ei pidä sekoittaa hänen muihin reaktioihinsa). - Notes – A Re-examination of the Limitations of the Hofmann Reaction
Ernest Magnien ja Richard Baltzly
The Journal of Organic Chemistry 1958, 23 (12), 2029-2032
DOI:10.1021/jo01106a630
Tämä on mielenkiintoinen artikkeli, jossa kirjoittajat ovat yrittäneet laajentaa Hofmannin uudelleenjärjestelyä alkuperäisessä artikkelissa kuvattua laajemmaksi säätämällä reaktio-olosuhteita huolellisesti. - 20. Hydrazide und Azide organischer Säuren
Curtius, T. I. Abhandlung.
Journal Für Praktische Chemie, 50(1), 275-294. (1894).
DOI:1002/prac.18940500125 - Ueber Stickstoffwasserstoffsäure (Azoimid) N3H.
Curtius, T.
Berichte Der Deutschen Chemischen Gesellschaft, 23(2), 3023-3033.(1890).
DOI:1002/cber.189002302232
Theodore Curtiuksen ensimmäiset artikkelit, joissa kuvataan asyylihyratsidien ja asyyliatsidien reaktiivisuutta. - The Curtius Reaction
Smith, P. A. S.
Org. React. 1946, 3, 336
DOI: 10.1002/0471264180.or003.09
Vanha, mutta kattava katsaus Curtius-reaktioon, joka sisältää tämän uudelleenjärjestelyn löytöhistorian, substraatin laajuuden, rajoitukset, vertailun muihin samankaltaisiin reaktioihin ja kokeelliset menetelmät. - UNDECYL ISOCYANATE
F. H. Allen ja Alan Bell
Org. Synth. 1944, 24, 94
DOI: 10.15227/orgsyn.024.0094
Vanha, mutta toistettavissa oleva ja testattu menetelmä isosyanaattien syntetisoimiseksi Curtius-uudelleenjärjestelyllä. - An Expedient Protecting-Group-Free Total Synthesis of (±)-Dievodiamine
William P. Unsworth, Christiana Kitsiou, and Richard J. K. Taylor
Organic Letters 2013 15 (13), 3302-3305
DOI:1021/ol4013469
Tämän kokonaissynteesin ensimmäisessä vaiheessa käytetään Curtius-järjestelyä indoli-substituoidun karboksyylihapon intramolekulaarisen syklisoinnin aikaansaamiseksi. - Synteettiset menetelmät ja reaktiot. 121. Sinkkijodidin katalysoima aroyyliatsidien valmistus aroyyliklorideista ja trimetyylisilyyliatsidista
K. Surya Prakash, Pradeep S. Iyer, Massoud Arvanaghi ja George A. Olah
The Journal of Organic Chemistry 1983 48 (19), 3358-3359
DOI: 10.1021/jo00167a051
Käytännöllinen menetelmä aromaattisten aryyliatsidien valmistamiseksi Nobel-palkinnon saajalta Prof. George A. Olahilta. Näitä voidaan sitten käyttää Curtiuksen uudelleenjärjestelyihin.