Kennojen ja akkujen käyttö ja merkitys on kiistaton. Jokapäiväisessä elämässämme käytämme kennoja niin monin eri tavoin. Nyt, viime käsitteissä, olemme jo esitelleet teille akkuja yleisesti. Tässä annamme sinulle kuitenkin syvällisen analyysin galvaanisista kennoista. Aloitetaan siis.
Suggested Videos
Galvaaniset kennot
Muiden kennojen lisäksi galvaaninen kenno on eräänlainen sähkökemiallinen kenno. Sitä käytetään sähkövirran syöttämiseen tekemällä elektronien siirto redox-reaktion kautta. Galvaaninen kenno on esimerkillinen ajatus siitä, miten energiaa voidaan valjastaa käyttämällä yksinkertaisia reaktioita muutaman tietyn alkuaineen välillä. On hämmästyttävää tutkia, miten galvaaninen kenno voidaan perustaa ja miten sitä voidaan hyödyntää energian saamiseksi.
Yksinkertaisesti selitettynä galvaaninen kenno toimii laitteena, jossa tapahtuu samanaikaisia hapettumis- ja pelkistymisreaktioita. Näiden reaktioiden avulla kemiallinen energia muunnetaan sähköenergiaksi, jota voidaan hyödyntää mihin tahansa kaupallisiin tarkoituksiin.
Selaa lisää aiheita kohdasta Sähkökemia
- Paristot
- Elektrolyyttisten liuosten johtokyky
- Korroosio
- Sähkökemialliset kennot
- Elektrolyyttiset kennot ja elektrolyysi
- Polttoainekennot
- Nernstin yhtälö
- Johtokyvyn ja molaarisen johtokyvyn muuttuminen konsentraation funktiona
.
Galvaanisten kennojen toiminta

Galvaanisen kennon toiminta on varsin yksinkertainen. Siihen liittyy kemiallinen reaktio, jonka lopputuloksena on käytettävissä sähköenergiaa. Redox-reaktion aikana galvaaninen kenno hyödyntää elektronien välistä energiansiirtoa kemiallisen energian muuntamiseksi sähköenergiaksi.
Galvaaninen kenno hyödyntää kykyä erottaa elektronien virtaus toisistaan hapettumis- ja pelkistymisprosessissa aiheuttaen puolireaktion ja liittämällä kumpikin johtimella niin, että voidaan muodostaa polku elektronien virralle tällaisen johtimen läpi. Tätä elektronien virtausta kutsutaan olennaisesti virraksi. Tällainen virta voidaan saada kulkemaan johtimen läpi, jotta virtapiiri saadaan valmiiksi ja saadaan sen ulostulo mihin tahansa laitteeseen, kuten televisioon tai kelloon.
Galvaaninen kenno voidaan tehdä mistä tahansa kahdesta metallista. Nämä kaksi metallia voivat muodostaa anodin ja katodin, jos ne jätetään kosketuksiin toistensa kanssa. Tämä yhdistelmä mahdollistaa sen metallin galvaanisen korroosion, joka on anodisempi. Jotta tämä korroosio voisi tapahtua, tarvitaan kytkentäpiiri.
Galvaanisen kennon kokoonpano
Galvaanisen kennon luomiseksi olisi käytävä läpi seuraava kokoonpano. Kennossa olisi mieluiten kaksi elektrodia. Toinen näistä elektrodeista, katodi, on positiivisesti varautunut elektrodi, kun taas toinen, anodi, on negatiivisesti varautunut elektrodi.
Nämä kaksi elektrodia muodostavat galvaanisen kennon kaksi olennaista komponenttia. Pelkistymiseen liittyvä kemiallinen reaktio tapahtuu katodilla, kun taas hapettumisen puolireaktio tapahtuu anodilla. Kuten on jo sanottu, kemiallisen reaktion aikaansaamiseksi voidaan käyttää mitä tahansa kahta metallia.
Galvaanisen kennon ymmärtäminen esimerkin avulla
Tarkastellaan esimerkkiä, jossa kemialliseen reaktioon osallistuvat kaksi metallia ovat sinkki ja kupari. Kun kemiallinen reaktio tapahtuu, sinkki menettäisi lopulta kaksi elektronia. Kupari ottaa tämän vastaan ja muuttuu alkuaineeksi kupariksi. Koska nämä kaksi metallia sijoitetaan kahteen erilliseen astiaan ja ne yhdistetään toisiinsa johtavalla johdolla, muodostuu sähkövirta, joka siirtää kaikki elektronit yhdestä metallista toiseen.
Kahden metallin on samanaikaisesti upotettava suolaliuokseen, tässä tapauksessa vaikkapa sinkkisulfaattiin ja kuparisulfaattiin. Tässä tapauksessa näitä kahta liuosta ei sekoiteta suoraan keskenään, vaan ne voidaan yhdistää sillan tai väliaineen avulla. Tämän väliaineen on huolehdittava ionien siirtymisestä, mutta myös siitä, etteivät nämä kaksi liuosta pääse sekoittumaan keskenään.
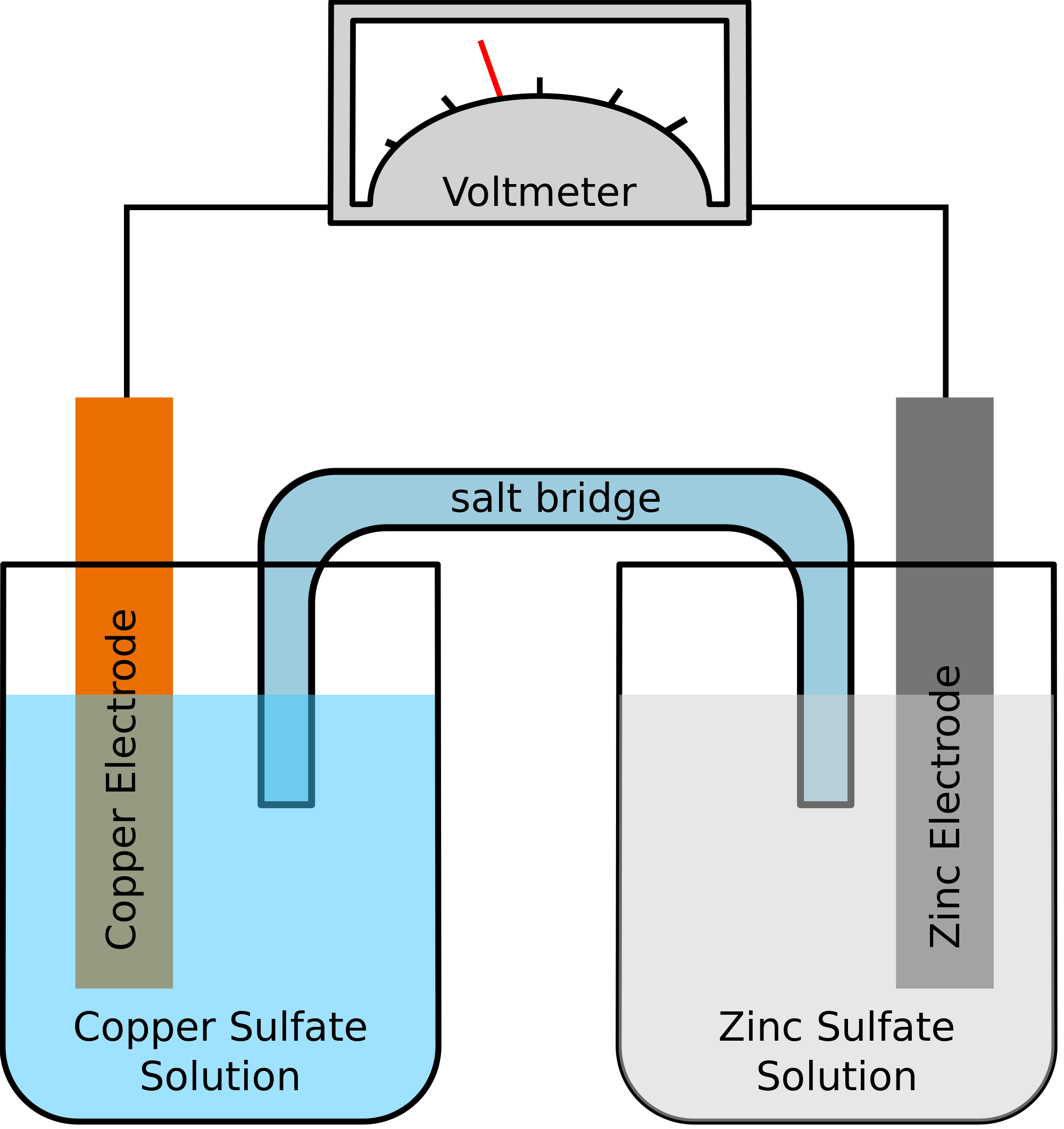
Tällainen silta auttaa täydentämään virtapiiriä sähkövarauksen kuljettamiseksi ja varmistaa myös sen, että metallien kanssa olevissa astioissa olevat liuokset pysyvät neutraaleina eivätkä sekoitu keskenään. Niin kauan kuin suolasilta ei häiritse redox-reaktiota, jossa tapahtuu hapettumista ja pelkistymistä, ei ole väliä, mitä suolasiltaa kemiallisessa reaktiossa käytetään.
Joitakin tärkeitä termejä
Joitakin galvaanisessa kennossa käyttöön otettuja tärkeitä termejä on lueteltu alla:
- Faasien väliset rajat: Se viittaa kahteen metalliin, jotka toimivat katodina ja anodina.
- Suolasilta: Yhdyssilta tai väliaine, joka mahdollistaa redox-reaktion tapahtumisen.
- Hapettuminen ja pelkistyminen: Kemialliset prosessit, jotka mahdollistavat sähkövirran muodostumisen ja kulkemisen galvaanisen kennon läpi.
Ratkaistuja esimerkkejä sinulle
Kysymys: Mitä galvaanisessa kennossa tapahtuisi, jos suolasiltaa ei käytettäisi, kun redox-reaktio tapahtuu?
Ratkaisu: Ilman suolasiltaa kussakin metalleja sisältävässä säiliössä redox-reaktio alkaisi suurin piirtein samalla tavalla. Mutta ilman suolasiltaa sama päättyisi melko äkillisesti. Kyseiset liuokset eivät pysty säilyttämään sähköistä neutraaliuttaan. Muutoin kemiallisessa reaktiossa ei tapahdu mitään muutosta tai minkäänlaista muutosta suolasiltaa tai väliaineen puuttumisen vuoksi.