Yleinen yleiskatsaus
Suuri osa mikro-organismeista ei ainoastaan asu meissä vaan myös elää meissä. Ihmisen iholla onkin heterogeeninen sekoitus enimmäkseen ei-patogeenisiä bakteereja, sieniä ja viruksia, jotka todennäköisesti vaikuttavat ihon pinnan terveyteen (kuva 1). Propionibacterium acnes (P. acnes) on kaikkialle levinnyt, hitaasti kasvava, sauvamainen, ei itiöitä muodostava, grampositiivinen anaerobinen bakteeri (kuva 2), jota esiintyy eri puolilla kehoa, myös kasvojen ja kaulan talitupissa (Funke ym., 1997; Grice ja Segre, 2011; Findley ja Grice, 2014). Sitä pidetään usein osana barrier-kohtien kommenssimikrobistoa (Cogen ym., 2008), joka vakiintuu adaptiivisen immuunitoleranssin mekanismien kautta vastasyntyneiden varhaisvaiheessa (Scharschmidt ym., 2015). Vaikka anaerobin topografinen jakautuminen talikohdissa on merkittävää, P. acnesin alueellinen ja henkilökohtainen jakautuminen on enemmän yksilö- kuin kohdekohtaista (Oh ym., 2014). Lisäksi P. acnesin biogeografia ja yksilöllisyys on erittäin dynaamista, sillä muutokset terveydentilassa tai muutokset pH:ssa, lämpötilassa, kosteudessa ja/tai talipitoisuudessa voivat vaikuttaa myös mikro-organismin valtaamien markkinarakojen valikoimaan (Grice et al., 2009). Samoin kuin ihon mikrobien jakautuminen, myös iho-olosuhteet voivat muokata P. acnesin toimintaa patogeenin laajenemisen kannalta sairauksissa. Esimerkiksi P. acnes on yhdistetty ihovaurioihin, kuten akne vulgaris kasvoilla ja kaulalla sekä etenevä makulaarinen hypermelanoosi selässä (Bojar ja Holland, 2004; Kurokawa ym., 2009; Barnard ym., 2016). Lisäksi tietyillä tautiin liittyvillä P. acnesin fylotyypeillä on kyky säilyä kehon implantteihin ja kirurgisiin laitteisiin aiheuttaen monenlaisia postoperatiivisia infektiotiloja, kuten endokardiittia, endoftalmitiittia ja verisuonensisäisiä hermostoinfektioita (Perry ja Lambert, 2011; Portillo ym., 2013). P. acnesin haittavaikutukset ulottuvat myös eturauhaseen, jossa bakteerin kudosinvaasiota ja solunsisäistä laskeutumista on usein havaittu rauhasen epiteelisoluissa ja verenkierrossa olevissa makrofageissa; ilmiön uskotaan epäsuorasti vaikuttavan eturauhasen hyvänlaatuiseen liikakasvuun (BPH) ja eturauhassyöpään (Tanabe ym, 2006; Alexeyev et al., 2007; Fassi-Fehri et al., 2011; Mak et al., 2012; Bae et al., 2014; Davidsson et al., 2016). Ei kuitenkaan ole selvää, mitä P. acnesin käyttämiä perusmekanismeja käytetään infektion, tulehduksen ja/tai etäpesäkkeiden aiheuttamiseen ihon ulkopuolella. Jonkin verran varmuudella tiedetään, että bakteerien infektoimat keratinosyytit, sebosyytit ja/tai adiposyytit erittävät useita pro-inflammatorisia kemokiineja ja sytokiineja sekä antimikrobisia tekijöitä (esim, katelisidiini), jotka viittaavat spesifisiin tautimekanismeihin (Graham ym., 2004; Nagy ym., 2006; Lee ym., 2010; Zhou ym., 2015; Sanford ym., 2016; Yu ym., 2016).
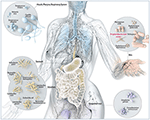
KUVIO 1. KUVIO 1. Bakteerien aiheuttamat sairaudet. Kaavamainen havainnollistus tavallisista mikrobeista, joita tavataan barrier-kohdissa ihmisillä, mukaan lukien P. acnes. Vaikka P. acnes esiintyy kaikilla ulkoisilla ja sisäisillä pinnoilla (esim. suun ja ruoansulatuskanavan epiteeleillä, sidekalvolla), sitä esiintyy eniten ihmisen iholla. Siellä se asuu kasvojen ja selän karvatupissa, missä se liittyy yleiseen ihosairauteen acne vulgaris. Useimmat pitävät P acnesia edelleen enimmäkseen hyvänlaatuisena ja vierasperäisenä mikro-organismina, mutta raportit sen haitallisesta opportunistisesta puolesta lisääntyvät. Muokattu ja ystävällisellä luvalla Bryan Christie Designista (http://bryanchristiedesign.com/).
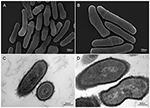
Kuva 2. P. acnes -kannan KPA:n skannaus- ja läpäisyelektronimikroskooppikuvat (SEM ja TEM) (A, B = SEM; C, D = TEM). Viimeaikaiset edistysaskeleet eristys- ja viljelytekniikoissa paljastavat, että P. acnes -infektioita on aliarvioitu huomattavasti, mikä tuo uutta valoa tähän opportunistiseen bakteerilajiin. Mikroskopointi: Volker Brinkmann, Max Planck Institute for Infection Biology, Berliini, Saksa. Mittakaavapalkki = 200/300 nm.
Sarkoidoosi
Sarkoidoosi on etiologialtaan tuntematon sairaus, joka johtaa tulehdukseen niinkin erilaisissa elimissä kuin keuhkoissa, maksassa, ihossa ja imusuonissa. Sarkoidoosin ja P. acnesin oletettua yhteyttä ehdotettiin ensimmäisen kerran, kun bakteeri eristettiin ihon ja imusolmukkeiden sarkoidimuutoksista (Eishi ym., 2002; Yamada ym., 2002). Nämä havainnot on vahvistettu merkittävästi (de Brouwer ym., 2015), ja niitä on laajennettu edelleen erilaisilla in vitro -kokeilla, jotka osoittavat P. acnesin invasiokapasiteetin HEK293T- (ihmisen alkiomunuaisen) ja A549-solulinjoissa (ihmisen alveolaarinen epiteelikarsinooma) (Tanabe ym., 2006). Tuoreimmat työt sarkoidisessa bronkoosi-alveolaarisessa huuhtelunesteessä (BAL) ja soluissa osoittivat P. acnes -spesifisen immuunivasteen merkittävää ylössäätelyä (Schupp ym., 2015). Lisäksi hiirillä tehdyt kokeet ovat osoittaneet, että elinkelpoinen P. acnes voi aiheuttaa keuhkorakkuloita, jotka muistuttavat sarkoidoosipotilailla havaittuja granuloomia (Werner ym., 2017). Yleiskatsauksen, jossa selvitetään yksityiskohtaisesti sarkoidoosin ja P. acnesin välinen yhteys, antaa lisäksi Eishi (2013).
Tutkimukset, joissa pyrittiin luonnehtimaan P. acnesin infektion aikana aktivoimia signalointireittejä, osoittivat, että P. acnes aktivoi ydintekijä-kappaB:n , transkriptiotekijän, joka säätelee immuniteetti- ja tulehduskaskadeihin osallistuvien geenien ilmentymistä (Kim ym., 2002). Laajemmin ilmaistuna tollin kaltainen reseptori 2 (TLR2) osoittautui kriittiseksi reseptoriksi NF-κB:stä riippuvaiselle vasteelle P. acnes -bakteerille, mikä paljasti tämän bakteerin kyvyn provosoida synnynnäisen immuniteetin geenien valikoivaa aktivoitumista (Inohara ja Nuñez, 2001; Chamaillard ym., 2003; Moreira ja Zamboni, 2012). Lisäksi isännän genetiikan roolia tutkittiin sarkoidoositapauksissa, jotka liittyivät P. acnes -infektioon. NOD1- ja NOD2-proteiinien NOD1:n ja NOD2:n nukleotideja sitovan oligomerisaatiodomeenin (NOD) yksittäiset nukleotidipolymorfismit (SNP:t) korreloivat P. acnes -infektioon 73 sarkoidoosipotilaalla, joilla oli 52 interstitiaalista pneumoniaa, ja 215 terveellä kontrolleilla (Tanabe ym., 2006). NOD1 ja NOD2 ovat solunsisäisiä hahmontunnistusreseptoreita, jotka voivat aistia bakteerimolekyylejä, kuten peptidoglykaaniryhmiä. Samansuuntaisesti in vitro -kokeet ovat osoittaneet, että P. acnesin internalisaatio HEK293T-soluihin voi johtaa NOD1:n ja NOD2:n aktivoitumiseen, mikä viittaa krooniseen tulehdukseen tai paikalliseen immunosuppressioon perustuvaan tautimekanismiin (Tanabe ym., 2006). Nämä havainnot viittaavat myös siihen, että invasiivinen P. acnes voi toimia bakteerien ligandeina aiheuttaen poikkeavaa NOD-reseptorin aktivaatiota tietyillä henkilöillä, joilla on pitkäaikainen alttius sarkoidoosille. Tulevissa kokeissa on kuitenkin selvitettävä tarkka mekanistinen kronologia siitä, voiko tai miten P. acnesin välittämä poikkeava NF-κB-aktivaatio voi aiheuttaa granulooman muodostumista NOD1/NOD2-riippuvaisella tavalla.
Vaikka invasiivinen P. acnes voi olla mahdollinen sarkoidoosin ja ehkä muidenkin tautien etiologia, on syytä selvittää kausaalisuhde ja korrelaatio P. acnes-infektion ja patologian välillä on epäselvää, koska bakteerikannan heterogeenisuus, isännän genetiikka sekä isännän ympäristö on otettava huomioon aina, kun tutkimuksessa yhdistetään mikrobiomi sairaustilaan.
Benigni eturauhasen liikakasvu (BPH) ja eturauhassyöpä
Kroonisia tai toistuvia tulehdusprosesseja on jo pitkään pidetty osallisina BPH:n ja eturauhassyövän etenemisessä (De Marzo et al., 1999; Nelson ym., 2004; Sfanos ym., 2014). Tulehduksen katsotaan johtuvan tiettyjen biomarkkereiden, kuten kohonneen interleukiini (IL)-6:n, tuumorinekroositekijä alfan (TNFα) ja akuutin faasin proteiinin, C-reaktiivisen proteiinin, läsnäolosta (Mechergui ym., 2009; Menschikowski ym., 2013; Yu ym., 2015). Urologisia nesteitä (eli virtsaa, siemennestettä, eturauhasen eritteitä) sekä eturauhasen biopsioita koskevat viimeaikaiset työt viittaavat merkittävään ehdolliseen siirtymiseen kohti tiettyjä mikrobilajeja, joita voidaan käyttää diagnostisena indeksinä (Yu ym., 2015; Ni ym, 2016).
Hyvin monet työt viittaavat siihen, että P. acnes -bakteerin spesifinen liittyminen eturauhaseen ja erityisesti eturauhasen epiteelisolujen invaasio (kuva 3) voivat osaltaan vaikuttaa BPH:n tai eturauhassyövän patologiaan, jolla on tulehduksellinen komponentti (Sfanos et al., 2013; Davidsson et al., 2016). Tällä hetkellä on kuitenkin epäselvää, onko P. acnes todellinen eturauhasen infektion aiheuttaja, kommenssiaalinen vai satunnainen eturauhasen mikrobi. On uskottavaa, että eturauhasessa sijaitsevat P. acnes -mikrobit ovat peräisin ihosta, jotka joutuvat sinne vahingossa esimerkiksi eturauhasen biopsian yhteydessä – näkökulma, jonka pitäisi herättää huolta tietyissä diagnostisissa työstöskenaarioissa.
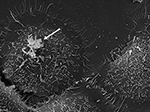
Kuvio 3. Eturauhasen mikrobisto. P. acnes -kannan P6 (nuoli) SEM in vitro viljellyissä eturauhasen epiteelisoluissa RWPE1. P. acnesin eturauhasen epiteelisolujen invasiivinen käyttäytyminen on hyvin dokumentoitu sekä in vivo että solupohjaisissa tutkimuksissa, joissa vimentiinivälitteinen invasioprosessi näyttää todennäköiseltä (Mak ym., 2012). Mikroskopointi: Volker Brinkmann, Max Planck Institute for Infection Biology, Berliini, Saksa. Mittakaavapalkki = 2 μm.
Sisääntuloreitistä tai patogeenisesta potentiaalista riippumatta merkittävä määrä eturauhaskudoksia, jotka on saatu BPH:n vuoksi tehdyssä transuretraalisessa resektiossa tai syövän vuoksi tehdyssä radikaalisessa eturauhasen poistoleikkauksessa, on aiemmin testattu positiivisiksi P. acnes -aggregaattien osalta, jotka ovat ilmeisesti asuneet vaeltavien makrofaagien seassa (Aleksejev ym., 2007; Bae ym., 2014). Ihmisnäytteisiin perustuvissa muissa raporteissa on saatu lisätodisteita BPH:n tai eturauhassyövän ja P. acnesin välisestä yhteydestä käyttäen erilaisia teknisiä lähestymistapoja, kuten viljelyä, konfokaalimikroskopiaa bakteerin visualisoimiseksi ja in situ -hybridisaatiota, immunohistokemiaa (kuva 4) ja PCR-pohjaista bakteerin 16S rRNA:n profilointia (Hochreiter ym., 2000; Cohen ym., 2005; Sfanos ym., 2008; Fassi-Fehri ym., 2011; Bae ym., 2014; Davidsson ym., 2016). Lisänäyttöä saadaan eläinkokeista, jotka osoittavat, että P. acnesin inokulaatio hiiren tai rotan eturauhaseen ja virtsarakkoon johtaa avoimeen, pitkäaikaiseen tulehdusreaktioon ja monenlaisiin soluhäiriöihin eturauhasessa (Olsson ym., 2012; Shinohara ym., 2013).
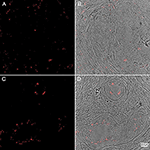
KUVA 4. P. acnesin inokulaatio hiiren tai rotan eturauhaseen ja rakkoon. Immunohistokemia ihmisen eturauhaskudosnäytteistä, jotka on värjätty P. acnes -vasta-aineella (punainen). Mukautettu luvalla lähteestä Fassi-Fehri et al., 2011 (lisäkuva 2B). P. acnesin esiintyminen ihmisen eturauhaskudosnäytteissä, joissa on eturauhasen hyvänlaatuinen liikakasvu (A,B) tai adenokarsinooma (C,D). Molemmissa tapauksissa havaittiin laaja bakteerikuormitus.
Yritykset analysoida fylogeneettisesti sairauteen liittyviä P. acnes -kantoja syöpäsairaista eturauhasista ovat osoittaneet, että useimmat eturauhasista saadut isolaatit kuuluvat fylogeneettisiin kluadeihin, jotka ovat harvinaisia ihmisen iholla, mikä viittaa siihen, että näytteenoton aikana tapahtunut ihokontaminaatio on epätodennäköistä (Mak ym., 2013; Davidsson ym., 2016). Samansuuntaisesti P. acnes näyttää aktivoivan samankaltaisia tulehdusreittejä kuin sarkoidoosin yhteydessä kuvatut, mukaan lukien NF-κB, IL-6, STAT3 ja COX2, sekä in situ että in vitro -olosuhteissa (Drott ym., 2010; Fassi-Fehri ym., 2011; Mak ym., 2013; Tsai ym., 2013; Bae ym., 2014). Vaikka näiden tulehduksellisten muutosten tarkka etiologia ei ole vielä selvillä, nisäkkäiden virtsa- ja sukupuolielinten järjestelmissä on laajalti levinnyt useita kalvoon sidottuja hahmontunnistusreseptorireittejä, jotka tunnistavat innokkaasti bakteeri- ja viruskomponentteja (Jorgensen ja Seed, 2012; Gambara ym., 2013). Nämä isäntäsolureseptorit, esimerkiksi TLR:t, edistävät sytokiinien tuotantoa, joka on synnynnäisen immuniteetin keskeinen piirre mikrobipatogeeneja vastaan. Yhdessä nämä havainnot viittaavat siihen, että kykynsä kautta laukaista immuniteetin eri osa-alueita tunkeutuvat P. acnes -bakteerit voivat toimia taudin vaikeusasteen ensisijaisena aiheuttajana ja/tai vahvistajana.
Spondylodiskiitti ja selkäkipu
Yksi monista postoperatiivisista komplikaatioista, joihin P. acnes liittyy, on välilevyn ja sitä ympäröivän nikamavälialueen tulehdus (diskiitti) välilevyn diskektomiaoperaation jälkeen (Harris ym., 2005). Samanaikainen viereisten nikamien degeneratiivinen infektio (spondylodiskiitti) voi olla yleinen piirre ja perussyy vakaviin neurologisiin vaurioihin ja kipuihin, jos hoito viivästyy (Uçkay ym., 2010). Sen lisäksi, että taudinaiheuttajat tuodaan tahattomasti kirurgisesti suoraan selkärankaan, ne voivat päästä sinne myös selkärangan valtimo- ja laskimoverenkierron kautta (hematogeeninen leviäminen). Staphylococcus aureus, Escherichia coli ja Proteus -lajit eristetään yleisimmin, mutta P. acnes on tässä yhteydessä yleisin anaerobinen patogeeni, jonka esiintyvyys on todennäköisesti liian pieni viljelyhaasteiden vuoksi. On jonkin verran kliinistä näyttöä siitä, että potilailla, joilla on anaerobisten patogeenien yleensä ja erityisesti P. acnes -bakteerin infektoima välilevytyrä (nucleus pulposus), kehittyy todennäköisemmin viereisten nikamien tulehdus ja turvotus (Modicin muutokset tyypin I) ja selkäkipu (Albert ym., 2013; Urquhart ym., 2015). Kliiniset ja eläinpohjaiset seurantatutkimukset vahvistavat nyt alkuperäiset havainnot, jotka osoittavat, että paikallinen P. acnesin proliferaatio aiheuttaa Modic-muutosten kanssa yhdenmukaista tulehdusmarkkereiden ylössäätelyä ja levyn rappeutumista (Aghazadeh ym., 2016; Dudli ym., 2016). Nyt on jopa ensimmäistä kliinistä näyttöä siitä, että nikamavälilevyn P. acnesin ja/tai Staphylococcus epidermidiksen aiheuttama bakteeri-infektio voi itse asiassa edeltää kaikkia muita ongelmia levytyrän ja siihen liittyvien patologisten muutosten perimmäisenä syynä (Rajasekaran ym, 2017).
Parkinsonin tauti (PD)
Degeneroituville aivoille on ominaista hermoston vaurioituminen, joka voi johtua epätyypillisestä aggregaatiosta ja mutaattisten tai väärinfoldoituneiden proteiinien laskeutumisesta (esim. Lewyn kappaleet ja Lewyn neuriitit), kuten idiopaattisessa Parkinsonin taudissa on selvästi dokumentoitu (Taylor ym., 2002). Yleisesti ei kuitenkaan ymmärretä, että aivot ovat myös alttiit tunkeutuville patogeeneille viruksista ja bakteereista sieniin. Nämä patogeenit tai tarkemmin sanottuna niiden endogeeniset komponentit ja/tai aineenvaihduntatuotteet voivat aiheuttaa keskushermostoperäisiä neurologisia häiriöitä, jotka vaihtelevat hienovaraisista dementian ja dystonian merkeistä, jotka ovat seurausta kroonisesta, toistuvasta infektiosta (De Chiara ym., 2012; Bibi ym., 2014), vakavampiin motoneuronisairauksiin, kuten on havaittu esimerkiksi ihmisen endogeenisen retrovirus K:n yhteydessä (Li ym., 2015). Näin ollen on selvää, että ihmisillä on valtavan raskas systeeminen mikrobitaakka (Potgieter ym., 2015; Spadoni ym., 2015), joka voi sattumalta myötävaikuttaa sellaisten etenevien neurodegeneratiivisten sairauksien patologiaan, joilla on epätyypillinen proteiinikomponentti. Varmasti tämä työhypoteesi on saamassa huomattavaa tukea, sillä kognitiiviseen, emotionaaliseen tai patologiseen käyttäytymiseen näyttää epäsuorasti vaikuttavan suolisto-aivoakselin kautta vaikuttavien mikrobien alueellinen ja henkilökohtainen jakautuminen (kuva 5) (Collins et al., 2012; Dinan et al., 2013; Mayer et al., 2014; Burokas et al., 2015). Tuore tapaus-verrokkitutkimus osoittikin, että mikrobien vaihtelu ruoansulatuskanavassa sekä yksilöiden välillä että yksilöiden sisällä; vastaa merkittävimmin PD:n fenotyyppisiä vaihteluita (Scheperjans ym., 2015; Vizcarra ym., 2015). Vaikka taustalla olevat mekanismit, jotka yhdistävät mikrobiston koostumuksen PD:n eroihin, eivät ole selviä, edellä mainittu havainto saattaa ainakin selittää PD-potilailla havaittujen ruoansulatuskanavan poikkeavuuksien suuren esiintyvyyden (Dobbs ym., 2016). Yhdistämällä mikrobistoa edelleen PD:n vaikeusasteeseen PD-potilailta kerätyt sigman limakalvon biopsiat ja ulostemateriaali osoittivat, että niissä esiintyi opportunistisia ja pro-inflammatorisia bakteerilajeja, jotka usein aiheuttavat kroonista ummetusta, ärtyvän suolen oireyhtymää ja haavaista paksusuolitulehdusta (Keshavarzian ym., 2015). Yhdessä nämä alustavat tulokset viittaavat siihen, että suoliston erilaisten mikrobiyhteisöjen väliset suhteet ovat yleinen liitännäissairaus Parkinsonin taudissa ja että suoliston ekosysteemin ainutlaatuiset yksilölliset allekirjoitukset voivat vahvistaa Parkinsonin taudin klassisia motorisia häiriöitä.
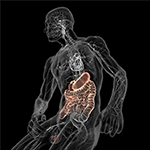
KUVIO 5. Suoliston ekosysteemi. Kaavamainen kuva suolisto-aivot-akselista (värillinen), jonka toisessa päässä on mikrobeilla täytetty ruoansulatusjärjestelmä ja toisessa päässä aivot homeostaasikeskuksineen (hypotalamus ja aivolisäke). Molemmat ovat yhteydessä toisiinsa sydän- ja verenkiertoelimistön ja autonomisen hermoston kautta, mukaan lukien vagushermo (kallohermo X), joka voi helpottaa mikrobien siirtymistä keskushermostoon (CNS). Ystävällisesti Bryan Christie Designin luvalla (http://bryanchristiedesign.com/).
Tämän taustan perusteella on kysyttävä, onko näyttöä siitä, että P. acnesilla on jokin rooli Parkinsonin taudin patofysiologiassa. Jotta tämä mahdollisuus toteutuisi, kahden edellytyksen on täytyttävä: (1) P. acnes -infektion on edeltävä taudin klassisten oireiden, kuten tärinän, moottorin käynnistymisen ja liikkeiden hitauden, ilmaantumista; ja (2) P. acnes -inokulaation on aiheutettava riittävästi Parkinsonin taudin oireita ja/tai johdettava dopamiiniprojektioneuronien häviämiseen substantia nigra pars compacta -nimisessä keskiaivojen ytimessä. Toistaiseksi laboratoriomme on havainnut P. acnes -ryhmiä, jotka ovat lokalisoituneet keskiaivojen neuroneihin ja läheisiin aivokuoren rakenteisiin autopsiassa otetuissa PD-aivoissa (kuva 6). Tämä odottamaton havainto lisää entisestään uskottavuutta sille, että P. acnes vaikuttaa epäsuorasti paikallisiin tulehdusjaksoihin, jotka ovat samanlaisia kuin sarkoidoosissa ja BPH:ssa havaitut. Avoimena kysymyksenä on, missä määrin P. acnes voi epäsuorasti lisätä tiettyjä PD:n patologisia piirteitä. Koska PD on erittäin heterogeeninen sairaus, on epätodennäköistä, että yksi tautimekanismi soveltuu kaikkiin PD-fenotyyppeihin. On kuitenkin kiehtovaa spekuloida, että ihon paikalliset mikrobit voisivat käynnistää tai voimistaa PD:n etenemistä tulehduksellisten ja/tai geneettisten alttiustekijöiden kautta.

Kuva 6. Immunohistokemia ihmisen PD-keskiaivokudosnäytteistä, jotka on värjätty P. acnesin (vihreä; A+B), neuronaalisten mikrotubulusten (MAP2; punainen; A) ja tuman (DAPI; sininen; A+B) suhteen. Ikäsidonnainen lipofussiinin autofluoresenssi sammutettiin Sudan Black B:llä. P. acnes -bakteerin (nuoli) esiintyminen ihmisen hermosolun (A) periplasmisessa tilassa tuman (n) ja sytoskeletin välissä; tai neutrofiili (B), jolla on sille ominainen monilohkoinen ydin keskiaivokapillaarin sisällä (Cap). Nämä löydökset ovat tyypillisiä Parkinsonin taudille ja puuttuvat useimmista kontrollileikkeistä. Retrogradiset liikkeet kallohermoja pitkin, trauman aiheuttamat mikroverenvuodot sekä äskettäin löydetty glymfaattinen järjestelmä edustavat potentiaalisia mikrobien kulkureittejä keskushermostoon.
Jos P. acnes voi päästä keskiaivojen dopamiinisoluihin, mikä on todennäköisin inokulaatio- ja infektioreitti? Vaikka iho on fyysisesti lokeroitu aivoista, ristiintartunta on edelleen riskitekijä. Esimerkiksi nenäontelossa voisi mahdollisesti olla patogeenisiä P. acnes -kantoja, jotka sitten siirtyisivät aivojen parenkyymiin hyperaktivoimaan paikallisia makrofageja, joita kutsutaan mikroglioiksi; ilmiö, joka on johdonmukainen piirre Parkinsonin taudin patologiassa (katsaus Chao et al., 2014). Sairaalainfektioita koskevat tutkimukset osoittavat, että niinkin erilaiset bakteerilajit kuin Pneumokokki sp. (Zwijnenburg ym., 2001) ja Salmonella sp. (Bollen ym., 2008) vaeltavat helposti hajuhermoa (aivohermo 1; CN 1) pitkin ja lopulta hajuhermoon. Toinen mahdollinen pääsyreitti haitallisille mikrobeille tai vaarallisille vääristyneille proteiineille on vagushermo (kallohermo 10; CN 10). Joissakin olosuhteissa Lewyn kappaleiden ja Lewyn neuriittien muodossa olevat vääristyneet aggregaatit näyttävätkin vaeltavan vagushermosta aivoihin, mikä antaa lisätodisteita siitä, että patogeeniset bakteerit yhdessä myrkyllisten proteiinien kanssa voivat mahdollisesti myötävaikuttaa hermosolujen valikoivaan haavoittuvuuteen (Holmqvist ym., 2014). Mielenkiintoista on, että CN 1:n ja CN 10:n aivojen ytimet ovat ensimmäisten paikkojen joukossa, joissa esiintyy ensisijaisesti Lewyn kappaleiden ja Lewyn neuriittien laskeutumista PD:n etenemisen aikana (Braak ym., 2004). Tämä erityinen havainto ei ainoastaan korosta bakteerien todennäköistä kulkureittiä aivoihin, vaan tarjoaa myös mahdollisen mekanismin havainnolle, jonka mukaan truncal vagotomy vähentää merkittävästi PD-riskiä (Svensson ym., 2015). Pään trauman ja PD:n välinen yhteys (Harris ym., 2013; Jafari ym., 2013; Pearce ym., 2015) sekä käsitys monimuotoisesta veren mikrobiomista (Potgieter ym., 2015) viittaavat laajaan patogeenisen opportunismin potentiaaliin, kun veri-aivoesteessä tapahtuu traumaattisia rikkomuksia. Kun äskettäin on löydetty aivojen lymfaattinen (glymfaattinen) järjestelmä (Iliff ym., 2012; Hitscherich ym., 2016), on otettava huomioon toinen potentiaalinen aivoinfektioreitti.
Kokonaisuutena on olemassa prekliinistä ja jonkin verran kliinistä näyttöä, joka epäsuorasti osoittaa P. acnesin olevan riippumaton muuttuja, joka vaikuttaa PD:n esiintyvyyteen tai vakavuuteen. Tätä näyttöä täydentävät raportit, joissa vaikea ihosairaus, acne inversa, yhdistetään Alzheimerin tautiin (Wang ym., 2010). Terapeuttisesta näkökulmasta katsottuna mahdollisuus, että P. acnes aiheuttaa tai vahvistaa Parkinsonin taudin ydinpiirteitä, on tärkeä resurssi neurodegeneratiivisten sairauksien antibioottisille lähestymistavoille. Ja tutkimuksen näkökulmasta olisi syytä tutkia tarkemmin potilaita, joilla on ihosairauksia, sellaisten neuropatologisten merkkien varalta, joilla tauti alkaa aikaisemmin ja joiden taudin fenotyyppi on vakavampi.
Tulevaisuuden näkymät
Tässä artikkelissa esitetyssä katsauksessa hahmotellaan P. acnesin odottamatonta pimeää puolta patologian suhteen. P. acnesin solunsisäinen pysyvyys liittyy keuhkojen ja eturauhasen sekä mahdollisesti aivojen sairauksiin. Tämä on selkeä todiste ihosta peräisin olevien bakteerien patogeenisuudesta tietyissä tauti-ilmiöissä. Jatkotutkimuksissa on keskityttävä useisiin P. acnesin biologiaan liittyviin kysymyksiin: (1) Mitkä ovat ratkaisevat P. acnesin vuorovaikutussuhteet tautialttiudessa? (2) Mitkä ovat ne mekanismit, joilla P. acnes vaikuttaa taudin etenemiseen? (3) Jos tietyt P. acnes -populaatiot voivat lisätä alttiutta taudin vaikeusasteelle, onko olemassa muita P. acnes -kokoonpanoja, jotka ovat suojaavia? (4) Todiste siitä, että P. acnes -infektio liittyy suoraan tautipatologiaan, tai tarkemmin sanottuna, osoittaako konseptitutkimus syy-yhteyden vai vain korrelaation? Ja lopuksi (5) Voidaanko P. acnesin aiheuttamaa tautipatologiaa hoitaa tavanomaisella antibioottihoidolla ja diagnostisilla sovelluksilla?
Tekijöiden panos
JL, KER, JC, KR, CH, AM, HB ja GT laativat käsikirjoituksen. JL ja MS laativat luvut.
Rahoitus
Intramuraalisen rahoituksen JL:lle myönsi NYIT College of Osteopathic Medicine.
Conflict of Interest Statement
Tekijät ilmoittavat, että tutkimus suoritettiin ilman kaupallisia tai taloudellisia suhteita, jotka voitaisiin tulkita mahdolliseksi eturistiriidaksi.