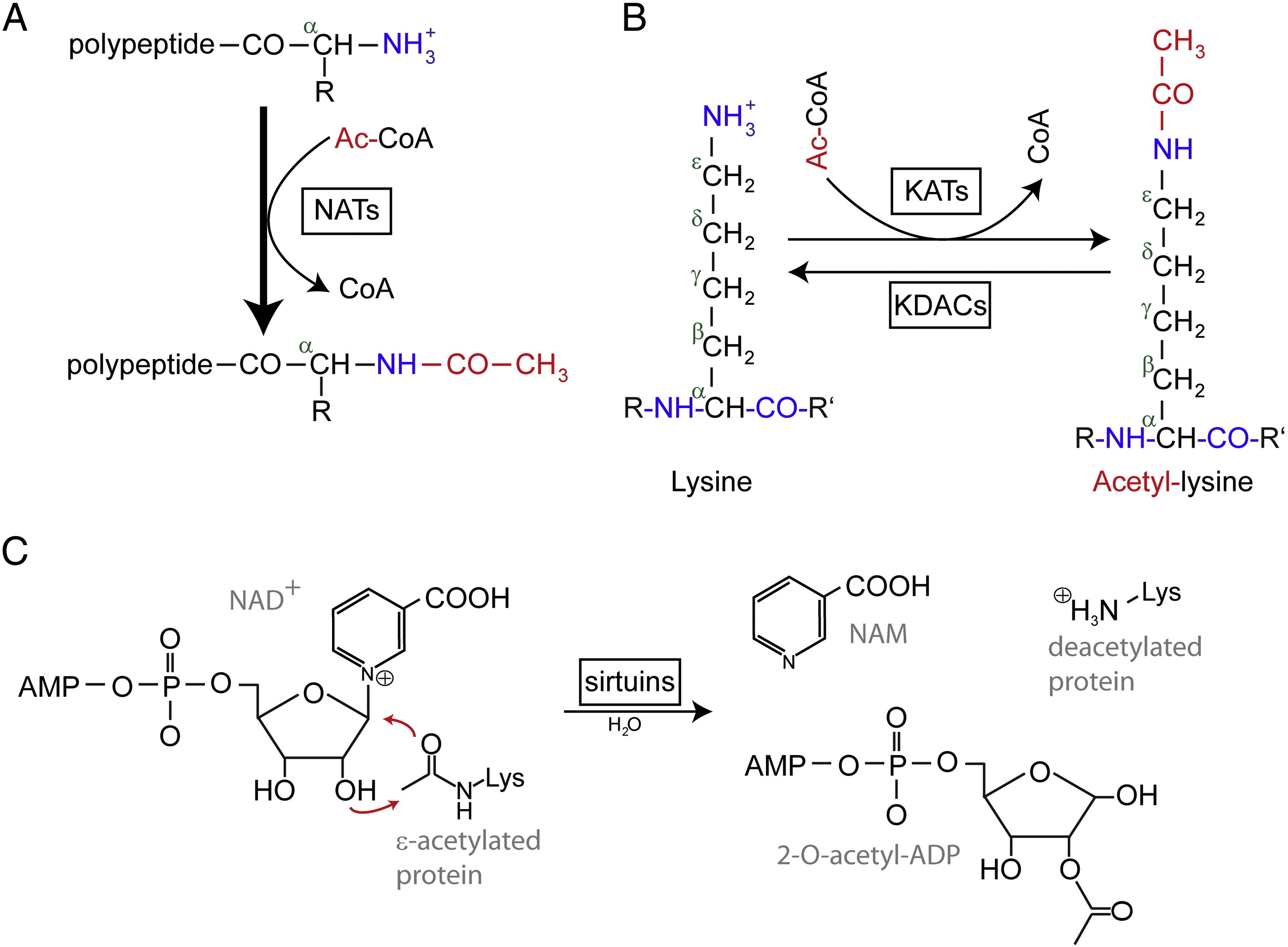
Asetylaatiolla tarkoitetaan reaktiota, jossa kemialliseen yhdisteeseen tuodaan asetyylifunktionaalinen ryhmä, jossa hydroksyyliryhmän vetyatomi korvataan asetyyliryhmällä (CH3 CO), jolloin saadaan tietty esteri, asetaatti. Proteiinien asetylaatiolla on yleisesti kaksi eri muotoa. Ihmisillä lähes (80-90 %) proteiinit asetyloituvat co-translationaalisesti syntyvien polypeptidiketjujen Nα-terminaaleissa. Toinen tyyppi asetyloidaan tyypillisesti lysiinijäämiin.
N-terminaalinen asetylaatio
N-terminaalista (Nt) asetylaatiota katalysoivat Nt-asetyylitransferaasit (Nt-acetyltransferaasit, NAT), ja sen on toistaiseksi todettu olevan palautumatonta. NAT:t ovat mono- tai moniyksikköisiä entsyymejä, jotka koostuvat katalyyttisestä alayksiköstä ja enintään kahdesta ylimääräisestä alayksiköstä, ja ne voivat siirtää asetyyliryhmän asetyylikoentsyymi A:sta (Ac-CoA) proteiinin ensimmäisen aminohappojäännöksen α-aminoryhmään. NAT:issa tärkein apuyksikkö moduloi katalyyttisen alayksikön aktiivisuutta ja substraattispesifisyyttä. Nt-asetylaatiosta vastaavat eri NAT:t. Ihmisistä on tähän mennessä löydetty kuusi NAT:ia, mukaan lukien NatA, NatB, NatC, NatD, NatE ja NatF. Sen lisäksi, että alayksiköiden koostumuksessa on eroja, eri NATit eroavat toisistaan myös substraattispesifisyydeltään.
Nt-asetylaatiolla on erilaisia rooleja molekyylivaikutuksissa. Ensinnäkin Nt-asetylaatio määrittää tiettyjen proteiinien subcellulaarisen lokalisaation. Esimerkiksi Arl3 ja Grh1, kaksi Golgi-assosioitunutta proteiinia, eivät voi assosioitua Golgi-laitteistoon, jos Nt-asetyyliryhmä puuttuu. Toiseksi on raportoitu, että Nt-asetylaatio hillitsee proteiineja sytosolissa ja estää translaation jälkeisen translokaation siirtymisen endoplasmiseen retikulumiin (ER) ja eritysreitille. Lisäksi Nt-asetylaatio voi muuttaa N-terminaalin ominaisuuksia, jolloin proteiini-proteiini-interaktiot muuttuvat. Useiden proteiinien osalta osoitettiin, että affiniteetti niiden sitoutumiskumppaneihin kasvoi Nt-asetyloinnin jälkeen. Esimerkiksi E2-ubikitiinikonjugaatioentsyymi Ubc12:n Nt-asetylointi NatC:n avulla lisää affiniteettia sen vuorovaikutuskumppania, E3-ubikitiiniligaasi Dcn1:tä, kohtaan. Lisäksi Nt-asetylaatio kontrolloi proteiinien laatua ja elinikää ja säätelee proteiinien stoikiometriaa N-end rule -reitillä.
N-terminaalisella asetylaatiolla on monia tehtäviä fysiologiassa. NAT:t ovat välttämättömiä normaalille kehitykselle, luuston ja verisuonten kehitykselle. N-terminaalinen asetylaatio voi säädellä verenpainetta, proteasomin lokalisaatiota, hormonia sekä organellien rakennetta ja toimintaa. Ihmisen sairauksissa se liittyy neurodegeneratiivisiin sairauksiin (kuten Alzheimerin tauti, Parkinsonin tauti ja Lewyn kappaleen dementia) ja syöpään (kuten keuhkosyöpä, rintasyöpä, paksu- ja peräsuolisyöpä).
Lysiiniasetylaatio
Asetyloidut lysiinijäämät löydettiin ensimmäisenä geenien transkriptiota säätelevistä histoneista. Lysiiniasetylaatio ei kuitenkaan rajoitu histoneihin. Toisin kuin Nt-asetylaatio, lysiiniasetylaatio on palautuvaa. Asetylaatiota katalysoivat lysiiniasetyylitransferaasit (KAT) ja lysiinijäämien deasetylaatiota lysiinideasetylaasit (KDAC).
On raportoitu, että ihmisen genomissa on tunnistettu 17-22 geeniä KAT:eja (KAT:ien tarkka lukumäärä on kiistanalainen), jotka voidaan luokitella kolmeen eri perheeseen, mukaan lukien GCN5 (general control non-derepressible 5) -perheeseen liittyvä asetyylitransferaasiperhe (GNAT), MYST-perhe ja p300/CBP-perhe (CREB-sitova proteiini). KAT-kompleksien tunnettuja substraatteja ovat histoniproteiinien lisäksi eräät erilaiset transkriptiotekijät, transkription yhteissäätäjät ja jotkin solun erityisten signaalireittien proteiinit, kuten p53, β-kateniini, NF-κB, MyoD tai Rb. Jopa jotkin RNA-molekyylit voivat olla asetyloidut. KDACeja on neljää eri tyyppiä, mukaan lukien luokka I, II, III ja IV. Luokat I, II ja IV ovat Zn2 + -riippuvaisia amidohydrolaaseja, kun taas luokka III (joita kutsutaan myös sirtuineiksi) käyttää katalyyttisen aktiivisuutensa osasubstraattina NAD+:a. Luokka III (jota kutsutaan myös sirtuineiksi) käyttää katalyyttiseen aktiivisuuteensa NAD+:a. Ne ovat Zn2 + -riippuvaisia amidohydrolaaseja.
Histonit ovat ensimmäiset löydetyt asetyloituneet proteiinit. Histonimolekyylejä muokataan erilaisilla PTM:illä, kuten fosforylaatiolla, metylaatiolla ja asetylaatiolla. histonien asetylaatio määrittää histonien kokoonpanon sekä DNA:n ja histonien välisen vuorovaikutuksen taittumisen ja tiiviyden ja esittää näin ollen kytkennän sallivan ja repressiivisen kromatiinirakenteen välillä. Histonien lisäksi KAT:t voivat katalysoida sytoskelettiproteiineja. Muissa proteiineissa, kuten HMG-proteiineissa, c-Myc:ssä, estrogeeni- ja androgeenireseptoreissa, E2F/Rb:ssä ja niin edelleen, on tunnistettu joitakin uusia asetylaatiokohtia.
Lysiiniasetylaation fysiologisista tehtävistä on raportoitu. Histoniproteiinit liittyvät tiukkaan säätelyyn olennaisesti kaikentyyppisissä DNA:n ohjaamissa prosesseissa, kuten transkriptiossa, replikaatiossa, rekombinaatiossa, korjauksessa sekä translaatiossa ja erikoistuneiden kromatiinirakenteiden muodostamisessa. Siksi proteiinien lysiiniasetylaatio vaikuttaa useisiin solujen signaalireitteihin sekä aineenvaihduntaan, stressivasteisiin, apoptoosiin ja kalvojen liikenteeseen.
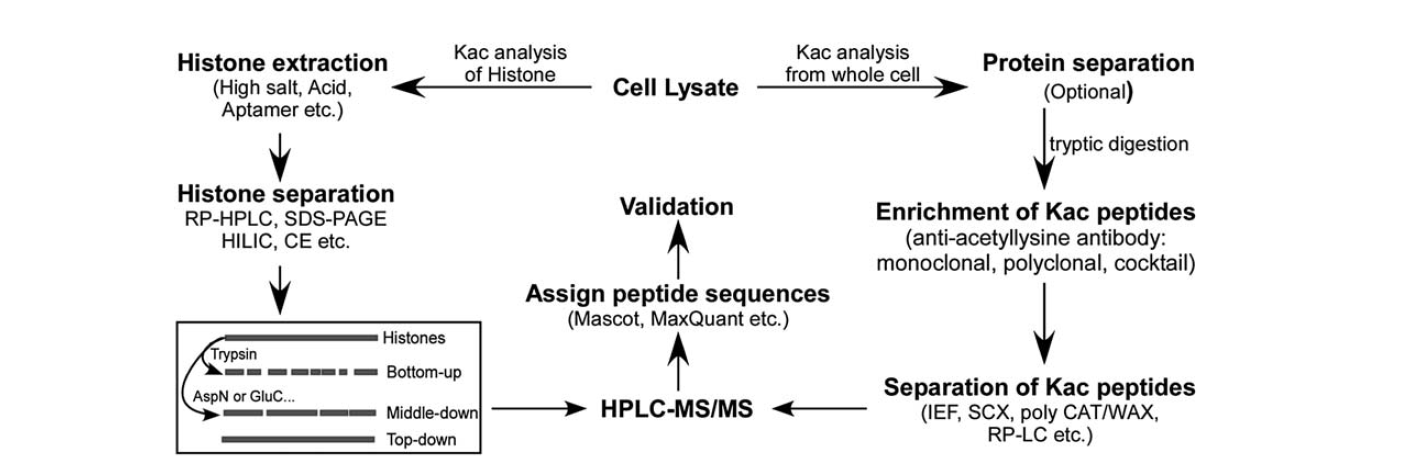
Lysiiniasetylaation tunnistamiseen on käytettävissä suhteellisen vähän välineitä. Massaspektrometrian kehittymisen myötä siitä on tullut tärkeä väline lysiiniasetylaation tunnistamiseen ja kvantifiointiin. Histonin lysiiniasetylaation analysointiin kuuluu useita vaiheita, kuten solulysaatti, histoniuutto, histonierotus, massaspektrometria ja data-analyysi. Proteiinien lysiiniasetylaation analysointiin koko solusta kuuluvat seuraavat vaiheet: solulysaatti, proteiinien erottelu, lysiiniasetylaatiopeptidien rikastaminen, lysiiniasetylaatiopeptidien erottelu, massaspektrometria ja data-analyysi.