Trendi 2: Tietyn keskeisen atomin omaavilla oksohapoilla happamuus lisääntyy keskeisen alkuaineen hapetusasteen eli toisin sanoen keskeiseen atomiin sitoutuneiden happiyhdisteiden lukumäärän kasvaessa.
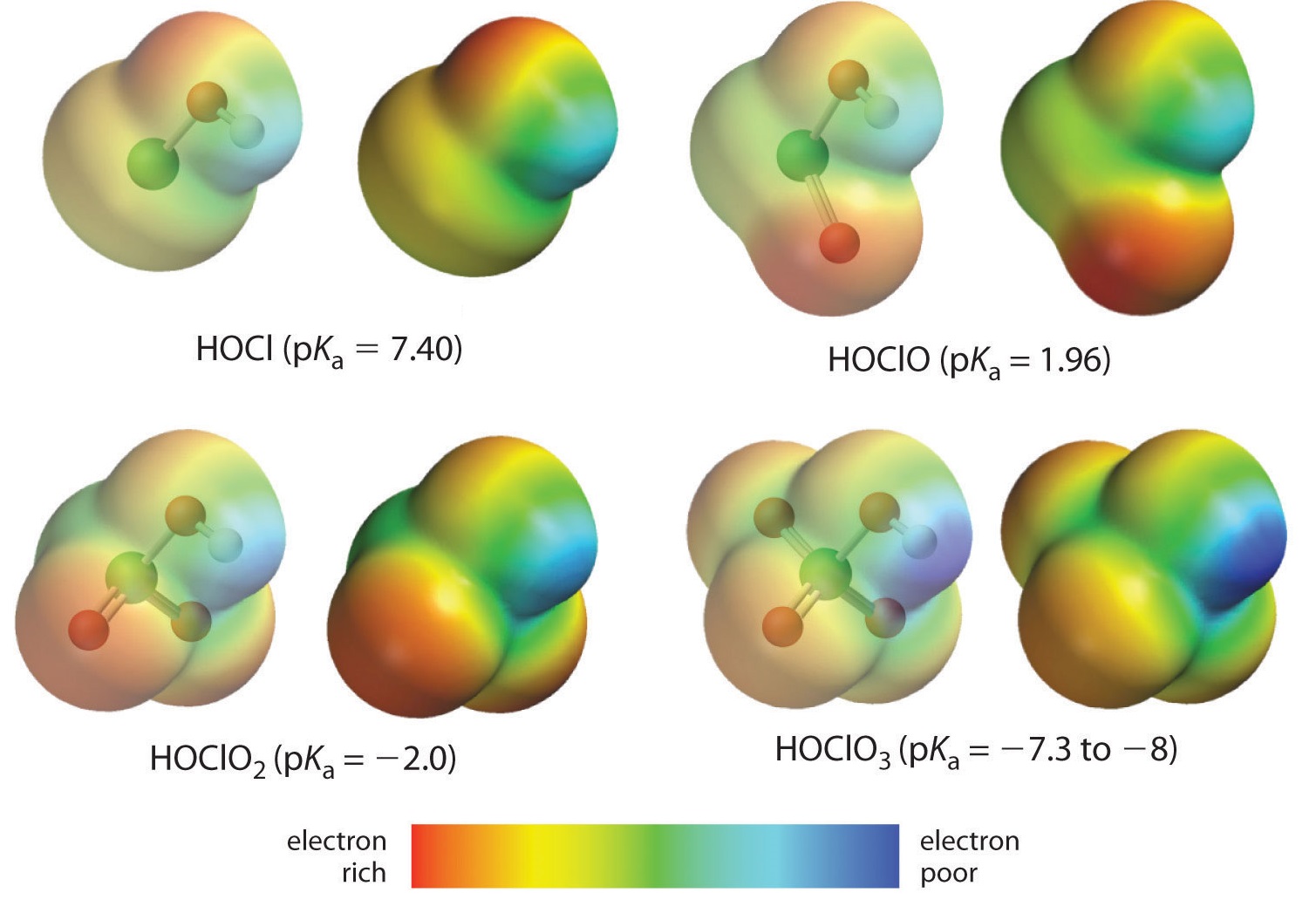
Tässä tarkastelemme trendiä happojen kohdalla, joissa tiettyyn keskeiseen atomeihin sitoutuu vaihteleva määrä happia. Esimerkkeinä ovat perkloorihappo (\(\ce{ClO_4^{-}}}\)), kloorihappo (\(\ce{ClO_3^{-}}\)), kloorihappo (\(\ce{ClO_2^{-}}}\)) ja hypokloosihappo (\(\(\ce{ClO^{-}}}\)). Näissä sarjoissa happo on sitä vahvempi, mitä suurempi on happogeenejä. Tämä voidaan selittää usealla tavalla. Itse hapon kannalta avaintekijä on jälleen induktiivinen vaikutus, joka tässä tapauksessa liittyy keskusatomiin kiinnittyneiden happigeenien kykyyn vetää elektronitiheyttä OH-sidoksen yli. Tämä käy ilmi kuvassa \(\PageIndex{1}\) esitetystä kloorin oksohappojen varaustiheysdiagrammista, jossa hapon vedyn osittainen positiivinen varaus kasvaa läsnä olevien hoksigeenien lukumäärän myötä.
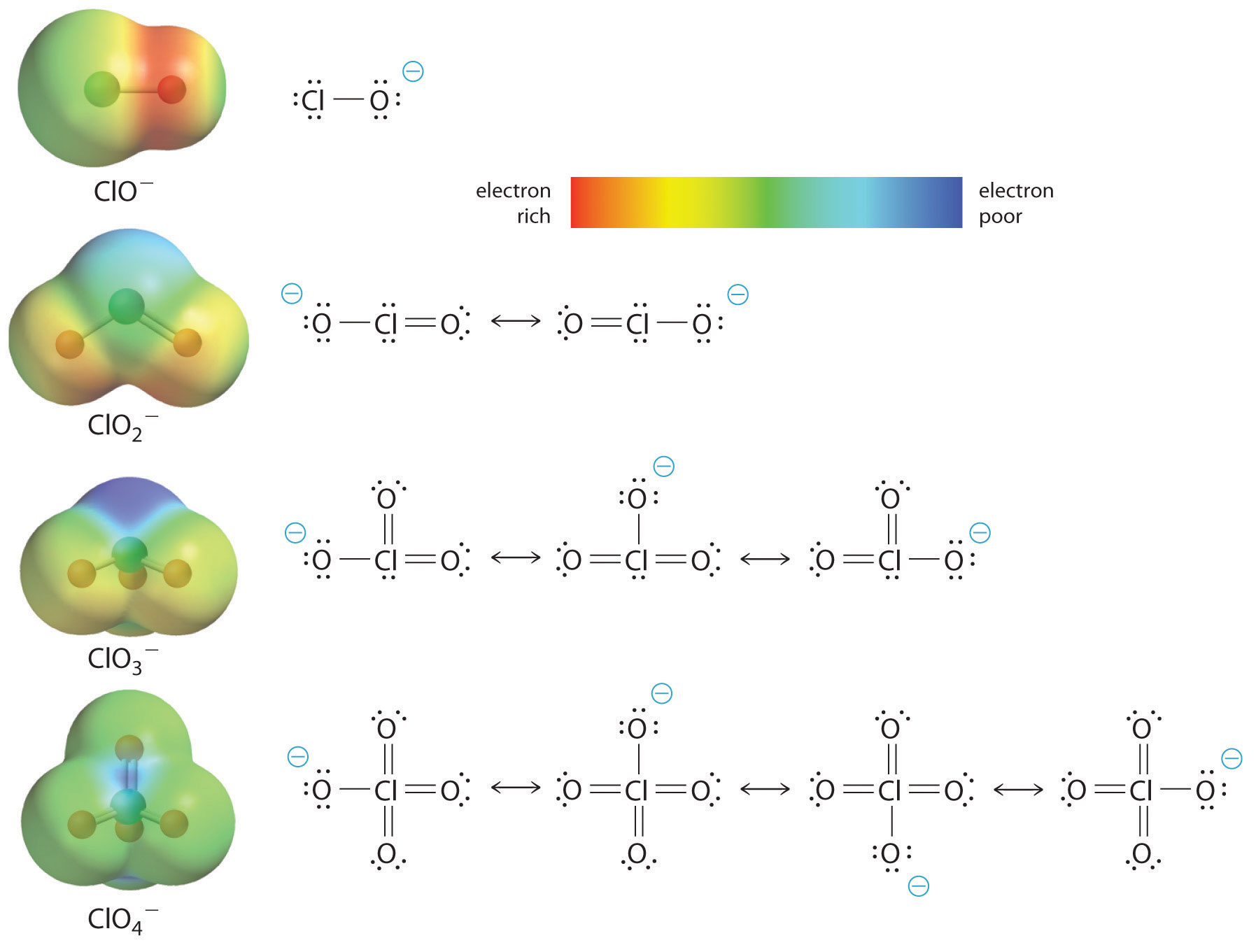
Oksihapon happamuuden lisääntyminen keskusatomiin sitoutuneiden happigeenien lukumäärän myötä voidaan nähdä myös tarkastelemalla konjugoidun happianionin stabiilisuutta. Se, että konjugaattiemäksen stabiilisuus kasvaa hoksigeenien lukumäärän kasvaessa, voidaan nähdä kuvassa \(\PageIndex{2}\) esitetyistä kloorin oksyanionien varausjakaumakaavioista ja Lewisin sidosmalleista. Kun negatiivinen varaus jakautuu useammalle happiatomille, siitä tulee yhä hajanaisempi.
Harjoitus \(\PageIndex{1}\)
Rikki ja seleeni muodostavat kumpikin oksohappoja kaavalla \(\ce{H_2EO_4}\), jossa E on joko S tai Se. Näitä kutsutaan vastaavasti rikkihapoksi ja seleenihapoksi. Kumman oksohapon luulisi olevan happamampi: seleenihapon vai rikkihapon?
Vastaus
Rikkihapon pitäisi olla happamampi. Koska rikki on elektronegatiivisempi kuin seleeni, rikki polarisoi OH-sidoksia enemmän, mikä tekee niistä happamampia. Tämän ennusteen vahvistaa happojen \(pK_a\)-arvojen vertailu:
| Happo | \(pK_{a1}\) | \(pK_{a2}\) |
|---|---|---|
| rikkihappo, \(H_2SO_3\) | 1.85 | 7.2 |
| selenihappo, \(H_2SeO_3\) | 2.62 | 8.32 |