US Pharm. 2018;43(9):21-26.
ABSTRACT: La terapia hormonal sustitutiva (THS) es el tratamiento más eficaz para los síntomas vasomotores y genitourinarios asociados a la menopausia. Los efectos adversos asociados a la THS dependen de varios factores, como la dosis, la vía, la duración del uso, el momento de inicio y la elección del agente. La decisión de iniciar la THS debe incluir una evaluación del riesgo, y la THS debe ser individualizada para la paciente. Las numerosas opciones de THS existentes se presentan en una amplia gama de dosis y formas farmacéuticas. Los farmacéuticos deben ser capaces de aconsejar a las pacientes sobre la THS y sus efectos secundarios.
La mujer media vivirá un tercio de su vida en la menopausia o después de ella.1 El tratamiento de los síntomas de la menopausia ha adquirido una importancia creciente debido a la morbilidad asociada al envejecimiento de la mujer.2 La terapia hormonal sustitutiva (THS), término utilizado para describir la terapia con estrógenos, la terapia combinada de estrógenos y progesterona, o la terapia con agonistas o antagonistas de los receptores de estrógenos, sigue desempeñando un papel importante en la mitigación de los síntomas perimenopáusicos y posmenopáusicos.3 Aunque la experiencia de cada mujer es diferente, los síntomas vasomotores (SVM) y los síntomas vulvovaginales son dos de las quejas más comunes asociadas a los cambios hormonales que conlleva la menopausia.4
Síntomas de la menopausia
Los SVM son algunos de los síntomas menopáusicos más comunes y más molestos. Los sofocos, que se caracterizan por una sensación repentina de calor en la parte superior del pecho y la cara que dura de 2 a 4 minutos, se producen en aproximadamente el 75% de las mujeres menopáusicas.1 Otros posibles SVM son la sudoración, las palpitaciones y la ansiedad.1 Los SVM se han asociado con una disminución de la calidad del sueño, la irritabilidad, la dificultad para concentrarse y la reducción de la calidad de vida.3 Además, estos síntomas se han relacionado con riesgos cardiovasculares, óseos y cognitivos.5-9 Desde hace tiempo se reconoce que la THS es el tratamiento más eficaz para el SVM.4,10
Además de los molestos SVM, muchas mujeres experimentan síntomas vulvovaginales. Se calcula que entre el 10% y el 40% de las mujeres experimentan atrofia vaginal.3 La atrofia vaginal puede causar dolor, ardor y picor vulvar; sequedad vaginal; flujo vaginal; dispareunia (coito difícil o doloroso); y manchado o sangrado después del coito.1 Estos síntomas suelen aparecer en la etapa posmenopáusica tardía y pueden provocar molestias con la ropa ajustada, al sentarse o hacer ejercicio, o con la actividad sexual.1 Normalmente se recomienda la THS tópica para el tratamiento de los síntomas vulvovaginales.1
Además de aliviar los síntomas mencionados anteriormente, existen pruebas de que la THS estándar a dosis bajas también puede prevenir las fracturas posmenopáusicas de cadera, de columna y no vertebrales.10 Los beneficios de la THS para el SVM y los síntomas genitourinarios incluyen la mejora de la vejiga hiperactiva, la disminución de los trastornos del sueño, la reducción del riesgo de diabetes de tipo 2, la posible protección frente a la enfermedad arterial coronaria (EAC) y el infarto de miocardio, la disminución del riesgo de osteoporosis o fractura y la posible reducción de la mortalidad por todas las causas.1,10 Sin embargo, los beneficios que la THS confiere a la densidad ósea disminuyen rápidamente tras su interrupción. Además, aunque algunos productos están aprobados por la FDA para la prevención de la osteoporosis, ninguno de ellos está actualmente aprobado para el tratamiento de la misma. Los principales riesgos asociados con el uso de estos agentes incluyen el tromboembolismo venoso (TEV), el accidente cerebrovascular isquémico, el aumento de la incidencia de cáncer de endometrio (si se utiliza un estrógeno sin oposición en una mujer con útero) y el aumento del riesgo de cáncer de mama cuando la THS se utiliza más allá de 3 a 5 años.4,10
Productos de THS disponibles
Existe una amplia gama de productos de THS en varias formas de dosificación.4 De las preparaciones orales, las opciones incluyen estrógenos equinos conjugados (CEE), 17-beta estradiol micronizado (micronizado para mejorar la absorción), estrógenos esterificados, etinilestradiol (una preparación de estrógeno muy potente que se utiliza en dosis mucho más bajas para la THS que para la anticoncepción oral), comprimidos de combinación de estrógeno-progestina y un comprimido de combinación CEE/bazedoxifeno.4
El comprimido de CEE/bazedoxifeno, una combinación de estrógenos y un modulador selectivo de los receptores de estrógenos, está disponible en los Estados Unidos para el tratamiento del SMV menopáusico y la prevención de la osteoporosis. En esta combinación, el bazedoxifeno previene la hiperplasia endometrial inducida por los estrógenos, haciendo innecesaria la administración de una progestina. Sin embargo, el bazedoxifeno se asocia a un mayor riesgo de TEV.4 El uso de bazedoxifeno se ha considerado seguro cuando se ha estudiado durante un máximo de 7 años en el tratamiento de la osteoporosis, pero la combinación sólo se ha estudiado durante periodos más cortos.11,12 Los ensayos de EMV de hasta 2 años de duración no han demostrado un aumento de la incidencia de sensibilidad mamaria ni del riesgo de cáncer de mama.3 Las directrices actuales recomiendan el uso de CEE/bazedoxifeno en mujeres posmenopáusicas con útero y sin contraindicaciones para tratar el SMV y ayudar a prevenir la pérdida ósea, pero no especifican la duración de la terapia.1 Basándose en las pruebas disponibles, el tratamiento del SMV con CEE/bazedoxifeno durante un máximo de 2 años parece seguro; la seguridad del uso más allá de 2 años sigue sin estar clara.
La THS también está disponible en varias aplicaciones tópicas. Existen preparados de parches transdérmicos de 17-beta estradiol o combinaciones de estrógeno-progestina. Otras preparaciones tópicas incluyen paquetes de gel o bombas de dosis medida, aerosoles y emulsiones.4 También se pueden considerar las inyecciones de depósito, pero estos productos se utilizan raramente en el contexto de la THS.4 En la TABLA 1 se ofrece un resumen de las formulaciones de THS sistémicas disponibles.13-15
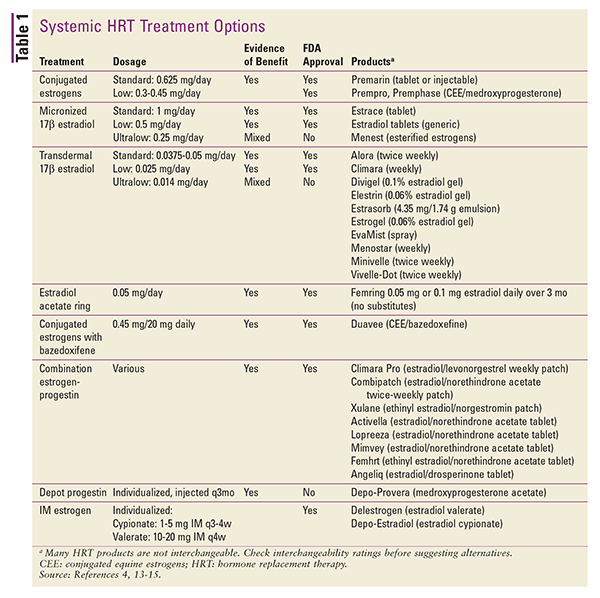
Al convertir de una forma de dosificación a otra, las diferencias en la vía de administración y la potencia del producto pueden tenerse en cuenta utilizando equivalentes de dosis estimados.4 Los equivalentes de dosis para las preparaciones orales son los siguientes: 1 mg de 17-beta estradiol micronizado equivale a 1,25 mg de sulfato de piperazina de estrona. En las conversiones entre las preparaciones de estrógeno orales y transdérmicas, 0,05 mg/24 horas transdérmicas equivalen a aproximadamente 0,625 mg diarios por vía oral.4
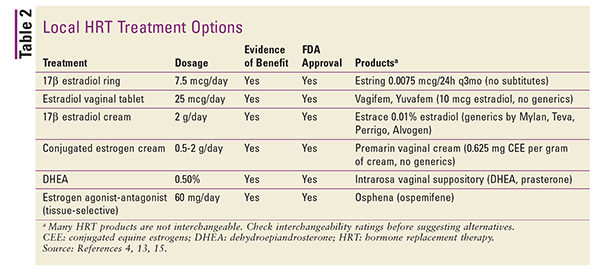
Las preparaciones locales son generalmente de dosis bajas y se utilizan específicamente para el tratamiento de los síntomas de la atrofia vulvovaginal.4 Se pueden utilizar dosis más altas para el tratamiento del SMV sistémico, pero generalmente no se recomienda.4 Las preparaciones locales incluyen anillos vaginales, comprimidos y cremas. Consulte la TABLA 2 para ver un resumen de las fórmulas de THS locales disponibles.4,13,15
Recomendaciones de las directrices actuales
Tres organizaciones -el Colegio Americano de Obstetras y Ginecólogos, la Sociedad Norteamericana de Menopausia (NAMS) y la Sociedad Endocrina- han elaborado directrices sobre el uso de la THS en la menopausia. Como se indica en estas directrices, las indicaciones de la THS incluyen el manejo del SVM asociado a la menopausia y el tratamiento de los efectos vulvovaginales en ausencia de síntomas sistémicos molestos.1,3,4 Se ha comprobado que los estrógenos solos o en combinación con una progestina reducen el SVM semanal en un 75% y reducen significativamente la gravedad de los síntomas en comparación con el placebo.4
En las mujeres menores de 60 años que tienen menos de 10 años después de la menopausia, tienen un SMV molesto y no tienen contraindicaciones para la THS o un riesgo cardiovascular o de cáncer de mama excesivo, se recomienda el uso de la terapia de estrógeno solo para las que no tienen útero. Se recomienda la adición de un progestágeno en pacientes con útero para prevenir la hiperplasia endometrial y el posible cáncer de endometrio.1,3,4 En la actualidad, no está clara la exposición requerida al progestágeno, pero muchos proveedores administran progestágenos en un ciclo de 14 días cada mes.4 Para las mujeres mayores de 60 años o que han pasado más de 10 años de la menopausia, se recomienda considerar otras terapias (no hormonales) en lugar de la THS.3
En mujeres con un riesgo elevado de enfermedad cardiovascular (ECV; definido como >10% de riesgo de ECV a 10 años según la herramienta de estimación del riesgo cardiovascular del American College of Cardiology/American Heart Association), se prefieren las terapias no hormonales.3 En las mujeres con un riesgo moderado de ECV, se prefiere el uso de estrógenos transdérmicos con o sin progestina en lugar del tratamiento oral, ya que estos preparados tienen un menor efecto sobre la presión arterial, los lípidos y el metabolismo de los hidratos de carbono.1 En las pacientes con un riesgo elevado de TEV, se prefiere el uso de las vías no orales a la dosis efectiva más baja. Por último, en pacientes con riesgo alto o intermedio de cáncer de mama, se da preferencia a las terapias no hormonales.4
Si se selecciona la THS, todas las directrices recomiendan el uso de la dosis efectiva más baja.1,4,10 Un beneficio de las dosis más bajas de THS es el mejor perfil de efectos secundarios en comparación con los regímenes de dosis altas.4 Actualmente no existe una vía de terapia preferida para el tratamiento del SMV; por lo tanto, la vía de administración debe guiarse por la preferencia de la paciente. Debe tenerse en cuenta que los productos transdérmicos pueden estar asociados a una menor incidencia de efectos adversos, como el TEV, pero todavía se están realizando estudios.10
Para el tratamiento de los síntomas genitourinarios en mujeres sin antecedentes de cánceres hormonodependientes, pueden utilizarse dosis bajas de estrógenos vaginales.1 Para los síntomas vaginales únicamente, las directrices recomiendan que no se añada progestina, independientemente de la presencia del útero. Esta terapia también puede ser apropiada en pacientes con antecedentes de cánceres dependientes de hormonas, pero en esos casos, la elección de la terapia debe basarse en un proceso de toma de decisiones compartido que incluya la discusión de los riesgos y beneficios. Los beneficios potenciales de los estrógenos vaginales incluyen la rápida mejora de los síntomas vaginales y urinarios y la posible prevención de las infecciones urinarias recurrentes. Las terapias no estrogénicas aprobadas por la FDA y acordes con las directrices que se utilizan para aliviar la dispareunia incluyen el ospemifeno y la dehidropiandrosterona intravaginal.16,17
La terapia con sólo progestina, la testosterona, las terapias alternativas no hormonales a base de plantas y las hormonas bioidénticas compuestas carecen de datos y, por lo general, no se recomiendan.1,4 La NAMS afirma que los prescriptores pueden considerar la TRH compuesta en situaciones en las que una paciente no pueda tolerar las terapias aprobadas por la FDA.3 Las opciones de tratamiento no hormonal para los síntomas vasomotores incluyen los inhibidores selectivos de la recaptación de serotonina y los inhibidores selectivos de la recaptación de serotonina-norepinefrina, la clonidina y la gabapentina, y el tratamiento no hormonal para los síntomas vaginales incluye los lubricantes, los antagonistas de los estrógenos y los remedios a base de hierbas.4 La evidencia que apoya el uso de terapias no hormonales varía, y no todas las opciones tienen evidencia probada o una indicación aprobada por la FDA.4
El seguimiento de la THS debe incluir exámenes regulares de cáncer de mama durante y después de la finalización de la terapia. Las hemorragias recurrentes no programadas deben evaluarse rápidamente.1 La duración de la terapia debe revisarse al menos una vez al año, y es preferible la duración más corta del tratamiento.1 Cuando las pacientes y los proveedores deciden interrumpir la THS, se puede utilizar una estrategia de reducción o de interrupción brusca. Se carece de evidencia respecto a los métodos de interrupción; por lo tanto, se recomienda la toma de decisiones compartida para el proceso de interrupción.1,4
Interacciones medicamentosas
La mayoría de los productos de THS disponibles en el mercado (TABLA 1) sufren un metabolismo hepático mediado por el sistema CYP450.15 Específicamente, los productos de estrógeno son parcialmente metabolizados por el CYP3A4; por lo tanto, los inductores fuertes del CYP3A4 pueden reducir la eficacia de la TRH de estrógeno y los inhibidores fuertes pueden aumentar las concentraciones séricas de estrógeno. Además, otros fármacos sustratos para estas enzimas pueden interferir con el metabolismo de la THS.15
Efectos secundarios graves y comunes
Los principales efectos secundarios asociados a la THS incluyen ECV, cáncer de mama, cáncer de endometrio o de ovario, ictus y TEV.1 El uso de estrógenos sin oposición aumenta el riesgo de hiperplasia y cáncer de endometrio, de ahí que se recomiende la adición de progestágenos en mujeres con útero. En cuanto al riesgo de cáncer de mama, parece haber un pequeño riesgo de desarrollar cáncer de mama cuando una mujer toma estrógenos durante 5 años.3 La bibliografía actual no es consistente en cuanto a la determinación del riesgo de desarrollar cáncer de ovario a causa de la THS.3 Se necesitan más ensayos aleatorios y controlados para determinar el verdadero riesgo de desarrollar cáncer de ovario con el uso de la THS.1 Los efectos de la THS sobre la enfermedad arterial coronaria (EAC), el ictus y la TEV varían en función de la edad de la mujer en el momento de iniciarla o del tiempo transcurrido desde el inicio de la menopausia. Parece que las mujeres que toman THS durante más de 10 años desde el inicio de la menopausia tienen un mayor riesgo de desarrollar EAC.3 En general, los estudios sugieren que las formulaciones orales y transdérmicas de dosis más bajas confieren un menor riesgo de ictus y TEV en comparación con la THS de dosis estándar.3 Las pacientes que tienen más de 60 años en el momento de iniciar la THS o que llevan más de 10 años desde el inicio de la menopausia tienen un mayor riesgo de sufrir estos efectos adversos. Además, las mujeres que toman THS con estrógenos solos o combinados tienen un mayor riesgo de padecer cálculos biliares, colecistitis y colecistectomía.3 El riesgo de enfermedad de la vesícula biliar se ha asociado con el uso de THS oral y puede no existir con las formulaciones tópicas o transdérmicas.1,3
Contraindicaciones
Las directrices de las sociedades profesionales no han especificado una lista de contraindicaciones absolutas o relativas a la THS.2 Por lo tanto, como en la mayoría de las decisiones clínicas, es importante una evaluación individualizada de los riesgos y beneficios. En general, la THS debe evitarse en pacientes con hemorragias vaginales inexplicables; antecedentes de ictus o accidente isquémico transitorio; infarto de miocardio; embolia pulmonar o TEV; cáncer de mama o de endometrio; enfermedad hepática activa; deficiencia conocida de proteína C, proteína S o antitrombina u otros trastornos trombofílicos; y embarazo conocido o sospechado.1 Además, debe tenerse precaución en pacientes con diabetes, enfermedad de la vesícula biliar, hipertrigliceridemia (>400 mg/día), hipoparatiroidismo, meningioma benigno, riesgo intermedio o alto de cáncer de mama, alto riesgo de enfermedad cardíaca o migraña con aura.2
Puntos de asesoramiento
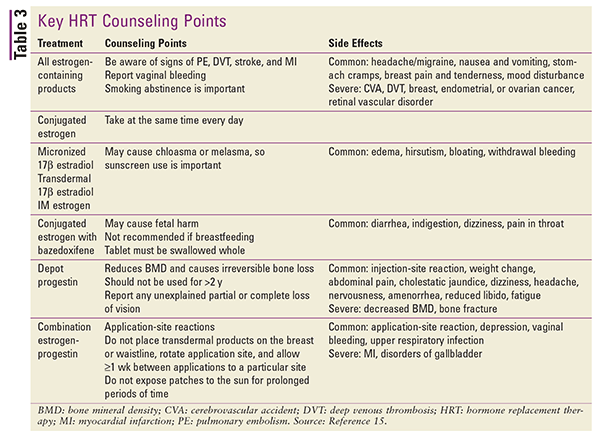
Consulte la TABLA 3 para ver un resumen de los puntos clave de asesoramiento al paciente y los efectos secundarios de los distintos tipos de THS.15
Conclusión
La THS, que está disponible en una amplia gama de preparados, es el tratamiento más eficaz tanto para el SMV como para los síntomas genitourinarios. Dado que los riesgos asociados a la THS son diferentes para cada mujer, el tratamiento debe ser individualizado y dirigido a maximizar la eficacia, minimizar la duración de la terapia y reducir el riesgo de efectos adversos. En los casos en los que la THS no es una opción, existen opciones de tratamiento no hormonal tanto para el SMV como para los síntomas genitourinarios, pero la eficacia y la aprobación de estos productos por parte de la FDA varían; por lo tanto, deben revisarse los datos de eficacia de estos productos.
1. Stuenkel CA, Davis SR, Gompel A, et al. Tratamiento de los síntomas de la menopausia: una guía de práctica clínica de la Sociedad Endocrina. J Clin Endocrinol Metab. 2015;100(11):3975-4011.
2. Shifren JL, Schiff I. Papel de la terapia hormonal en el manejo de la menopausia. Obstet Gynecol. 2010;115(4):839-855.
3. El panel asesor de la declaración de posición de la terapia hormonal de la NAMS 2017. La declaración de posición de la terapia hormonal 2017 de la Sociedad Norteamericana de Menopausia. Menopausia. 2017;24(7):728-753.
4. Boletín de práctica del ACOG nº 141: manejo de los síntomas de la menopausia. Obstet Gynecol. 2014;123(1):202-216.
5. Thurston RC, Sutton-Tyrrell K, Everson-Rose SA, et al. Sofocos y enfermedad cardiovascular subclínica: hallazgos del Estudio de la Salud de la Mujer en toda la Nación Heart Study. Circulation. 2008;118(12):1234-1240.
6. Thurston RC, Kuller LH, Edmundowicz D, Matthews KA. Historia de los sofocos y la calcificación aórtica entre las mujeres posmenopáusicas. Menopausia. 2010;17(2):256-261.
7. Thurston RC, Sutton-Tyrrell K, Everson-Rose SA, et al. Hot flashes and carotid intima media thickness among midlife women. Menopausia. 2011;18(4):352-358.
8. Crandall CJ, Aragaki A, Cauley JA, et al. Associations of menopausal vasomotor symptoms with fracture incidence. J Clin Endocrinol Metab. 2015;100(2):524-534.
9. Maki PM. Memoria verbal y menopausia. Maturitas. 2015;82(3):288-290.
10. Sociedad norteamericana de menopausia. La declaración de posición de la terapia hormonal 2012 de: La Sociedad Norteamericana de Menopausia. Menopausia. 2012;19(3):257-271.
11. Palacios S, Silverman SL, de Villiers TJ, et al. Ensayo aleatorizado y controlado con placebo de 7 años de duración que evalúa la eficacia y seguridad a largo plazo del bazedoxifeno en mujeres posmenopáusicas con osteoporosis: efectos sobre la densidad ósea y las fracturas. Menopause. 2015;22(8):806-813.
12. Archer DF, Freeman EW, Komm BS, et al. Análisis conjunto de los efectos de los estrógenos conjugados/bazedoxifeno sobre los síntomas vasomotores en los ensayos de estrógenos selectivos, menopausia y respuesta a la terapia. J Womens Health (Larchmt). 2016;25(11):1102-1111.
13. FDA. Libro naranja: productos farmacéuticos aprobados con evaluaciones de equivalencia terapéutica. Detalles del producto para ANDA 204726. www.accessdata.fda.gov/scripts/cder/ob/results_product.cfm?Appl_Type=A&Appl_No=204726. Consultado el 18 de marzo de 2018.
14. FDA. Drugs@FDA: Productos farmacéuticos aprobados por la FDA. www.accessdata.fda.gov/scripts/cder/daf/index.cfm. Consultado el 17 de junio de 2018.
15. DrugDex . Greenwood Village, CO: Truven Health Analytics, Inc. www.micromedexsolutions.com. Consultado el 15 de junio de 2018.
16. Constantine G, Graham S, Portman DJ, et al. Función sexual femenina mejorada con ospemifeno en mujeres posmenopáusicas con atrofia vulvar y vaginal: resultados de un ensayo aleatorizado y controlado con placebo. Climacteric. 2015;18(2):226-232.
17. Labrie F, Archer DF, Koltun W, et al. Eficacia de la dehidroepiandrosterona (DHEA) intravaginal sobre la dispareunia y la sequedad vaginal de moderada a grave, los síntomas de la atrofia vulvovaginal y del síndrome genitourinario de la menopausia. Menopause. 2016;23(3):243-256.