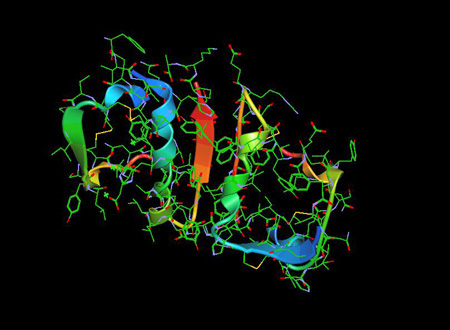
La Molécula de la Insulina 1ZNI PDB es una hormona pancreática que desempeña un papel esencial en la regulación de la glucosa en sangre, así como en el metabolismo de los lípidos y los carbohidratos..
Para la estructura tridimensional de la molécula de insulina utilizando Jsmol haga clic en
Resumen
La insulina es una hormona polipeptídica producida por las células β de los islotes pancreáticos que es la principal responsable de la regulación de la glucosa en sangre y del almacenamiento de carbohidratos y lípidos. La diabetes de tipo 1 se debe a una producción inadecuada de insulina causada por la destrucción y pérdida de las células β de los islotes pancreáticos productoras de insulina. La diabetes de tipo 2 se debe a una resistencia relativa a la insulina. Se considera que es la principal hormona anabólica del organismo. (1)
Estructura de la proteína
Se descubrió que la insulina es un polipéptido en 1928 y su secuencia de aminoácidos se identificó en 1952. De hecho, es un dipéptido, que contiene las cadenas A y B respectivamente, unidas por puentes disulfuro, y que contiene 51 aminoácidos, con un peso molecular de 5802. Su punto isoeléctrico es de pH 5,5.5 La cadena A comprende 21 aminoácidos y la cadena B 30 aminoácidos. La cadena A tiene una hélice N-terminal unida a una hélice C-terminal antiparalela; la cadena B tiene un segmento helicoidal central. Las dos cadenas están unidas por 2 enlaces disulfuro, que unen las hélices N- y C-terminal de la cadena A a la hélice central de la cadena B. En la pro-insulina, un péptido de conexión une el N-terminal de la cadena A con el C-terminal de la cadena B.
En los vertebrados, la secuencia de aminoácidos de la insulina está muy conservada. La insulina bovina difiere de la humana en sólo tres residuos de aminoácidos, y la insulina porcina en uno. Incluso la insulina de algunas especies de peces es lo suficientemente similar a la humana como para ser clínicamente eficaz en los seres humanos. La insulina de algunos invertebrados es bastante similar en su secuencia a la insulina humana, y tiene efectos fisiológicos similares. La fuerte homología observada en la secuencia de la insulina de diversas especies sugiere que se ha conservado a lo largo de gran parte de la historia evolutiva de los animales. El péptido C de la proinsulina, sin embargo, difiere mucho más entre las especies; también es una hormona, pero secundaria.
La insulina se produce y se almacena en el cuerpo como un hexámero (una unidad de seis moléculas de insulina), mientras que la forma activa es el monómero. El hexámero es una forma inactiva con estabilidad a largo plazo, que sirve para mantener la insulina altamente reactiva protegida, pero fácilmente disponible. La conversión hexámero-monómero es uno de los aspectos centrales de las formulaciones de insulina inyectable. El hexámero es mucho más estable que el monómero, lo cual es deseable por razones prácticas; sin embargo, el monómero es un fármaco de reacción mucho más rápida porque la velocidad de difusión está inversamente relacionada con el tamaño de las partículas.
Mecanismos de la secreción de insulina
La insulina se produce en el páncreas y en el cuerpo de Brockmann (en algunos peces), y se libera cuando se detecta alguno de varios estímulos. Estos estímulos incluyen las proteínas ingeridas y la glucosa en la sangre producida por los alimentos digeridos. Los hidratos de carbono pueden ser polímeros de azúcares simples o los propios azúcares simples. Si los hidratos de carbono incluyen glucosa, ésta será absorbida por el torrente sanguíneo y el nivel de glucosa en sangre comenzará a aumentar. En las células diana, la insulina inicia una transducción de señales, que tiene el efecto de aumentar la captación y el almacenamiento de glucosa. Finalmente, la insulina se degrada, terminando la respuesta.
En los mamíferos, la insulina se sintetiza en el páncreas dentro de las células beta. Entre un millón y tres millones de islotes pancreáticos forman la parte endocrina del páncreas, que es principalmente una glándula exocrina. La parte endocrina representa sólo el 2% de la masa total del páncreas. Dentro de los islotes pancreáticos, las células beta constituyen el 65-80% de todas las células.
Liberación de insulina
Regulación de la glucosa en sangre Las células beta de los islotes de Langerhans liberan insulina en dos fases. La primera fase se desencadena rápidamente en respuesta al aumento de los niveles de glucosa en sangre, y dura unos 10 minutos. La segunda fase es una liberación lenta y sostenida de vesículas recién formadas que se desencadena independientemente del azúcar y que alcanza un máximo de 2 a 3 horas. La reducción de la liberación de insulina en la primera fase puede ser el primer defecto detectable de las células beta que predice la aparición de la diabetes de tipo 2. La liberación de primera fase y la sensibilidad a la insulina son predictores independientes de la diabetes.
Niveles de insulina en sangre
El nivel de insulina en sangre puede medirse en unidades internacionales, como µIU/mL o en concentración molar, como pmol/L, donde 1 µIU/mL equivale a 6,945 pmol/L. Un nivel sanguíneo típico entre comidas es de 8-11 μIU/mL (57-79 pmol/L).
Mecanismo de acción – Transducción de señales de la insulina
Transducción de señales Los efectos de la insulina se inician por su unión a un receptor presente en la membrana celular. La molécula del receptor contiene una subunidad α- y otra β. Dos moléculas se unen para formar lo que se conoce como un homodímero. La insulina se une a las subunidades α del homodímero, que está orientado hacia el lado extracelular de las células. Las subunidades β tienen una actividad enzimática de tirosina quinasa que se desencadena por la unión de la insulina. Esta actividad provoca la autofosforilación de las subunidades β y, posteriormente, la fosforilación de proteínas del interior de la célula conocidas como sustratos del receptor de insulina (IRS). La fosforilación del IRS activa una cascada de transducción de señales que conduce a la activación de otras quinasas así como de factores de transcripción que median los efectos intracelulares de la insulina.
Acción de la insulina de efectos fisiológicos
las acciones de la insulina a nivel del metabolismo humano global incluyen: Aumento del consumo celular de ciertas sustancias, de forma más destacada la glucosa en el músculo y el tejido adiposo (aproximadamente dos tercios de las células corporales) Aumento de la replicación del ADN y de la síntesis de proteínas a través del control de la captación de aminoácidos Modificación de la actividad de numerosas enzimas.
Regulador del metabolismo endocannabinoide. La insulina es un importante regulador del metabolismo de los endocannabinoides (CE) y se ha demostrado que el tratamiento con insulina reduce los CE intracelulares, el 2-araquidonilglicerol (2-AG) y la anandamida (AEA), que se corresponden con cambios de expresión sensibles a la insulina en las enzimas del metabolismo de los CE. En los adipocitos resistentes a la insulina, los patrones de expresión de las enzimas inducidas por la insulina se ven alterados de forma consistente con una elevada síntesis de CE y una reducida degradación de los mismos. Los hallazgos sugieren que los adipocitos resistentes a la insulina no regulan el metabolismo de las CE y disminuyen los niveles intracelulares de CE en respuesta a la estimulación de la insulina, por lo que los individuos obesos resistentes a la insulina presentan mayores concentraciones de CE. Esta desregulación contribuye a la acumulación excesiva de grasa visceral y a la reducción de la liberación de adiponectina del tejido adiposo abdominal, y además a la aparición de varios factores de riesgo cardiometabólico que se asocian con la obesidad y la diabetes de tipo 2.
1- Voet D, Voet JG (2011). Bioquímica (4ª ed.). Nueva York: Wiley.
2-Gisela Wilcox (2005) Insulin and Insulin Resistance, Clin Biochem Rev. 2005 May; 26(2): 19-39.
3- Rhoades RA, Bell DR (2009). Fisiología médica : principios para la medicina clínica (3ª ed.). Philadelphia: Lippincott Williams & Wilkins. pp. 644-47.
4-Gerich JE (febrero de 2002). «¿Es la reducción de la liberación de insulina en la primera fase la anormalidad más temprana detectable en los individuos destinados a desarrollar diabetes tipo 2?». Diabetes. 51 (Suppl 1): S117–21. doi:10.2337/diabetes.51.2007.s117. PMID 11815469.
5- Lorenzo C, Wagenknecht LE, Rewers MJ, Karter AJ, Bergman RN, Hanley AJ, Haffner SM (septiembre de 2010). «Índice de disposición, eficacia de la glucosa, y la conversión a la diabetes tipo 2: el Estudio de Aterosclerosis de Resistencia a la Insulina (IRAS)». Diabetes
6- Un diccionario de unidades de medida Archivado 2013-10-28 en la Wayback Machine. Por Russ Rowlett, de la Universidad de Carolina del Norte en Chapel Hill. 13 de junio de 2001
7- Iwase H, Kobayashi M, Nakajima M, Takatori T (enero de 2001). «La relación entre la insulina y el péptido C puede utilizarse para realizar un diagnóstico forense de sobredosis de insulina exógena». Forensic Science International. 115 (1-2): 123-27. doi:10.1016/S0379-0738(00)00298-X. PMID 11056282.
8- Xiang Z (junio de 2006). «Avances en el modelado de estructuras proteicas por homología». Actual proteína & Ciencia de péptidos. 7 (3): 217-27. doi:10.2174/138920306777452312. PMC 1839925. PMID 16787261.
9- Zagrovic B, Snow CD, Shirts MR, Pande VS (noviembre de 2002). «Simulación de plegado de una pequeña proteína alfa-hélica en detalle atomístico usando computación distribuida mundialmente». Journal of Molecular Biology. 323 (5): 927-37.
10-D’Eon TM, Pierce KA, Roix JJ, Tyler A, Chen H, Teixeira SR (mayo de 2008). «El papel de la resistencia a la insulina de los adipocitos en la patogénesis de las elevaciones de endocannabinoides relacionadas con la obesidad». Diabetes. 57 (5): 1262-68.
11- Di Marzo V (agosto de 2008). «El sistema endocannabinoide en la obesidad y la diabetes tipo 2». Diabetologia. 51 (8): 1356-67. doi:10.1007/s00125-008-1048-2. PMID 18563385.