Esto es lo que pasa con la cobertura de las «aminas» en Org 2: no hay narración.
A diferencia de la mayoría de los capítulos, no comienza con un conjunto de conceptos y luego construye una serie de ejemplos a los que se pueden aplicar esos conceptos.
No. Un capítulo típico sobre aminas en un libro de texto introductorio es esencialmente sólo una mezcolanza de temas aparentemente al azar lanzados juntos que no encajan en ningún otro lugar. El único hilo conductor es que contienen nitrógeno de alguna manera.
Por ejemplo: el post de hoy sobre aminas al azar trata de los reordenamientos de Hofmann y Curtius.
¿Qué motiva esto? No hay una buena respuesta. La mayoría de los cursos los cubren en algún momento, y tienen que encajar en alguna parte. Así que, qué demonios. ¿Por qué no ahora?
Tabla de contenidos
- Los reordenamientos de Hofmann y Curtius
- El mecanismo de los reordenamientos de Hofmann y Curtius, primera parte – Preparación del reordenamiento
- Segunda parte: El paso clave del reordenamiento de Hofmann y Curtius
- Tercera parte: Formación del isocianato
- Poniendo los pasos juntos
- El destino del isocianato: Formación de carbamatos, aminas y ureas
- Resumen: Los reordenamientos de Hofmann y Curtius
- Notas
- (Avanzado) Referencias y lecturas adicionales
- Los reordenamientos de Hofmann y Curtius
- El mecanismo de los reordenamientos de Hofmann y Curtius, Parte 1: Establecimiento del reordenamiento
- Parte 1: Preludio
- 3. El paso de reordenación clave en el Hofmann y el Curtius
- Formación del isocianato
- Juntando los pasos
- El destino del isocianato
- Resumen: Los reordenamientos de Hofmann y Curtius
- Notas
- (Avanzado) Referencias y lecturas adicionales
Los reordenamientos de Hofmann y Curtius
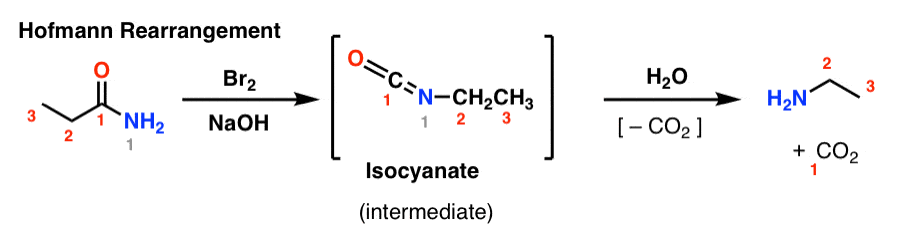
Los reordenamientos de Hofmann y Curtius son dos ejemplos de toda una familia de reacciones de reordenamiento que comparten un paso mecanístico común.
En el reordenamiento de Hofmann, una amida se trata con bromo y base (normalmente NaOH o KOH). Al calentar, se forma un isocianato intermedio, que no se aísla. En presencia de agua, el isocianato pierde dióxido de carbono («descarboxila») para dar una amina.
El enlace clave que se forma en el Hofmann es el enlace C2-N. Nótese cómo el grupo carbonilo (C1) se pierde, formando dióxido de carbono (CO2). (nota: esta no es la numeración de la IUPAC, sólo la numeración para facilitar la discusión)
En el reordenamiento de Curtius, se calienta una acil azida, y se forma un isocianato. En el Curtius, el isocianato puede aislarse, pero normalmente se transforma en otras especies como un carbamato, una urea, o (a través de la descarboxilación, como en el Hofmann) en una amina (más adelante).
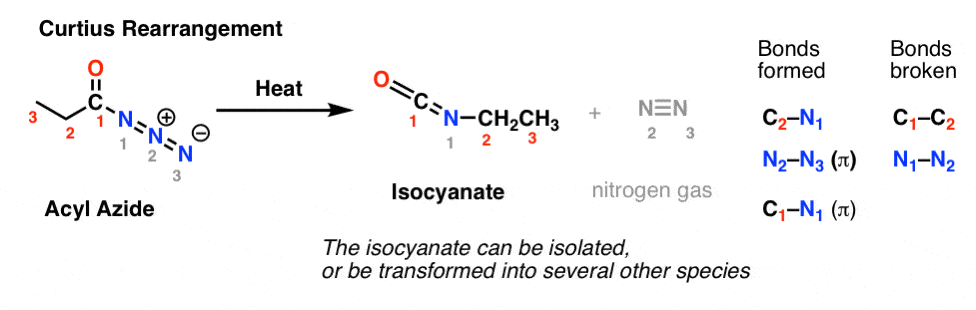
La observación clave a tener en cuenta en ambos casos es que el enlace C1-C2 se ha roto, y se ha formado un nuevo enlace C2-N.
La pregunta es ¿CÓMO?
El mecanismo de los reordenamientos de Hofmann y Curtius, Parte 1: Establecimiento del reordenamiento
Hay cuatro partes importantes en el mecanismo de los reordenamientos de Curtius y Hofmann, y vamos a recorrerlas todas.
- Preludio (sencillo)
- El paso clave de la migración (¡difícil, pero menos difícil si te das cuenta de que has visto una variante del mismo en Org 1!)
- Formación del isocianato (sencillo)
4. Epílogo: Transformaciones del isocianato
Parte 1: Preludio
- El reordenamiento de Hofmann se produce con una amida.
- El reordenamiento de Curtius se produce con una azida de acilo.
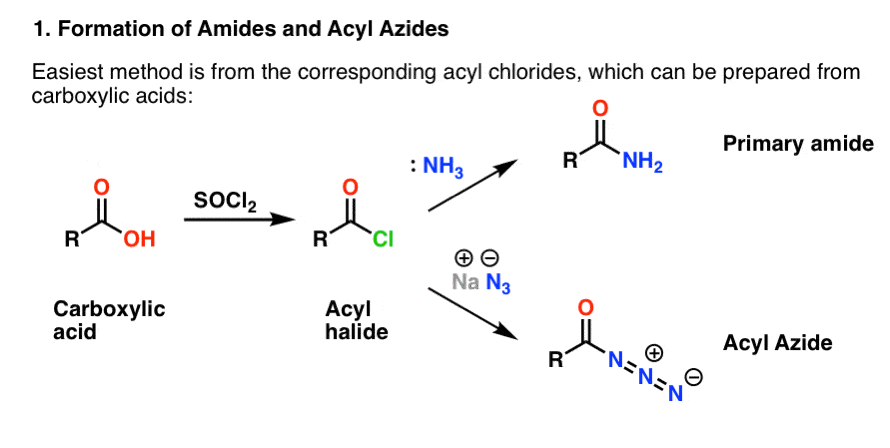
Ambos se preparan convenientemente a partir de haluros de acilo mediante una reacción de adición-eliminación. Si usted está cubriendo las aminas ahora, entonces las reacciones de carbonilo son probablemente territorio familiar. Los haluros de acilo pueden prepararse a partir de ácidos carboxílicos mediante el uso de un reactivo como el cloruro de tionilo (SOCl2) o el pentacloruro de fósforo (PCl5).
Preparación del Hofmann
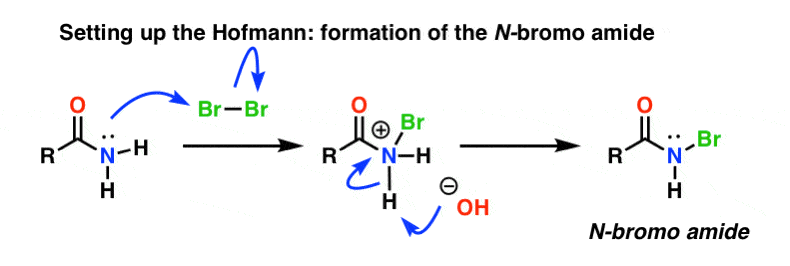
En el reordenamiento de Hofmann, la amida se trata con bromo (Br2) y una base como el NaOH. Esto da lugar a la ruptura del N-H y a la formación de N-Br, lo que resulta en la instalación de un buen grupo saliente en el nitrógeno. A esto lo llamamos una «N-bromo amida».
La Curtius no necesita «instalación», ya que la acil azida ya tiene un espléndido grupo saliente incorporado: N2. Por ello, las azidas orgánicas deben tratarse con cuidado, ya que un tratamiento brusco puede provocar explosiones.
3. El paso de reordenación clave en el Hofmann y el Curtius
Ahora vamos al grano.
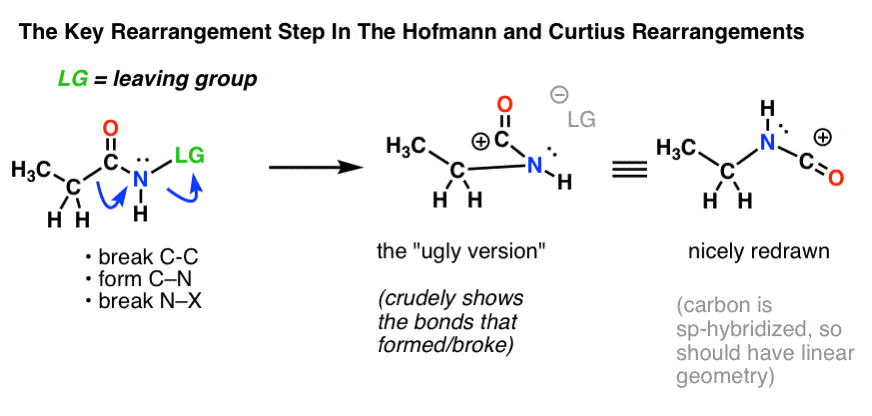
El paso clave en los reordenamientos de Hofmann y Curtius es la migración de un átomo de carbono para desplazar un grupo saliente en un nitrógeno adyacente.
Esto requiere dibujar dos flechas curvas, que se muestran en la estructura del extremo izquierdo (abajo).
- En la primera flecha curva se rompe el enlace C-C y se forma un nuevo enlace C-N.
- En la segunda flecha curva se rompe el enlace N-LG (grupo saliente).
Sin embargo, no siempre es fácil pasar directamente de la estructura del extremo izquierdo a la estructura del extremo derecho (¡que está dibujada de forma bonita y ordenada! ).
¡Cada año se pierden inútilmente puntos en los exámenes por estudiantes que aciertan las flechas curvas pero acaban dibujando la estructura equivocada! Por eso animo a los estudiantes a dibujar primero una «versión fea», que parece una mierda pero que al menos tiene todos los enlaces en el lugar correcto. Siempre hay tiempo para volver a dibujarla y hacerla bonita más tarde.
Al principio este reordenamiento probablemente parezca… extraño. ¡Pero en realidad es una reacción que ya has visto antes! (pero en forma disfrazada).
¿Alguien recuerda el mecanismo del paso de «oxidación» en la hidroboración-oxidación?
¡Es básicamente lo mismo!
Aquí tienes un repaso:
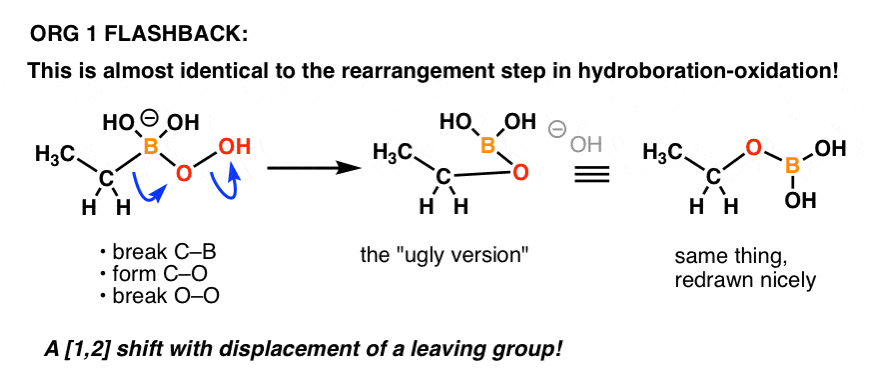
¡Sólo otro ejemplo de cómo las cosas que aprendes en una parte anterior de la química orgánica pueden volver en una parte posterior del curso!
Visitemos el paso de reordenamiento específico en los reordenamientos de Hofmann y Curtius con ejemplos concretos.
Aquí está el paso clave en el Hofmann, donde el calentamiento resulta en la ruptura de C-C , la formación de C-N, y la ruptura de N-Br.
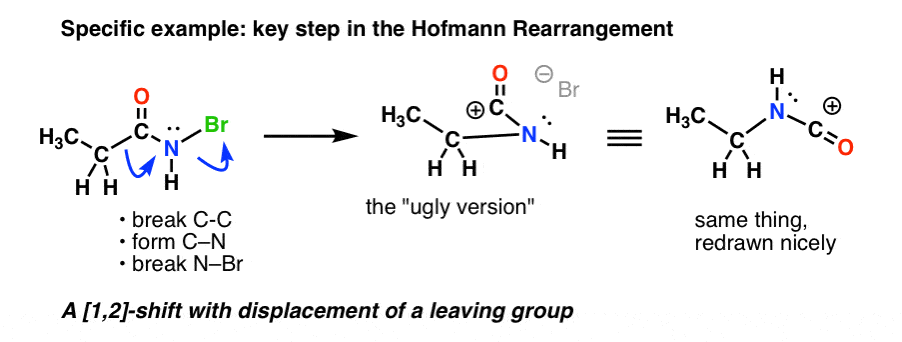
Si sigues todas las flechas, deberías acabar con un carbocatión de aspecto extraño (arriba a la derecha) del que nos ocuparemos en un minuto.
En el Curtius, el calentamiento de la acil azida da lugar a un reordenamiento. El grupo saliente es nitrógeno gaseoso (N2).
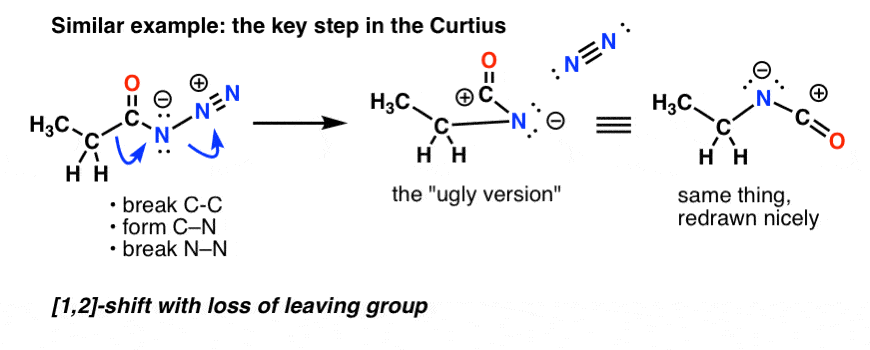
(Una sutil diferencia entre el Curtius y el Hofmann es que no hay hidrógeno unido al N en el Curtius, por lo que acabamos con una carga negativa en el nitrógeno de la especie reordenada.)
Formación del isocianato
El siguiente paso es pasar de nuestra especie reordenada al isocianato. Para cualquiera que esté acostumbrado a dibujar formas de resonancia, esto no debería ser demasiado difícil.
(Como discutiremos más adelante, los estudios han determinado que la formación del isocianato ocurre al mismo tiempo que la migración. Pero para nuestros fines didácticos, creo que es útil tratar este paso de forma aislada. Podemos ponerlo todo junto en un minuto).
Como se puede recordar de waayyyy atrás en Org 1, una forma de resonancia con octetos completos es superior a uno sin (revisión rápida). Nuestro producto de aspecto extraño del reordenamiento tiene un carbocation adyacente a un nitrógeno que contiene un par solitario. Así que el primer paso es dibujar la formación de un nuevo enlace C-N pi. Esto es esencialmente sólo una forma de resonancia.
El reordenamiento de Hofmann ocurre en presencia de base. Así que después de dibujar la forma de resonancia, el siguiente paso es la desprotonación del enlace N-H dando el isocianato neutro.
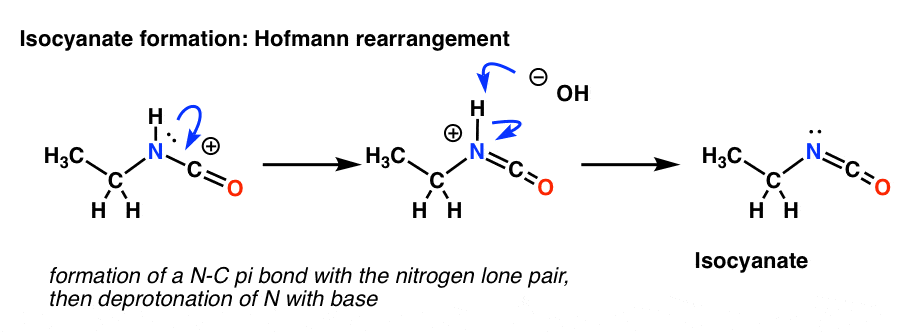
No hay hidrógeno en el nitrógeno en el Curtius. Así que la formación del isocianato se consigue simplemente por la donación de un par solitario del nitrógeno al carbocatión. Se puede ver simplemente como si se dibujara una forma de resonancia.
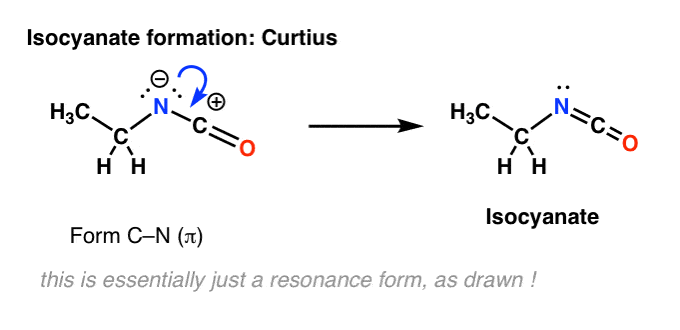
Juntando los pasos
Los estudios sobre el mecanismo de los reordenamientos de Hofmann y Curtius han determinado que estos dos pasos no ocurren secuencialmente; ¡en realidad ocurren al mismo tiempo! (¿cómo sabemos esto? ver Nota 1 )
Es decir, la migración ocurre al mismo tiempo que la formación de isocianato.
Necesitamos volver a dibujar los mecanismos de Hofmann y Curtius para reflejar eso, incorporando ambos pasos.
Aquí está el de Hofmann (nótese que el evento de desprotonación está realmente separado).
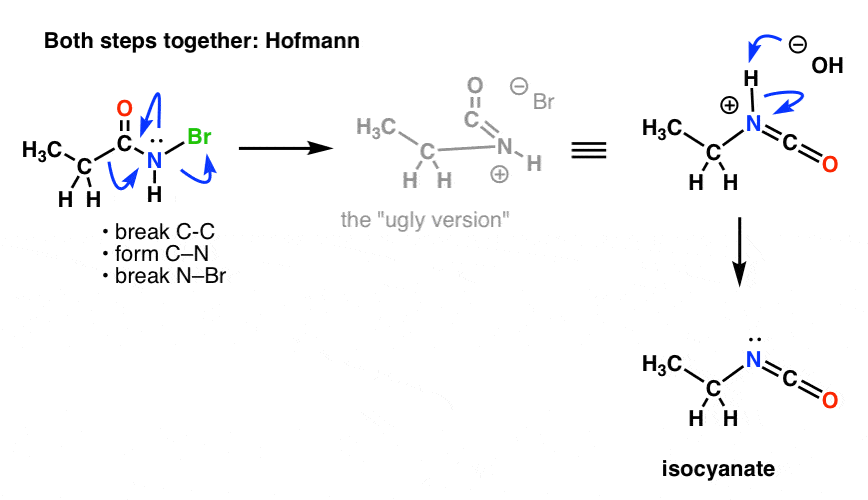
Y el Curtius:
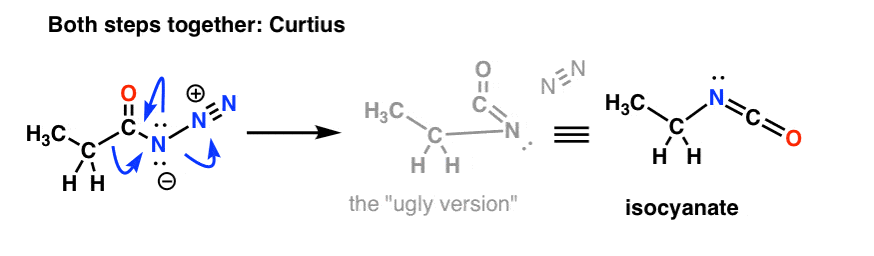
El destino del isocianato
Tanto el Hofmann como el Curtius dan lugar a un isocianato. Es probable que no se haya encontrado antes con los isocianatos. A primera vista, son especies de aspecto bastante extraño, pero su química no es tan diferente de la de otras especies carbonílicas como los ésteres, las amidas y los haluros de acilo.
La estructura del isocianato se parece mucho a la del dióxido de carbono, CO2. El carbono está unido por pi a dos átomos fuertemente electronegativos. Esto hace que el carbono sea un excelente electrófilo.
Al añadir varios nucleófilos, los isocianatos pueden transformarse en otras especies útiles.
– Al añadir un alcohol se forma un carbamato
– Al añadir una amina se obtiene una urea
– Al añadir agua se obtiene un ácido carbámico, que es inestable. Los ácidos carbámicos pierden rápidamente dióxido de carbono para dar una amina.
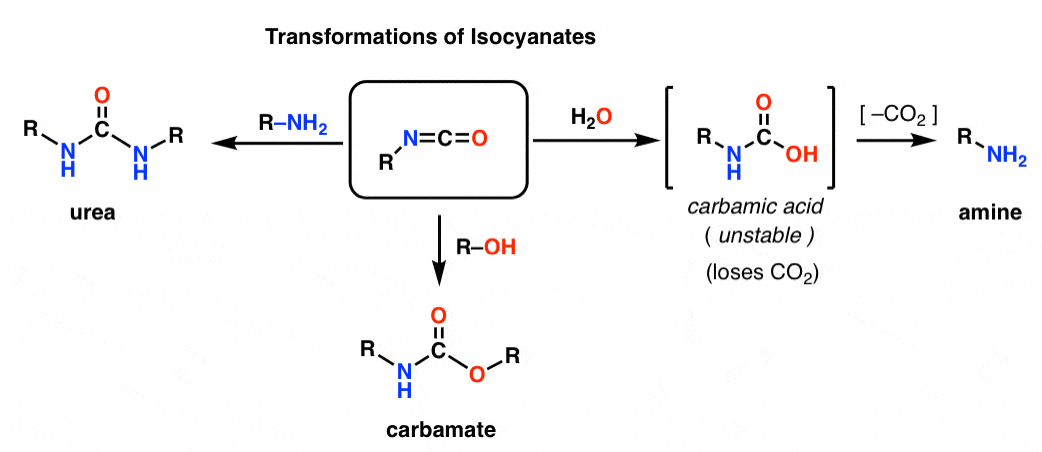
En particular, la vía de descarboxilación presenta una forma ingeniosa de hacer aminas. Hemos aprendido toneladas de formas de hacer ácidos carboxílicos, pero no demasiadas formas de hacer aminas (además de la sustitución nucleofílica y la aminación reductora). El Hofmann es un buen truco para tener en el bolsillo en situaciones en las que ninguna de esas situaciones podría aplicarse – como hacer anilinas sustituidas, por ejemplo.
¿Mecanismos? De acuerdo, bien. Ver tema extra 1.
Resumen: Los reordenamientos de Hofmann y Curtius
El mecanismo de estos reordenamientos es complicado a primera vista, pero se hace considerablemente más fácil una vez que te das cuenta de que has visto una variante de la reacción de migración antes (i.e. en la hidroboración-oxidación).
Recomiendo encarecidamente dibujar primero la versión fea, porque te ayudará a concentrarte en ver los enlaces que se forman y rompen, antes de intentar redibujarla en una estructura más atractiva estéticamente. Esto también es válido para los reordenamientos de Beckmann y Wolff, que tienen un paso similar.(ver abajo)
Notas
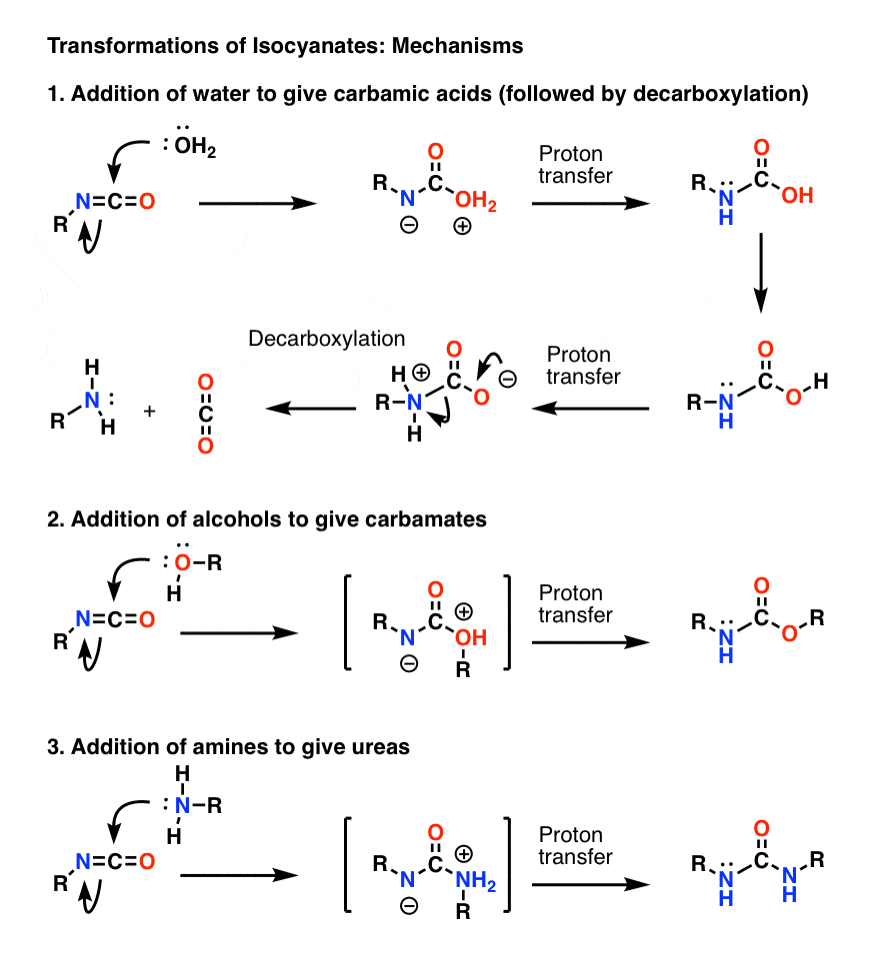
Tema de Bonificación 1: Isocianatos
El mecanismo más importante de los isocianatos es la adición electrófila (es decir, la adición de un nucleófilo al carbono central, electrófilo). En el mecanismo de abajo mostré el nucleófilo añadiendo al carbono para formar un anión en el nitrógeno, aunque es probable que esta no sea la mejor forma de resonancia (el oxígeno es mejor para estabilizar la carga negativa que el nitrógeno). La transferencia de protones del oxígeno al nitrógeno da lugar a una especie neutra. (Utilicé la Varita Mágica de Transferencia de Protones aquí, porque es más rápido).
Nótese que el paso de descarboxilación en 1) no necesita ser precedido por la deportación del oxígeno, aunque definitivamente necesita ocurrir de tal manera que el nitrógeno sea protonado durante el paso (no se quiere formar un ion amida fuertemente básico, por ejemplo).
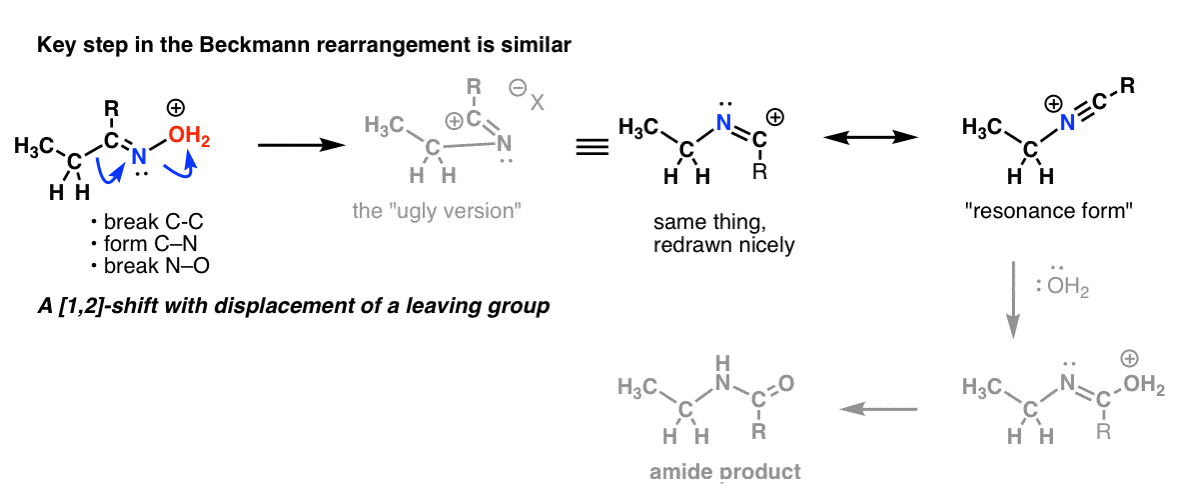
Tema de bonificación 2: Los reordenamientos de Beckmann, Wolff y otros comparten un paso similar
¡Pero espera, hay más!
Hay un desplazamiento 1,2 con pérdida de un grupo saliente en el reordenamiento de Beckmann. El paso clave es esencialmente el mismo que vimos en el de Hofmann y Curtius.
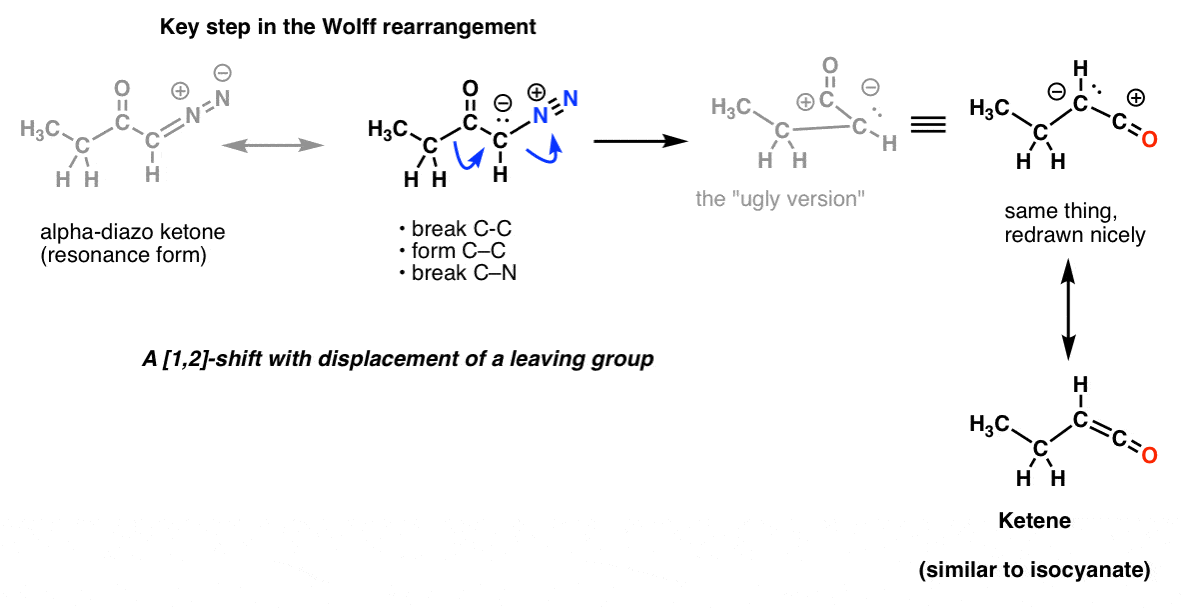
Y en el reordenamiento de Wolff, que también se cubre comúnmente, también podrías reconocer el mismo paso clave.
¡Y eso no es todo! Hay una reacción llamada el reordenamiento de Schmidt, que es como la de Curtius, pero proviene de la adición de HN3 a un cloruro de acilo (o ácido carboxílico). Y hay otra llamada reordenación de Lossen que se produce con los ácidos hidroxílicos. No hay premios por adivinar el paso clave de estos dos procesos. Y ni siquiera hemos mencionado el Baeyer-Villiger, que no involucra nitrógeno, pero es más o menos el mismo tipo de proceso.
Cuando aprendí el paso de hidroboración-oxidación en Org 1, hace muchas lunas, ciertamente nunca esperé que vería el mismo patrón de reacción repetirse en tantas formas diferentes.
La conclusión es que hay un montón de reacciones que tienen diferentes nombres que proceden a través del mismo proceso mecánico. Esto pone de manifiesto la importancia de aprender los patrones clave de la química orgánica, porque seguro que se repiten mucho.
Nota final. ¿Concertado, no separado?
Si el Curtius fuera escalonado, la pérdida de nitrógeno llevaría a un nitreno. Los nitrenos sufren una serie de reacciones interesantes, como la inserción en enlaces C-H (¡!). Así que se puede diseñar un experimento para probar esto: si se intenta el siguiente reordenamiento de Curtius, se podría buscar evidencia de la formación de un anillo de cinco miembros.
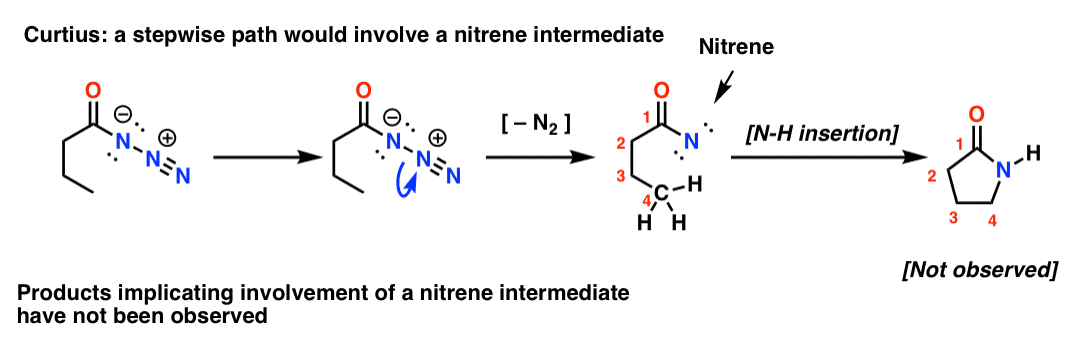
La ausencia de tales productos, junto con otras evidencias, apunta a un mecanismo concertado.
(Avanzado) Referencias y lecturas adicionales
- Ueber die Einwirkung des Broms in alkalischer Lösung auf Amide
W. Hofmann
Chem. Ber. 1881, 14, 2725-2736
DOI: 10.1002/cber.188101402242
Trabajo original de A. W. Hofmann (que fue un químico muy productivo y tiene su nombre atribuido a muchas otras transformaciones) sobre la degradación de amidas a aminas primarias. - Un reordenamiento de Hofmann modificado suave y eficiente
Xicai Huang, Mehran Seid, y Jeffrey W. Keillor
The Journal of Organic Chemistry 1997, 62 (21), 7495-7496
DOI:10.1021/jo9708553
Se trata de un reordenamiento de Hofmann modificado llevado a cabo en metanol – en este caso, el ácido carbámico intermedio puede reaccionar con el disolvente metanol para producir carbamatos de metilo en buen rendimiento. - FORMACIÓN DE CARBAMATOS DE METILO MEDIANTE REACCIONES DE REORDENAMIENTO DE HOFMANN MODIFICADAS: CARBAMATO DE METILO N-(p-METOXIFENILO)
Jeffrey W. Keillor y Xicai Huang
Org. Synth. 2002, 78, 234
DOI: 10.15227/orgsyn.078.0234
Un procedimiento fiable y probado de forma independiente para el reordenamiento de Hofmann modificado en la Ref #2. - La reacción de Hofmann
Wallis, Everett L.; Lane, John F.
Org. React. 1946, 3, 267-306
DOI: 10.1002/0471264180.or003.07
Una revisión antigua pero completa (para su época) sobre la reacción de Hofmann (la reacción de amida a amina, que no debe confundirse con sus otras reacciones). - Notas – Un reexamen de las limitaciones de la reacción de Hofmann
Ernest Magnien y Richard Baltzly
The Journal of Organic Chemistry 1958, 23 (12), 2029-2032
DOI:10.1021/jo01106a630
Se trata de un interesante trabajo en el que los autores han intentado ampliar el alcance del reordenamiento de Hofmann más allá de lo descrito en el trabajo original, ajustando cuidadosamente las condiciones de reacción. - 20. Hydrazide und Azide organischer Säuren
Curtius, T. I. Abhandlung.
Journal Für Praktische Chemie, 50(1), 275-294. (1894).
DOI:1002/prac.18940500125 - Ueber Stickstoffwasserstoffsäure (Azoimid) N3H.
Curtius, T.
Berichte Der Deutschen Chemischen Gesellschaft, 23(2), 3023-3033.(1890).
DOI:1002/cber.189002302232
Primeros trabajos de Theodore Curtius en los que se describe la reactividad de las hirazidas de acilo y las azidas de acilo. - La reacción de Curtius
Smith, P. A. S.
Org. React. 1946, 3, 336
DOI: 10.1002/0471264180.or003.09
Una revisión antigua pero completa de la reacción de Curtius, que incluye la historia del descubrimiento de este reordenamiento, el alcance del sustrato, las limitaciones, la comparación con otras reacciones similares y los procedimientos experimentales. - ISOCIANATO DE UNDECILO
F. H. Allen y Alan Bell
Org. Synth. 1944, 24, 94
DOI: 10.15227/orgsyn.024.0094
Un procedimiento antiguo pero reproducible y probado para sintetizar isocianatos mediante el reordenamiento de Curtius. - Una síntesis total expeditiva sin grupo protector de (±)-Dievodiamina
William P. Unsworth, Christiana Kitsiou y Richard J. K. Taylor
Organic Letters 2013 15 (13), 3302-3305
DOI:1021/ol4013469
El primer paso de esta síntesis total utiliza un reordenamiento de Curtius para efectuar una ciclización intramolecular del ácido carboxílico sustituido por indol. - Métodos y reacciones sintéticas. 121. Preparación catalizada por yoduro de zinc de aroil azidas a partir de cloruros de aroilo y trimetilsilil azida
K. Surya Prakash, Pradeep S. Iyer, Massoud Arvanaghi, and George A. Olah
The Journal of Organic Chemistry 1983 48 (19), 3358-3359
DOI: 10.1021/jo00167a051
Un procedimiento conveniente para la preparación de azidas de arilo aromáticas del Premio Nobel Prof. George A. Olah. Éstas pueden utilizarse para los reordenamientos de Curtius.