En esta serie, Colin Baker de la Escuela de Bedford proporciona demostraciones espectaculares, diseñadas para capturar la imaginación del estudiante. Las demostraciones son fáciles de preparar, seguras y funcionan.
Nada tiende a imprimir los hechos químicos en la mente tanto como la exhibición de experimentos interesantes – Samuel Parkes, 1816
En septiembre de 1931, el químico estadounidense Wallace Carothers, que trabajaba en los laboratorios de DuPont, informó de una investigación sobre moléculas «gigantes» llamadas polímeros basada en la comprensión de la estructura química de la lana. Su trabajo se centró en una fibra denominada simplemente «66», número derivado de su estructura molecular. En 1935 nació el nailon, la «fibra milagrosa», que tuvo un gran éxito en su mercado inicial, las medias femeninas. Cuando Estados Unidos entró en la Segunda Guerra Mundial, en diciembre de 1941, el Consejo de Producción de Guerra destinó toda la producción de nailon a usos militares, incluidos los paracaídas y los neumáticos de los bombarderos B29.

Fuente: Colin Baker
La reacción entre el dicloruro de decanedioilo y el 1,6-diaminohexano
Un cloruro de diácido en un disolvente orgánico forma una capa inmiscible con una diamina alifática en agua. En la interfase, donde las dos soluciones incoloras se encuentran, se forma un polímero blanco de cadena larga. Esta película de polímero puede arrancarse de la interfaz y se sustituye inmediatamente al retirarla. Si se deja de tirar, parece que no ocurre nada: la reacción se detiene, pero se reanuda inmediatamente cuando se empieza a tirar de nuevo. La reacción puede ocurrir durante varias horas.

Fuente: Colin Baker
Kit
- Ciclohexano, 100cm3 (irritante, altamente inflamable);
- Decanedioil dicloruro, 5.0cm3;
- Agua destilada, 100cm3;
- Carbonato de sodio anhidro, 10g;
- 1,6-diaminohexano, 5,0g;
- Dos vasos de precipitados, 250cm3;
- Vaso de precipitados, 5cm3;
- Pinzas;
- Barras de vidrio.
Seguridad
El dicloruro de decano y el 1,6-diaminohexano son corrosivos. Son nocivos si se ingieren o inhalan, y en contacto con la piel provocan quemaduras. Son irritantes graves. El ciclohexano es altamente inflamable e irritante.
Procedimiento
Preparar las dos soluciones siguientes:
Solución A: dicloruro de decanedioilo en ciclohexano. Poner 100cm3 de ciclohexano en un vaso de precipitados de 250cm3, añadir 5,0cm3 de dicloruro de decanedioilo y agitar para que se disuelva. Esta solución se conserva durante unas cuatro semanas.
Solución B: 1,6-diaminohexano en carbonato sódico acuoso. Poner 100cm3 de agua destilada en un vaso de precipitados de 250cm3, añadir 10g de carbonato sódico anhidro y agitar para que se disuelva. Añadir 5,0g de 1,6-diaminohexano sólido y agitar para disolver.
Verter 2cm3 de solución A en un vaso de precipitados de 5cm3. Añadir con cuidado un volumen igual de solución B. La solución A contiene el disolvente orgánico, es más densa que la capa acuosa y, por tanto, es la capa inferior. Coge la película de poliamida (un sólido blanco) que empieza a formarse en la interfaz de estas dos soluciones con unas pinzas y sácala lentamente del vaso de precipitados. Enrolla la fibra alrededor de una varilla de vidrio y sigue tirando. Detén el proceso cuando se agote uno de los reactivos.
Consejos especiales
Hay que tener cuidado al añadir la segunda solución para evitar que se mezcle. Demuestra cómo se puede sacar la fibra en un hilo continuo y luego organiza una competición para ver qué pareja de estudiantes puede producir la fibra más larga. Deberían ser capaces de producir hasta 5 m antes de que la fibra se rompa. Rápidamente se darán cuenta de que necesitan ayuda para sostener la fibra: divido la clase en dos grandes grupos, cada uno de ellos armado con varillas de vidrio. Mis alumnos han producido fibras de más de 30 m, incluso han intentado doblar las esquinas. Hay que limitar el volumen máximo de cada solución a 10 cm3. Los alumnos deben llevar guantes y evitar el contacto con la fibra. Si la fibra se rompe, hay que envolverla en papel absorbente. Cualquier derrame debe limpiarse con papel absorbente y depositarse en la basura.
Objetivos didácticos
Las poliamidas son polímeros en los que las unidades repetitivas se mantienen unidas por enlaces amida, -CO-NH-.
El nylon-6,10
El nylon-6,10 está hecho de dos monómeros, uno contiene seis átomos de carbono, el otro 10 – de ahí su nombre. El monómero de 10 carbonos es dicloruro de decanedioilo (ClOC(CH2)8 COCl), un cloruro ácido con un grupo -COCl en cada extremo. El otro monómero es una cadena de seis carbonos con un grupo amino, -NH2, en cada extremo. Se trata del 1,6-diaminohexano (H2 N(CH2)6 NH2, también conocido como hexano-1,6-diamina).
Cuando estos dos compuestos se polimerizan, los grupos amina y ácido se combinan, cada vez con la pérdida de una molécula de cloruro de hidrógeno:
n ClOC-(CH2)8-COCl + n H2N-(CH2)6-NH2 → -(CO-(CH2)8-CONH-(CH2)6-NH)n – + n HCl
Este proceso de formación de polímeros que implica la pérdida de una pequeña molécula se conoce como polimerización por condensación.
Nilón-6,6
Este polímero se fabrica por condensación de dos moléculas de seis carbonos, el ácido hexanedioico y el 1,6-diaminohexano. En la industria, el ciclohexano se utiliza para fabricar ambos monómeros. Si el ciclohexano se oxida, el anillo se abre y ambos extremos de la cadena tienen un grupo ácido: se forma el ácido hexanedioico. Si este ácido se neutraliza con amoníaco, se produce la sal de diamonio (NH4 OOCCH2 CH2 CH2 COONH4) que puede deshidratarse (calentando a 350°C) y reducirse (utilizando H2/Ni) a 1,6-diaminohexano. La polimerización por condensación del diácido y la diamina se produce con la pérdida de agua:
n HOOC-(CH2)4 -COOH + n H2 N-(CH2)6 -NH2 → -(CO-(CH2)4 -CONH-(CH2)6 -NH)n – + n H2 O
Nilón-6
Es posible hacer nilón a partir del monómero único caprolactama (hexahidro-2H-azepina-2-ona, 1).
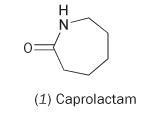
La caprolactama contiene un enlace amídico interno. La polimerización de esta molécula da lugar a la apertura del anillo y su unión para formar una cadena continua:
-(NH-(CH2)5 -CONH-(CH2)5 -CONH-(CH2)5 -CO)n –
El nailon revolucionó la industria textil y fue el precursor de muchas de las fibras sintéticas actuales. Sigue siendo un material importante y ampliamente utilizado en la fabricación.