Descripción general
Una gran fracción de microorganismos no sólo reside en nuestro interior, sino que también vive sobre nosotros. De hecho, la piel humana alberga una mezcla heterogénea de bacterias, hongos y virus, en su mayoría no patógenos, que probablemente contribuyen a la salud de la superficie cutánea (Figura 1). El Propionibacterium acnes (P. acnes) es un anaerobio Gram positivo ubicuo, de crecimiento lento, con forma de bastón y que no forma esporas (Figura 2) que se encuentra en todas las zonas del cuerpo, incluidos los folículos sebáceos de la cara y el cuello (Funke et al., 1997; Grice y Segre, 2011; Findley y Grice, 2014). A menudo se considera parte de nuestra microbiota comensal en sitios de barrera (Cogen et al., 2008) que se establece a través de mecanismos de tolerancia inmune adaptativa durante el período neonatal temprano (Scharschmidt et al., 2015). Aunque la distribución topográfica del anaerobio en los sitios sebáceos es significativa, la distribución espacial y personal de P. acnes es más específica del individuo que del sitio (Oh et al., 2014). Además, la biogeografía y la individualidad de P. acnes es muy dinámica, ya que los cambios en la salud o los cambios en el pH, la temperatura, la humedad y/o el contenido de sebo también pueden afectar a la gama de nichos ocupados por el microorganismo (Grice et al., 2009). Al igual que la distribución de los microbios cutáneos, las condiciones de la piel también pueden determinar la función de P. acnes en cuanto a la expansión del patógeno en la enfermedad. Por ejemplo, P. acnes se ha relacionado con afecciones cutáneas como el acné vulgar en la cara y el cuello, y la hipermelanosis macular progresiva en la espalda (Bojar y Holland, 2004; Kurokawa et al., 2009; Barnard et al., 2016). Además, ciertos filotipos de P. acnes asociados a enfermedades tienen la capacidad de persistir en implantes corporales y dispositivos quirúrgicos causando una amplia gama de condiciones infecciosas postoperatorias, como endocarditis, endoftalmitis e infecciones del sistema nervioso intravascular (Perry y Lambert, 2011; Portillo et al., 2013). Las características adversas de P. acnes también se extienden a la glándula prostática, donde se ha observado con frecuencia la invasión de tejidos y el depósito intracelular de la bacteria en las células epiteliales glandulares y los macrófagos circulantes; un fenómeno que se cree que contribuye indirectamente a la hiperplasia benigna de próstata (HBP) y al cáncer de próstata (Tanabe et al., 2006; Alexeyev et al., 2007; Fassi-Fehri et al., 2011; Mak et al., 2012; Bae et al., 2014; Davidsson et al., 2016). Sin embargo, no está claro cuáles son los mecanismos subyacentes utilizados por P. acnes para inducir la infección, la inflamación y/o la metástasis fuera de la piel. Lo que sí se sabe con cierta certeza es que los queratinocitos, sebocitos y/o adipocitos infectados por bacterias secretan varias quimiocinas y citocinas proinflamatorias, así como factores antimicrobianos (p. ej, la catelicidina) que insinúan mecanismos específicos de la enfermedad (Graham et al., 2004; Nagy et al., 2006; Lee et al., 2010; Zhou et al., 2015; Sanford et al., 2016; Yu et al., 2016).
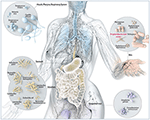
Figura 1. Ilustración esquemática de los microbios comunes que se encuentran en los sitios de barrera en los seres humanos, incluido P. acnes. Aunque P. acnes está presente en todas las superficies externas e internas (es decir, en los epitelios oral y gastrointestinal y en la conjuntiva), es más frecuente en la piel humana. Allí reside en los folículos pilosos de la cara y la espalda, donde se asocia con la enfermedad cutánea común del acné vulgar. Para la mayoría, P acnes sigue considerándose un microorganismo mayoritariamente benigno y comensal; sin embargo, cada vez hay más informes sobre su faceta oportunista maliciosa. Adaptado y con amable permiso de Bryan Christie Design (http://bryanchristiedesign.com/).
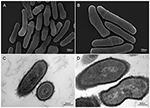
Figura 2. Imágenes de microscopía electrónica de barrido y transmisión (SEM y TEM) de la cepa KPA de P. acnes (A, B = SEM; C, D = TEM). Los recientes avances en las técnicas de aislamiento y cultivo están revelando que las infecciones por P. acnes se han infravalorado enormemente, arrojando una nueva luz sobre esta especie bacteriana oportunista. Microscopía de Volker Brinkmann, Instituto Max Planck de Biología de la Infección, Berlín, Alemania. Barra de escala = 200/300nm.
Sarcoidosis
La sarcoidosis es una enfermedad de etiología desconocida que provoca la inflamación de órganos tan diversos como los pulmones, el hígado, la piel y los linfáticos. Se propuso por primera vez una supuesta relación de la sarcoidosis con P. acnes cuando se aisló la bacteria de lesiones sarcoides de la piel y los ganglios linfáticos (Eishi et al., 2002; Yamada et al., 2002). Estos hallazgos han sido corroborados de forma significativa (de Brouwer et al., 2015), y ampliados por varios experimentos in vitro que demuestran la capacidad de invasión de P. acnes en las líneas celulares HEK293T (riñón embrionario humano) y A549 (carcinoma epitelial alveolar humano) (Tanabe et al., 2006). Los trabajos más recientes en células y fluido de lavado broncoalveolar (LBA) sarcoideo mostraron una importante regulación de la respuesta inmunitaria específica de P. acnes (Schupp et al., 2015). Además, los experimentos en ratones han demostrado que P. acnes viable puede inducir granulomas pulmonares similares a los observados en pacientes con sarcoidosis (Werner et al., 2017). Eishi (2013) ofrece una visión general que detalla la relación entre la sarcoidosis y P. acnes.
Los estudios que intentan caracterizar las vías de señalización activadas por P. acnes durante la infección mostraron que el factor nuclear-kappaB , un factor transcripcional que regula la expresión de los genes implicados en las cascadas inmunitarias e inflamatorias es activado por P. acnes (Kim et al., 2002). Más ampliamente, se demostró que el receptor toll-like 2 (TLR2) es un receptor crítico para la respuesta dependiente de NF-κB a P. acnes, lo que revela la capacidad de esta bacteria para provocar la activación selectiva de los genes de la inmunidad innata (Inohara y Nuñez, 2001; Chamaillard et al., 2003; Moreira y Zamboni, 2012). Además, se examinó el papel de la genética del huésped en los casos de sarcoidosis asociados a la infección por P. acnes. Los polimorfismos de un solo nucleótido (SNP) en el dominio de oligomerización de unión a nucleótidos (NOD) de las proteínas NOD1 y NOD2 se correlacionaron con la infección por P. acnes entre 73 pacientes de sarcoidosis con 52 neumonías intersticiales y 215 controles sanos (Tanabe et al., 2006). NOD1 y NOD2 son receptores de reconocimiento de patrones intracelulares que pueden percibir moléculas bacterianas como las moléculas de peptidoglicano. En la misma línea, los experimentos in vitro han demostrado que la internalización de P. acnes en las células HEK293T puede provocar la activación de NOD1 y NOD2, lo que sugiere un mecanismo de la enfermedad basado en la inflamación crónica o la inmunosupresión local (Tanabe et al., 2006). Estos hallazgos también sugieren que el P. acnes invasivo puede actuar como ligando bacteriano para causar una activación aberrante del receptor NOD en ciertos individuos con susceptibilidad duradera a la sarcoidosis. Sin embargo, los experimentos futuros tienen que aclarar la cronología mecánica exacta de si la activación aberrante de NF-κB mediada por P. acnes puede inducir la formación de granulomas de una manera dependiente de NOD1/NOD2.
Aunque el P. acnes invasivo podría ser una posible etiología de la sarcoidosis y quizás de otras enfermedades, dilucidar la causalidad y la correlación entre la infección por P. acnes y la patología es turbia, ya que hay que tener en cuenta la heterogeneidad de las cepas bacterianas, la genética del huésped y el entorno del mismo siempre que un estudio vincule un microbioma con un estado de enfermedad.
Hiperplasia benigna de próstata (HBP) y cáncer de próstata
Los procesos inflamatorios crónicos o recurrentes han estado implicados durante mucho tiempo en la progresión de la HBP y el cáncer de próstata (De Marzo et al., 1999; Nelson et al., 2004; Sfanos et al., 2014). La inflamación se atribuye a la presencia de biomarcadores específicos como la interleucina (IL)-6 elevada, el factor de necrosis tumoral alfa (TNFα) y la proteína de fase aguda, la proteína C reactiva (Mechergui et al., 2009; Menschikowski et al., 2013; Yu et al., 2015). Trabajos recientes sobre fluidos urológicos (es decir, orina, líquido seminal, secreciones prostáticas), así como biopsias de próstata, sugieren un cambio condicional significativo hacia ciertas especies microbianas que pueden utilizarse como índice de diagnóstico (Yu et al., 2015; Ni et al., 2016).
Una buena cantidad de trabajos están sugiriendo que la asociación específica de P. acnes con la próstata y la invasión de las células epiteliales de la próstata en particular (Figura 3) puede contribuir a la patología de la HBP o del cáncer de próstata con un componente inflamatorio (Sfanos et al., 2013; Davidsson et al., 2016). Sin embargo, actualmente no está claro si P. acnes representa un verdadero agente infeccioso de la próstata, un comensal o un microbión prostático accidental. Es plausible que los P. acnes localizados en la próstata sean derivados de la piel que se introducen accidentalmente, por ejemplo, durante una biopsia de próstata, un punto de vista que debería suscitar preocupación con ciertos escenarios de trabajo diagnóstico.
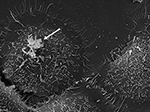
Figura 3. MEB de la cepa P. acnes P6 (flecha) in vitro sobre células epiteliales de próstata cultivadas RWPE1. El comportamiento invasivo de las células epiteliales de próstata de P. acnes está bien documentado tanto en estudios in vivo como en estudios basados en células, en los que parece probable un proceso de invasión mediado por la vimentina (Mak et al., 2012). Microscopía de Volker Brinkmann, Instituto Max Planck de Biología de la Infección, Berlín, Alemania. Barra de escala = 2 μm.
Cualquiera que sea la vía de entrada o el potencial patógeno, un número significativo de tejidos prostáticos obtenidos mediante resección transuretral para la HBP, o prostatectomía radical para el cáncer, fueron previamente analizados como positivos para agregados de P. acnes que aparentemente residen dentro de macrófagos errantes (Alexeyev et al., 2007; Bae et al., 2014). Otros informes basados en muestras humanas han aportado más pruebas de una relación entre la HBP o el cáncer de próstata y P. acnes utilizando diversos enfoques técnicos, como el cultivo, la microscopía confocal para la visualización de la bacteria y la hibridación in situ, la inmunohistoquímica (Figura 4) y el perfilado basado en la PCR del ARNr 16S bacteriano (Hochreiter et al., 2000; Cohen et al., 2005; Sfanos et al., 2008; Fassi-Fehri et al., 2011; Bae et al., 2014; Davidsson et al., 2016). Otras pruebas proceden de estudios en animales que indican que la inoculación de P. acnes en la próstata y la vejiga de murinos o ratas da lugar a una respuesta inflamatoria manifiesta y a largo plazo y a una amplia gama de alteraciones celulares dentro de la glándula prostática (Olsson et al., 2012; Shinohara et al., 2013).
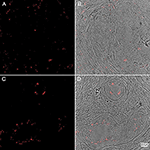
Figura 4. Inmunohistoquímica de muestras de tejido prostático humano teñidas con el anticuerpo contra P. acnes (rojo). Adaptado con permiso de Fassi-Fehri et al., 2011 (Figura suplementaria 2B). Presencia de P. acnes en muestras de tejido prostático humano con hiperplasia prostática benigna (A,B); o adenocarcinoma (C,D). Se detectó una amplia carga bacteriana en ambos casos.
Los intentos de analizar filogenéticamente las cepas de P. acnes asociadas a la enfermedad de las glándulas prostáticas cancerosas han revelado que la mayoría de los aislados de próstata pertenecen a clados filogenéticos que son raros en la piel humana, lo que indica que es poco probable una contaminación derivada de la piel durante la toma de muestras (Mak et al., 2013; Davidsson et al., 2016). En la misma línea, vías inflamatorias similares a las descritas para la sarcoidosis, incluyendo NF-κB, IL-6, STAT3 y COX2, parecen ser activadas por P. acnes tanto en condiciones in situ como in vitro (Drott et al., 2010; Fassi-Fehri et al., 2011; Mak et al., 2013; Tsai et al., 2013; Bae et al., 2014). Aunque la etiología precisa de estos cambios inflamatorios aún no está clara, en los sistemas urinario y genital de los mamíferos están ampliamente distribuidas varias vías de receptores de reconocimiento de patrones unidos a la membrana que reconocen con avidez los componentes bacterianos y virales (Jorgensen y Seed, 2012; Gambara et al., 2013). Estos receptores de las células huésped, por ejemplo los TLR, promueven la producción de citoquinas, que es una característica fundamental de la inmunidad innata contra los patógenos microbianos. En conjunto, estos hallazgos sugieren que, a través de su capacidad para desencadenar diversos aspectos de la inmunidad, el P. acnes invasor puede actuar como conductor primario y/o amplificador de la gravedad de la enfermedad.
Espondilodiscitis y dolor de espalda
Una de las diversas complicaciones postoperatorias en las que interviene el P. acnes es la inflamación del disco intervertebral y del espacio intervertebral circundante (discitis) tras la discectomía (Harris et al., 2005). La infección degenerativa concomitante de las vértebras adyacentes (espondilodiscitis) puede ser una característica común y la causa principal de graves daños neurológicos y dolor si se retrasa el tratamiento (Uçkay et al., 2010). Aparte de la introducción quirúrgica involuntaria en la columna vertebral, los patógenos también pueden llegar a través del suministro de sangre arterial y venosa de la columna vertebral (propagación hematógena). Aunque las especies Staphylococcus aureus, Escherichia coli y Proteus son las más comúnmente aisladas, P. acnes es el patógeno anaerobio más abundante en este contexto y es probable que esté infradeclarado debido a las dificultades de cultivo. Ha habido algunas pruebas clínicas de que los pacientes con material de disco nuclear (núcleo pulposo) herniado infectado con patógenos anaerobios en general, y P. acnes en particular, tienen más probabilidades de desarrollar inflamación y edema de las vértebras adyacentes (cambios de Modic tipo I) y dolor de espalda (Albert et al., 2013; Urquhart et al., 2015). Los seguimientos clínicos y en animales están corroborando ahora los hallazgos iniciales que muestran que la proliferación local de P. acnes provoca la regulación al alza de los marcadores inflamatorios y la degeneración del disco, consistente con los cambios Modic (Aghazadeh et al., 2016; Dudli et al., 2016). Ahora hay incluso las primeras pruebas clínicas que sugieren que la infección bacteriana del disco intervertebral con P. acnes y/o Staphylococcus epidermidis puede en realidad preceder a todos los demás problemas como la causa raíz de la hernia de disco y los cambios patológicos asociados (Rajasekaran et al., 2017).
Enfermedad de Parkinson (EP)
El cerebro en degeneración se caracteriza por el daño del sistema neural que puede atribuirse a la agregación atípica y a la deposición de proteínas mutantes o mal plegadas (por ejemplo, cuerpos de Lewy y neuritas de Lewy), como se ha documentado claramente en la EP idiopática (Taylor et al., 2002). Lo que generalmente no se aprecia es que el cerebro también es susceptible de ser invadido por patógenos que van desde virus y bacterias hasta hongos. Estos patógenos, o más específicamente sus componentes endógenos y/o metabolitos, pueden producir déficits neurológicos centrales que van desde signos sutiles de demencia y distonía, que resultan de una infección crónica y recurrente (De Chiara et al., 2012; Bibi et al., 2014), hasta una enfermedad más grave de la neurona motora, como por ejemplo la observada con el retrovirus endógeno humano K (Li et al., 2015). Así pues, está claro que los seres humanos tienen una carga sistémica tremendamente pesada de microbios (Potgieter et al., 2015; Spadoni et al., 2015) que puede contribuir incidentalmente a la patología de las enfermedades neurodegenerativas progresivas con componente proteico atípico. Ciertamente, esta hipótesis de trabajo está ganando un apoyo considerable, ya que el comportamiento cognitivo, emocional o patológico parece verse afectado indirectamente por la distribución espacial y personal de los microbios que actúan a través del eje intestino-cerebro (Figura 5) (Collins et al., 2012; Dinan et al., 2013; Mayer et al., 2014; Burokas et al., 2015). De hecho, un reciente estudio de casos y controles demostró que la variación microbiana en el tracto gastrointestinal, tanto entre individuos como dentro de ellos, corresponde de manera más significativa a las variaciones fenotípicas en la EP (Scheperjans et al., 2015; Vizcarra et al., 2015). Aunque los mecanismos subyacentes que vinculan la composición de la microbiota con las diferencias en la EP no están claros, el hallazgo anterior podría al menos explicar la alta prevalencia de anormalidades gastrointestinales observadas en los pacientes con EP (Dobbs et al., 2016). Relacionando aún más la microbiota con la gravedad de la EP, las biopsias de la mucosa sigmoidea y el material fecal recogido de pacientes con EP mostraron la presencia de especies bacterianas oportunistas y proinflamatorias que a menudo causan estreñimiento crónico, síndrome del intestino irritable y colitis ulcerosa (Keshavarzian et al., 2015). Colectivamente, estos resultados iniciales sugieren que las relaciones entre las diferentes comunidades microbianas en el intestino son una comorbilidad común en la EP, y que las firmas individuales únicas del ecosistema intestinal pueden reforzar las deficiencias motoras clásicas de la EP.
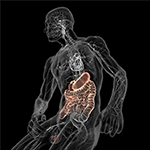
Figura 5. Ilustración esquemática del eje intestino-cerebro (en color) con el sistema digestivo lleno de microbios en un extremo y el cerebro con sus centros de homeostasis (hipotálamo e hipófisis) en el otro. Ambos están conectados a través del sistema nervioso cardiovascular y autónomo, incluido el nervio vago (nervio craneal X), que podría facilitar la transición microbiana al sistema nervioso central (SNC). Con permiso de Bryan Christie Design (http://bryanchristiedesign.com/).
Con estos antecedentes, la pregunta que hay que hacerse es si hay alguna evidencia de que P. acnes desempeña algún papel en la fisiopatología de la EP. Para que esta posibilidad se produzca, deben cumplirse dos condiciones (1) la infección por P. acnes debe preceder a la aparición de los síntomas clásicos de la enfermedad, como los temblores, la iniciación motora y la lentitud de movimientos; y (2) la inoculación de P. acnes debe inducir suficientemente los síntomas de la EP y/o provocar la pérdida de las neuronas de proyección de la dopamina en el núcleo del cerebro medio conocido como substantia nigra pars compacta. Hasta ahora, nuestro laboratorio ha detectado grupos de P. acnes localizados en las neuronas del cerebro medio y en las estructuras corticales cercanas de los cerebros de EP autopsiados (Figura 6). Este inesperado hallazgo añade más credibilidad a la contribución indirecta de P. acnes a los brotes locales de inflamación, similares a los observados en la sarcoidosis y la HBP. Una cuestión abierta es hasta qué punto P. acnes puede potenciar indirectamente ciertas características patológicas de la EP. Como la EP es un trastorno muy heterogéneo, es poco probable que un mecanismo de la enfermedad se aplique a todos los fenotipos de la EP. Sin embargo, es intrigante especular que los microbios de la piel residentes podrían iniciar o amplificar la progresión de la EP a través de factores inflamatorios y/o de predisposición genética.

Figura 6. Inmunohistoquímica de muestras de tejido cerebral medio humano teñidas para P. acnes (verde; A+B), microtúbulos neuronales (MAP2; rojo; A) y núcleos (DAPI; azul; A+B). La autofluorescencia de lipofuscina ligada a la edad se extinguió con Sudán Negro B. Presencia de P. acnes (flecha) en el espacio periplásmico de una neurona humana (A) entre el núcleo (n) y el citoesqueleto; o de un neutrófilo (B) con su característico núcleo multilobulado dentro de un capilar del cerebro medio (Cap). Estos hallazgos son típicos de la EP y están ausentes en la mayoría de las secciones de control. Los movimientos retrógrados a lo largo de los nervios craneales, las microsangrías inducidas por traumas, así como el recién descubierto sistema glinfático, representan posibles vías microbianas hacia el SNC.
Si P. acnes puede acceder a las células dopaminérgicas del mesencéfalo, ¿cuál es la vía más probable de inoculación e infección? Aunque la piel está físicamente compartimentada del cerebro, la inoculación cruzada sigue siendo un factor de riesgo. Por ejemplo, las fosas nasales podrían albergar cepas patógenas de P. acnes que luego se trasladarían al parénquima cerebral para hiperactivar los macrófagos locales llamados microglía; un fenómeno que es una característica consistente de la patología de la EP (revisado por Chao et al., 2014). Las investigaciones sobre las infecciones nosocomiales demuestran que especies bacterianas tan diversas como Pneumococcus sp. (Zwijnenburg et al., 2001) y Salmonella sp. (Bollen et al., 2008) se desplazan fácilmente a lo largo del nervio olfativo (nervio craneal 1; CN 1) y, finalmente, al bulbo olfativo. Otra posible vía de entrada de microbios nocivos o proteínas mal plegadas peligrosas es el nervio vago (nervio craneal 10; CN 10). De hecho, en algunas circunstancias, los agregados mal plegados en forma de cuerpos de Lewy y neuritas de Lewy parecen migrar desde el nervio vago hasta el cerebro, proporcionando más pruebas de que las bacterias patógenas en asociación con las proteínas tóxicas pueden contribuir a la vulnerabilidad neuronal selectiva (Holmqvist et al., 2014). Es interesante que los núcleos cerebrales del CN 1 y del CN 10 estén entre los primeros sitios que muestran preferentemente la deposición de cuerpos de Lewy y neuritas de Lewy durante el curso de la progresión de la EP (Braak et al., 2004). Esta observación particular no sólo pone de relieve una probable vía de entrada de las bacterias en el cerebro, sino que también proporciona un mecanismo potencial para la observación de que la vagotomía troncal disminuye significativamente el riesgo de EP (Svensson et al., 2015). La relación entre el traumatismo craneoencefálico y la EP (Harris et al., 2013; Jafari et al., 2013; Pearce et al., 2015), junto con la noción de un microbioma sanguíneo diverso (Potgieter et al., 2015), implica un vasto potencial de oportunismo patógeno al producirse brechas traumáticas en la barrera hematoencefálica. Con el reciente descubrimiento de un sistema linfático cerebral (glinfático) (Iliff et al., 2012; Hitscherich et al., 2016) hay que tener en cuenta otra posible vía de infección cerebral.
En conjunto, hay pruebas preclínicas y algunas clínicas que implican indirectamente a P. acnes como una variable independiente que afecta a la incidencia o gravedad de la EP. Estas pruebas se complementan con informes que asocian un trastorno cutáneo grave, el acné inverso, con la enfermedad de Alzheimer (Wang et al., 2010). Desde una perspectiva terapéutica, la posibilidad de que P. acnes impulse o amplifique las características principales de la EP representa un recurso importante para los enfoques antibióticos de las enfermedades neurodegenerativas. Y desde la perspectiva de la investigación, valdría la pena examinar más de cerca a los pacientes con trastornos de la piel en busca de evidencias de neuropatología con un inicio más temprano y un fenotipo de enfermedad más grave.
Perspectiva de futuro
La revisión presentada en este artículo esboza un inesperado lado oscuro de P. acnes con respecto a la patología. La persistencia intracelular de P. acnes está implicada en enfermedades de los pulmones y de la glándula prostática y posiblemente del cerebro. Esto es un claro testimonio de la patogenicidad de las bacterias derivadas de la piel en ciertos fenotipos de enfermedades. Las investigaciones futuras deberán centrarse en varias cuestiones que se plantean en la biología de P. acnes: (1) ¿cuáles son las interacciones cruciales de P. acnes en la susceptibilidad a las enfermedades? (2) ¿Cuáles son los mecanismos utilizados por P. acnes para influir en la progresión de la enfermedad? (3) Si ciertas poblaciones de P. acnes pueden aumentar la susceptibilidad a la gravedad de la enfermedad, ¿existen otras configuraciones de P. acnes que sean protectoras? (4) ¿Prueba de concepto de que la infección por P. acnes se asocia directamente con la patología de la enfermedad, o más concretamente, el estudio de concepto muestra causalidad o sólo correlación? Y, por último, (5) ¿Puede tratarse la patología de la enfermedad provocada por P. acnes con terapia antibiótica convencional y aplicaciones de diagnóstico?
Contribuciones de los autores
JL, KER, JC, KR, CH, AM, HB y GT prepararon el manuscrito. JL y MS prepararon las figuras.
Financiación
La financiación intramuros para JL fue proporcionada por el Colegio de Medicina Osteopática de NYIT.
Declaración de conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un potencial conflicto de intereses.