El uso y la importancia de las células y baterías son incuestionables. En nuestro día a día, hacemos uso de las pilas de muchas maneras diferentes. Ahora, en los últimos conceptos, ya te hemos presentado las pilas en general. Sin embargo, aquí le daremos un análisis en profundidad de las pilas galvánicas. Así que, empecemos.
Vídeos sugeridos
Células galvánicas
Entre otras células, una célula galvánica es un tipo de célula electroquímica. Se utiliza para suministrar corriente eléctrica haciendo la transferencia de electrones a través de una reacción redox. Una célula galvánica es una idea ejemplar de cómo se puede aprovechar la energía utilizando reacciones sencillas entre unos pocos elementos determinados. Es asombroso estudiar cómo se puede montar y utilizar una célula galvánica para obtener energía.
Explicado en los términos más sencillos, una célula galvánica actúa como un dispositivo en el que se producen reacciones simultáneas de oxidación y reducción. Estas reacciones se utilizan para convertir la energía química en energía eléctrica, que puede utilizarse para cualquier fin comercial.
Buscar más temas en Electroquímica
- Baterías
- Conductancia de soluciones electrolíticas
- Corrosión
- Células electroquímicas
- Células electrolíticas y electrólisis
- Células de combustible
- Ecuación de Nernst
- Variación de la conductividad y la conductividad molar con la concentración
Funcionamiento de las células galvánicas

El funcionamiento de una célula galvánica es bastante sencillo. Implica una reacción química que hace que la energía eléctrica esté disponible como resultado final. Durante una reacción redox, una célula galvánica utiliza la transferencia de energía entre los electrones para convertir la energía química en energía eléctrica.
La célula galvánica utiliza la capacidad de separar el flujo de electrones en el proceso de oxidación y reducción, provocando una media reacción y conectando cada una de ellas con un cable para que se pueda formar un camino para el flujo de electrones a través de dicho cable. Este flujo de electrones se llama esencialmente corriente. Dicha corriente puede hacerse fluir a través de un cable para completar un circuito y obtener su salida en cualquier dispositivo como un televisor o un reloj.
Una célula galvánica puede hacerse con dos metales cualesquiera. Estos dos metales pueden formar el ánodo y el cátodo si se dejan en contacto entre sí. Esta combinación permite la corrosión galvánica de aquel metal que sea más anódico. Se necesitará un circuito de conexión para permitir que se produzca esta corrosión.
Configuración de una célula galvánica
Para crear una célula galvánica, habría que pasar por la siguiente configuración. La célula incluiría idealmente dos electrodos. Uno de estos electrodos, el cátodo, será un electrodo con carga positiva mientras que el otro, será el ánodo, el electrodo con carga negativa.
Estos dos electrodos formarán los dos componentes esenciales de la célula galvánica. La reacción química relacionada con la reducción tendrá lugar en el cátodo, mientras que la semirreacción de oxidación tendrá lugar en el ánodo. Como ya se ha dicho, se pueden utilizar dos metales cualesquiera para crear la reacción química.
Entendiendo la célula galvánica con un ejemplo
Tomemos un ejemplo en el que los dos metales que intervienen en la reacción química son el zinc y el cobre. Al producirse la reacción química, el zinc acabaría perdiendo dos electrones. Esto será tomado por el cobre para convertirse en cobre elemental. Dado que estos dos metales se colocarán en dos recipientes separados y se conectarán mediante un cable conductor, se formará una corriente eléctrica que transferirá todos los electrones de un metal a otro.
Al mismo tiempo, los dos metales se sumergirán en una solución salina, digamos, sulfato de Zinc y sulfato de Cobre en este caso. En este caso, las dos soluciones no se mezclan directamente, sino que pueden unirse mediante un puente o un medio. Este medio será responsable de la transferencia de iones pero también se asegurará de que las dos soluciones no se mezclen entre sí.
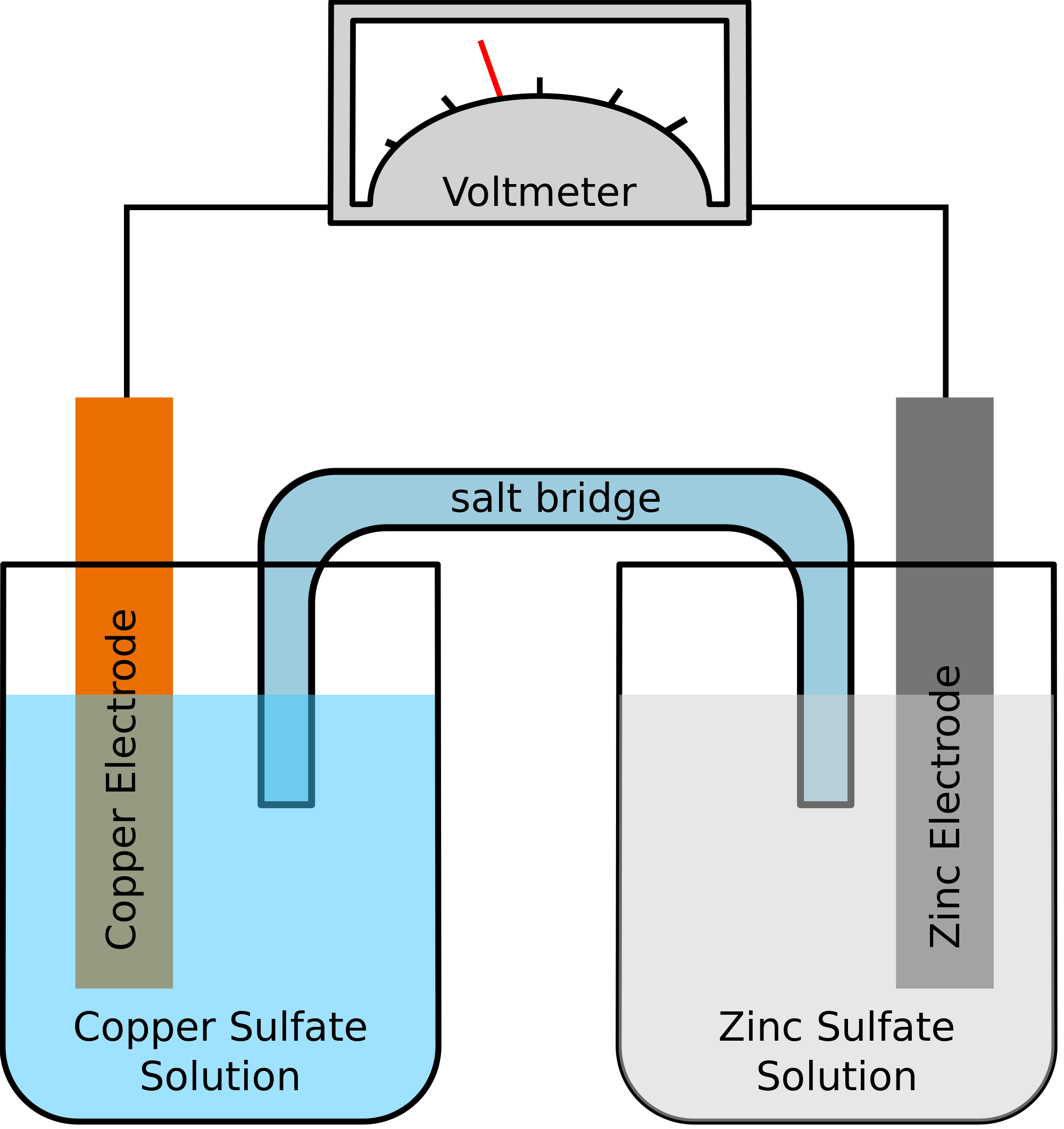
Este puente ayuda a completar el circuito para llevar la carga eléctrica y también se asegura de que las soluciones en los recipientes con los metales permanezcan neutrales y no se mezclen entre sí. Mientras el puente de sal no interfiera con la reacción redox, bajo la cual la oxidación y la reducción están teniendo lugar, no importa qué puente de sal se está utilizando en la reacción química.
Algunos términos importantes
Algunos de los términos importantes que se utilizan en las células galvánicas se enumeran a continuación:
- Límites de fase: Se refiere a los dos metales que actúan como cátodo y ánodo.
- Puente de sal: El puente o medio de conexión que permite que se produzca una reacción redox.
- Oxidación y reducción: Los procesos químicos que permiten que la corriente eléctrica se forme y fluya a través de una célula galvánica.
Ejemplos resueltos para ti
Pregunta: En una célula galvánica, ¿qué ocurriría si no se utiliza un puente de sal mientras tiene lugar la reacción redox?
Solución: En ausencia de un puente de sal dentro de cada recipiente que contiene los metales, la reacción redox comenzaría de manera muy similar. Pero en ausencia del puente salino, la misma llegaría a su fin de forma bastante abrupta. Las soluciones respectivas no podrán mantener su neutralidad eléctrica. Aparte de esto, no habrá ningún cambio en la reacción química ni ninguna alteración de ningún tipo por la ausencia del puente salino o del medio.