La acetilación se refiere a una reacción que introduce un grupo funcional acetilo en un compuesto químico, en la que el átomo de hidrógeno de un grupo hidroxilo se sustituye por un grupo acetilo (CH3 CO) para dar lugar a un éster específico, el acetato. La acetilación de las proteínas suele adoptar dos formas diferentes. En los seres humanos, casi (80%-90%) las proteínas se acetilan de forma cotraduccional en sus Nα-terminales de las cadenas polipeptídicas nacientes. Otro tipo se acetila típicamente en los residuos de lisina.
La acetilación N-terminal
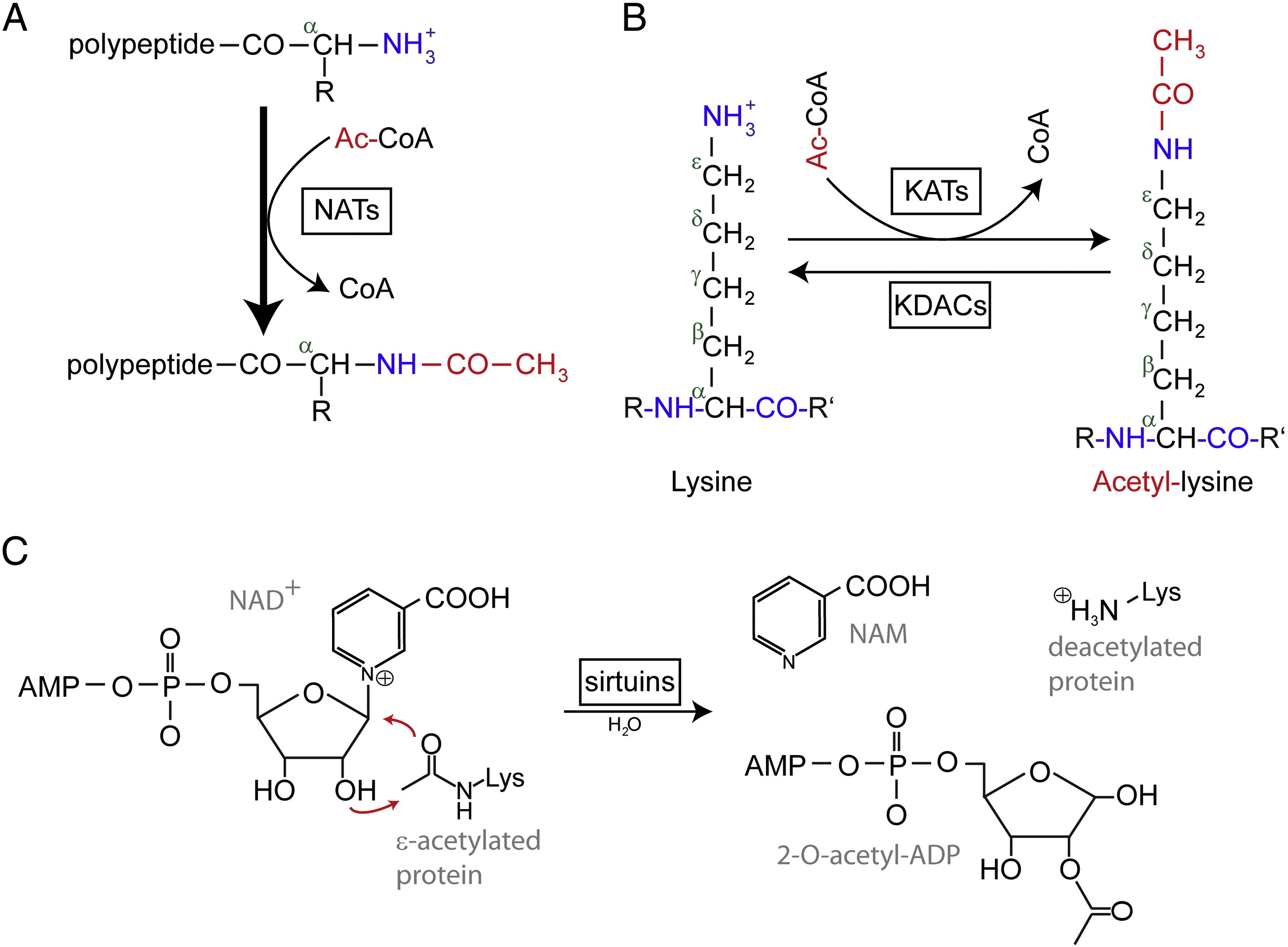
La acetilación N-terminal (Nt) es catalizada por las Nt-acetiltransferasas (NATs) y se encuentra que es irreversible hasta ahora. Las NATs, enzimas monosubunitarias o multisubunitarias compuestas por una subunidad catalítica y hasta dos subunidades auxiliares, pueden transferir un grupo acetilo desde la acetil-coenzima A (Ac-CoA) al grupo α-amino del primer residuo de aminoácido de la proteína. En las NATs, la subunidad auxiliar principal modula la actividad y la especificidad del sustrato de la subunidad catalítica. Diferentes NATs son responsables de la acetilación del Nt. En los humanos, se han encontrado hasta ahora seis NATs, incluyendo NatA, NatB, NatC, NatD, NatE y NatF. Además de la diferencia en la composición de las subunidades, los distintos NATs varían en sus especificidades de sustrato.
La acetilación de Nt desempeña diferentes papeles en los efectos moleculares. En primer lugar, la Nt-acetilación determina la localización subcelular de ciertas proteínas. Por ejemplo, Arl3 y Grh1, dos proteínas asociadas al Golgi, no pueden asociarse al aparato de Golgi cuando les falta el grupo Nt-acetilo. En segundo lugar, se ha informado de que la Nt-acetilación restringe las proteínas en el citosol e inhibe una migración de translocación postraduccional al retículo endoplásmico (RE) y a la vía secretora. Además, la acetilación Nt puede alterar las propiedades del N-terminal para hacer que las interacciones proteína-proteína se modifiquen. Se ha demostrado para varias proteínas que la afinidad con sus socios de unión aumenta después de ser Nt-acetiladas. Por ejemplo, la enzima ubiquitina-conjugadora E2 Ubc12 se somete a la Nt-acetilación por parte de NatC, lo que permite aumentar la afinidad hacia su socio de interacción, la ubiquitina ligasa E3 Dcn1. Además, la Nt-acetilación controla la calidad y el tiempo de vida de las proteínas, y regula la estequiometría de las mismas mediante la vía de la regla N-end.
La acetilación N-terminal tiene muchas funciones en la fisiología. Los NATs son esenciales para el desarrollo normal, el desarrollo de los huesos y los vasos sanguíneos. La acetilación N-terminal puede regular la presión sanguínea, la localización del proteasoma, la hormona, así como la estructura y la función de los orgánulos. En las enfermedades humanas, está relacionada con las enfermedades neurodegenerativas (como la enfermedad de Alzheimer, la enfermedad de Parkinson y la demencia de cuerpos de Lewy) y el cáncer (como el cáncer de pulmón, el cáncer de mama y el cáncer colorrectal).
La acetilación de la lisina
Los residuos de lisina acetilados se descubrieron por primera vez en las histonas que regulan la transcripción de los genes. Pero la acetilación de la lisina no se limita a las histonas. A diferencia de la acetilación de Nt, la acetilación de lisina es reversible. La acetilación es catalizada por las acetiltransferasas de lisina (KATs) y la desacetilación de los residuos de lisina es catalizada por las desacetilasas de lisina (KDACs).
Se ha informado de que se han identificado entre 17 y 22 genes de KATs en el genoma humano (el número exacto de KATs es controvertido), que pueden clasificarse en tres familias diferentes, incluyendo la familia de acetiltransferasas relacionadas con GCN5 (control general no derepresible 5), la familia MYST y la familia p300/CBP (proteína de unión a CREB). Los sustratos conocidos de los complejos KAT no sólo incluyen proteínas histónicas, sino también algunos factores de transcripción diferentes, corregidores transcripcionales y algunas proteínas de vías de señalización celular específicas como p53, β-catenina, NF-κB, MyoD o Rb. E incluso algunas moléculas de ARN pueden ser acetiladas. Hay cuatro tipos diferentes de KDACs, incluyendo la clase I, II, III y IV. Las de clase I, II y IV son amidohidrolasas dependientes de Zn2 +, mientras que las de clase III (también llamadas sirtuinas) utilizan NAD+ como co-sustrato para su actividad catalítica son amidohidrolasas dependientes de Zn2 +.
Las histonas son las primeras proteínas acetiladas descubiertas. Las moléculas de histonas son modificadas por diferentes PTMs, incluyendo la fosforilación, la metilación y la acetilación. La acetilación de las histonas, determinan el ensamblaje de las mismas, así como el plegamiento y la compactación de la interacción ADN-histona y, por tanto, presentan un cambio entre la estructura permisiva y represiva de la cromatina. Además de las histonas, las KAT pueden catalizar las proteínas del citoesqueleto. Hay algunos nuevos sitios de acetilación identificados en otras proteínas, incluyendo las proteínas HMG, c-Myc, los receptores de estrógenos y andrógenos, E2F/Rb, etc.
Se ha informado de las funciones fisiológicas de la acetilación de lisina. Las proteínas histónicas se asocian a una estrecha regulación de esencialmente todos los tipos de procesos provocados por el ADN como la transcripción, la replicación, la recombinación, la reparación, así como la traducción y la formación de estructuras de cromatina especializadas. Por lo tanto, la acetilación de lisina de las proteínas afecta a una serie de vías de señalización celular, así como al metabolismo, las respuestas al estrés, la apoptosis y el tráfico de membranas.
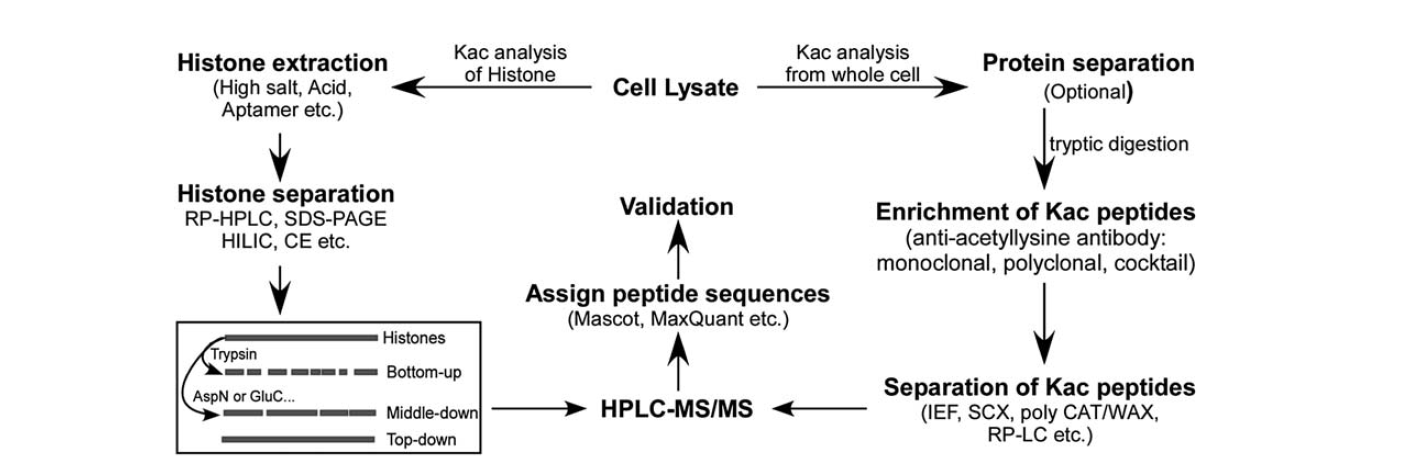
Hay relativamente pocas herramientas disponibles para identificar la acetilación de lisina. Con el desarrollo de la espectrometría de masas, ésta ha sido una herramienta importante para la identificación y cuantificación de la acetilación de lisinas. Para analizar la acetilación de lisina de las histonas, hay varios pasos, incluyendo el lisado celular, la extracción de las histonas, la separación de las histonas, la espectrometría de masas y el análisis de los datos. Los pasos para el análisis de la acetilación de lisina de proteínas de la célula completa incluyen el lisado celular, la separación de proteínas, el enriquecimiento de péptidos de acetilación de lisina, la separación de péptidos de acetilación de lisina, la espectrometría de masas y el análisis de datos.