
Cuando se hace burbujear gas de cloro a través de un cilindro de zumo de tomate, la mezcla de cloro y zumo de tomate se vuelve casi completamente blanca en cinco minutos. Este espectacular cambio es el resultado de la acción química del cloro, que actúa como agente blanqueador oxidante, sobre los pigmentos del zumo de tomate. Cuando los viejos recortes de periódico, descoloridos por el envejecimiento y la exposición a la luz, se tratan con una solución acuosa de borohidruro de sodio al 1%, el papel se blanquea de forma espectacular en veinte minutos. En este caso, el papel ha recuperado su color blanco original por la acción del borohidruro de sodio que actúa como agente blanqueador reductor.
Un agente blanqueador es una sustancia que puede blanquear o decolorar otras sustancias. Las sustancias coloreadas generalmente contienen grupos de átomos, denominados cromóforos , que pueden absorber luz visible con longitudes de onda específicas y características, y reflejar o transmitir la parte de luz que no se absorbe. Por ejemplo, si un cromóforo absorbe la luz azul, reflejará la luz del color complementario, y la sustancia que contiene el cromóforo aparecerá de color amarillo. Los agentes blanqueadores destruyen esencialmente los cromóforos (eliminando así el color), mediante la oxidación o reducción de estos grupos absorbentes. Así, los blanqueadores pueden clasificarse como agentes oxidantes o agentes reductores .
Algunos de los usos de los agentes blanqueadores son:
- El blanqueo de textiles y tejidos
- El blanqueo de la pulpa de madera
- La eliminación de manchas
- Lavado y limpieza comercial y doméstica
- . Como ingredientes de limpiadores para fregar y productos para lavar la vajilla
- El blanqueo del cabello
Blanqueadores oxidantes
Un gran número de blanqueadores oxidantes fueron revisados por Jules A. Szilard en Bleaching Agents and Techniques (1973). Los blanqueadores oxidantes (y los agentes blanqueadores) de uso común en la actualidad son: el cloro, el dióxido de cloro, los hipocloritos alcalinos, el peróxido de hidrógeno, los compuestos de peróxido y la luz solar y artificial.
Cloro (Cl 2 ). El descubrimiento del cloro por el químico sueco Carl Wilhelm Scheele en 1774 marcó el inicio de la era moderna del blanqueo. Según Sidney M. Edelstein en un artículo de la revista de 1948 titulado «The Role of Chemistry in the Development of Dyeing and Bleaching» (El papel de la química en el desarrollo del tinte y el blanqueo), el químico francés Claude-Louis Berthollet fue el primero en utilizar el cloro para blanquear tejidos de algodón y lino.
El cloro se ha utilizado para blanquear la pasta de madera. Muchas fábricas de pasta que emplean el proceso de fabricación de pasta Kraft preparan el hidróxido de sodio (necesario para digerir las virutas de madera) in situ mediante la electrólisis de la salmuera , una solución acuosa concentrada de cloruro de sodio.
2NaCl + 2H 2 O → 2NaOH + H 2 + Cl 2 (1)
El cloro es un producto secundario. El posterior blanqueo con cloro de la pulpa marrón da un producto que puede utilizarse para la fabricación de papel de escritura e impresión. Desgraciadamente, los compuestos orgánicos de la pasta se oxidan y se cloran, dando lugar a pequeñas cantidades de compuestos organoclorados, entre ellos
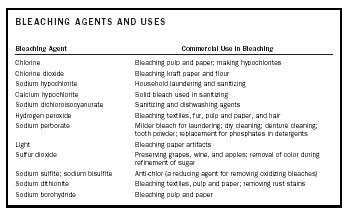
| AGENTES DE BLANQUEO Y USOS | |
| Agente de blanqueo | Uso comercial en el blanqueo |
| Cloro | Blanqueo de pulpa y papel; fabricación de hipocloritos |
| Dióxido de cloro | Blanqueo de papel kraft y de harina |
| Hipoclorito de sodio | Lavado e higienización del hogar |
| Calcio Hipoclorito | Blanqueador sólido utilizado en la desinfección |
| Dicloroisocianurato de sodio | Agentes desinfectantes y lavavajillas |
| Peróxido de hidrógeno | Blanqueo de textiles, pieles, pulpa y papel, y cabello |
| Perborato de sodio | Blanqueador más suave para el lavado limpieza en seco; limpieza de prótesis dentales; polvo dental; sustitución de fosfatos en detergentes |
| Luz | Blanqueo de artefactos de papel |
| Dióxido de azufre | Conservación de uvas, vino y manzanas; eliminación del color durante el refinamiento del azúcar |
| Sulfito de sodio bisulfito de sodio | Anticloro (un agente reductor para eliminar los blanqueadores oxidantes) |
| Ditionito de sodio | Blanqueo de textiles, pulpa y papel; eliminación de manchas de óxido |
| Borohidruro de sodio | Blanqueo de pasta y papel |
dioxinas. De hecho, la dioxina más abundante producida por el proceso de pulpa y blanqueo, la 2,3,7,8-tetraclorodibenzo- p -dioxina (2,3,7,8-TCDD), ha resultado ser tanto un carcinógeno como una toxina mortal . Por ello, el cloro como agente blanqueador está siendo sustituido por los agentes blanqueadores más seguros dióxido de cloro y peróxido de hidrógeno. De hecho, la tendencia en las industrias de la pulpa y el papel es hacia el blanqueo totalmente libre de cloro (TCF). El cloro se utiliza ahora en la industria del blanqueo principalmente para preparar soluciones de hipoclorito y blanqueadores secos como el hipoclorito de calcio.
Dióxido de cloro (ClO 2 ). El dióxido de cloro se ha utilizado como agente blanqueador tanto en su fase gaseosa como en solución acuosa. Debido a su naturaleza explosiva, el dióxido de cloro en fase gaseosa suele diluirse con nitrógeno o dióxido de carbono. Si se almacena o envía, el dióxido de cloro se pasa por agua fría y se mantiene bajo refrigeración.
El dióxido de cloro se prepara industrialmente mediante la reducción del clorato de sodio por el dióxido de azufre en solución acuosa.
2NaClO 3 + SO 2 + H 2 SO 4 → 2ClO 2 + 2NaHSO 4 (2)
Un método relativamente seguro para la preparación de ClO 2 implica la reacción entre el clorito de sodio (NaClO 2 ) y el formaldehído (H 2 CO).
H 2 CO + H + + ClO 2 – → HOCl + HCOOH (3)
A medida que avanza la reacción 3, el pH de la solución desciende (debido a la producción de ácido fórmico ). El aumento de la acidez de la solución promueve la formación de ClO 2 , mostrada en la ecuación 4.
HCOOH + HOCl + 2ClO 2 – → 2ClO 2 + Cl – + H 2 O + HCOO – (4)
En solución ácida, el dióxido de cloro se comporta como un agente oxidante. La reducción completa de ClO 2 se muestra en la ecuación 5.
ClO 2 + 4H + + 5 e – → Cl – + 2H 2 O (5)
Los pasos individuales de esta reacción de reducción global producen HClO 2 , HOCl, y Cl 2 , que se comportan como agentes oxidantes. Se requiere un medio ácido, ya que el ClO 2 se desproporciona en solución alcalina, como se muestra en la ecuación 6.
2ClO 2 + 2OH – → ClO 3 – + ClO 2 – + H 2 O (6)
El dióxido de cloro se utiliza principalmente para el blanqueo de la pulpa.
Hipocloritos (OCl – ). Las soluciones blanqueadoras de hipoclorito se hacen a partir de NaOCl y, en menor medida, de Ca(OCl) 2 . Los hipocloritos se utilizan en el lavado, como desinfectantes, en el blanqueo de la pulpa y los textiles, y en la eliminación de la tinta del papel reciclado. Las soluciones comerciales de blanqueo se obtienen haciendo pasar gas de cloro a través de hidróxido de sodio diluido y frío, como se muestra en la ecuación 7.
Cl 2 + 2OH – → OCl – + Cl – + H 2 O (7)
Alternativamente, el ion hipoclorito puede ser generado por la hidrólisis de compuestos orgánicos de nitrógeno-cloro. Algunos de los compuestos de nitrógeno-cloro más importantes utilizados de esta manera son los isocianuratos clorados. Estos se utilizan en productos de limpieza y lavavajillas.
Para ser un blanqueador eficaz, la solución de hipoclorito debe mantenerse alcalina (pH > 9,0), para suprimir la hidrólisis del OCl – (véase la ecuación 8) y evitar la formación de HOCl inestable.
OCl – + H 2 O → HOCl + OH – (8)
En las soluciones ácidas, el HOCl se forma y se descompone.
3HOCl → HClO 3 + 2HCl (9)
El HOCl también reaccionará con el HCl, uno de los productos de descomposición.
HOCl + HCl → H 2 O + Cl 2 (10)
Las soluciones de blanqueo con hipoclorito no deben contener cationes de metales pesados, ya que estos cationes (al igual que la luz o el calor) promueven la descomposición del HOCl, como se muestra en la ecuación 11.
2HOCl → 2HCl + O 2 (11)
Los principios activos de los blanqueadores de hipoclorito varían con el pH. A pH < 2, el Cl 2 es el principal componente en solución; a pH 4 a 6, el HOCl es la especie dominante; a pH > 9, el OCl – es el único componente presente. El ion hipoclorito en la solución básica es el ingrediente activo de la lejía doméstica, que suele tener entre un 5 y un 6 por ciento de NaOCl. El ion OCl – oxida los cromóforos de los materiales de color, y se reduce a su vez a iones de cloruro e hidróxido.
OCl – + H 2 O + 2 e – → Cl – + 2OH – (12)
El proceso de blanqueamiento efectuado por el blanqueador de hipoclorito comercial suele mejorarse con el uso de blanqueadores ópticos, compuestos que absorben la luz ultravioleta incidente y emiten luz visible, haciendo que el tejido parezca más brillante y blanco.
Peróxido de hidrógeno (H 2 O 2 ) . El peróxido de hidrógeno puede prepararse mediante la reacción del peróxido de bario y el ácido sulfúrico (véase la ecuación 13). Como el sulfato de bario se precipita, el peróxido de hidrógeno se separa fácilmente.
BaO 2 + H 2 SO 4 → BaSO 4 + H 2 O 2 (13)
El peróxido de hidrógeno, como agente blanqueador utilizado en la industria de la pasta y el papel, tiene la ventaja de que no es contaminante. Debido a la inestabilidad del peróxido de hidrógeno puro, se emplean soluciones acuosas para el blanqueo. A temperatura ambiente, el peróxido de hidrógeno se descompone muy lentamente en agua y oxígeno.
2H 2 O 2 → H 2 O + O 2 (14)
Sin embargo, la presencia de cationes de metales de transición (especialmente Fe 3+ , Mn 2+ , y Cu 2+ ) y otros catalizadores acelera drásticamente esta reacción. Como resultado, el peróxido de hidrógeno acuoso debe ser estabilizado con agentes complejantes que secuestren los cationes de metales de transición.
La especie activa de blanqueo en el peróxido de hidrógeno es el anión perhidroxilo , OOH – , formado a través de la ionización del H 2 O 2 .
H 2 O 2 + H 2 O → H 3 O + + OOH – (15)
La constante de ionización ácida del peróxido de hidrógeno es muy baja ( K a = 2 × 10 -12 ) con el resultado de que las soluciones de H 2 O 2 deben hacerse alcalinas para

para aumentar la concentración de OOH – . En ausencia de un medio alcalino, el peróxido de hidrógeno ya no es eficaz como agente blanqueador. Por ejemplo, la etapa de decoloración de la tintura del cabello a menudo emplea peróxido de hidrógeno (5-6%), pero también amoníaco para proporcionar un medio alcalino.
Al mismo tiempo, el pH no debe subir por encima de 11, ya que en este punto la descomposición de OOH – comienza a ocurrir.
2OOH – → O 2 + 2OH – (16)
Compuestos de peroxígeno. Existen varios compuestos sólidos de peroxígeno que liberan peróxido de hidrógeno cuando se disuelven en agua. Entre ellos se encuentran el perborato de sodio (NaBO 3 z 4H 2 O o NaBO 2 z H 2 O 2 z 3H 2 O) y el carbonato de sodio peroxidado (2Na 2 CO 3 z 3H 2 O 2 ). La estructura del perborato de sodio contiene el peroxoanión B 2 (O 2 ) 2 (OH) 4 2- , que contiene dos enlaces O-O que unen dos grupos BO 2 (OH) 2- tetraédricos. Estos compuestos de peroxígeno se utilizan en detergentes, limpiadores de dentaduras y polvos dentales.
Blanqueo con luz. El blanqueo que implica la luz solar natural o la luz artificial se ha utilizado para eliminar las manchas de los artefactos de papel y para tratar los textiles. El material a blanquear se sumerge primero en una solución alcalina de bicarbonato de calcio o de magnesio, y luego se protege de la radiación ultravioleta cubriéndolo con plexiglás, Lexan o Mylar. La exposición a la luz se deja entonces durante dos a cuatro horas, para la luz solar natural, y de dos a doce horas, para la luz artificial.
Blanqueadores reductores
Entre los agentes reductores utilizados en el blanqueo se encuentran los sulfitos, los bisulfitos, los ditionitos y el borohidruro de sodio, todos los cuales se utilizan en el blanqueo de la pasta de papel y los textiles.
Sulfitos (SO 3 2- ) y bisulfitos (HSO 3 – ). El estado de oxidación del azufre tanto en el SO 3 2- como en el HSO 3 – es +4, y la oxidación a +6 se produce fácilmente, con la formación de SO 4 2- y HSO 4 – , respectivamente, haciendo que los sulfitos y bisulfitos sean buenos agentes reductores.
Ditionitos (S 2 O 4 2- ) . Tanto el ditionito de sodio como el de zinc se han utilizado en el blanqueo de pulpas mecánicas y textiles. La preparación del ion ditiónito se lleva a cabo mediante la reducción del ion bisulfito y el dióxido de azufre con polvo de Zn.
2HSO 3 – + SO 2 + Zn → Zn 2+ + S 2 O 4 2- + SO 3 2- + H 2 O (17)
El ion ditionita, S 2 O 4 2- , que tiene azufre en el estado de oxidación +3, se comporta como un fuerte agente reductor en solución alcalina.
S 2 O 4 2- + 4OH – → 2SO 3 2- 2H 2 O + 2 e – (18)
A medida que se reduce el pH, el poder reductor del ion ditionito disminuye, como predice el principio de LeChatelier.
Los ditionitos son útiles para eliminar las manchas de óxido, y las soluciones de citrato neutro de Na 2 S 2 O 4 se utilizaron para eliminar los productos de la corrosión del hierro de los objetos recuperados del Titanic.
Borohidruro de sodio (NaBH 4 ). El borohidruro de sodio se ha utilizado principalmente en el blanqueo industrial de pulpas mecánicas. El ion BH 4 – es un fuerte agente reductor en solución alcalina.
BH 4 – + 10OH – → BO 3 3- + 8 e – + 7H 2 O (19)
Un problema con el uso de borohidruro de sodio es que el ion BH 4 – se descompone lentamente en solución acuosa.
BH 4 – + 4H 2 O → B(OH) 4 – + 4H 2 (20)
Como método alternativo, las sales de BH 4 – pueden disolverse en CH 3 OH o en el menos tóxico C 2 H 5 OH. La descomposición del ion BH 4 – en alcoholes se produce a una velocidad mucho más lenta:
BH 4 – + 4ROH → B(OR) 4 – + 4H 2 (R = CH 3 , C 2 H 5 ) (21)
Conclusión
Un agente blanqueador puede blanquear o decolorar una sustancia al reaccionar con los cromóforos responsables del color de la misma. Dependiendo de la naturaleza de los cromóforos, el agente blanqueador será un agente oxidante o reductor. Es decir, el cromóforo se oxida o se reduce para producir una sustancia incolora o blanqueada. Los agentes blanqueadores y sus usos comerciales se resumen en la Tabla 1.