Tendencia 2: Para los oxoácidos de un átomo central dado la acidez aumenta con el estado de oxidación del elemento central o, lo que es lo mismo, con el número de oxígenos unidos al átomo central.
Aquí estamos viendo la tendencia para los ácidos en los que hay un número variable de oxígeno unido a un átomo central dado. Un ejemplo es la serie de los ácidos perclórico (\ce{ClO_4^-}}), clórico (\ce{ClO_3^-}}), cloroso (\ce{ClO_2^-}}), e hipocloroso (\ce{ClO^-}}). En estas series, cuanto mayor sea el número de oxígenos, más fuerte será el ácido. Esto puede explicarse de varias maneras. Desde el punto de vista del propio ácido, el factor clave es de nuevo el efecto inductivo, que en este caso implica la capacidad de los oxígenos unidos al átomo central para atraer la densidad de electrones a través del enlace OH. Esto se ve en el diagrama de densidad de carga para los oxoácidos de cloro que se muestra en la Figura \(\PageIndex{1}\), en la que la carga positiva parcial en el hidrógeno ácido aumenta con el número de oxígenos presentes.
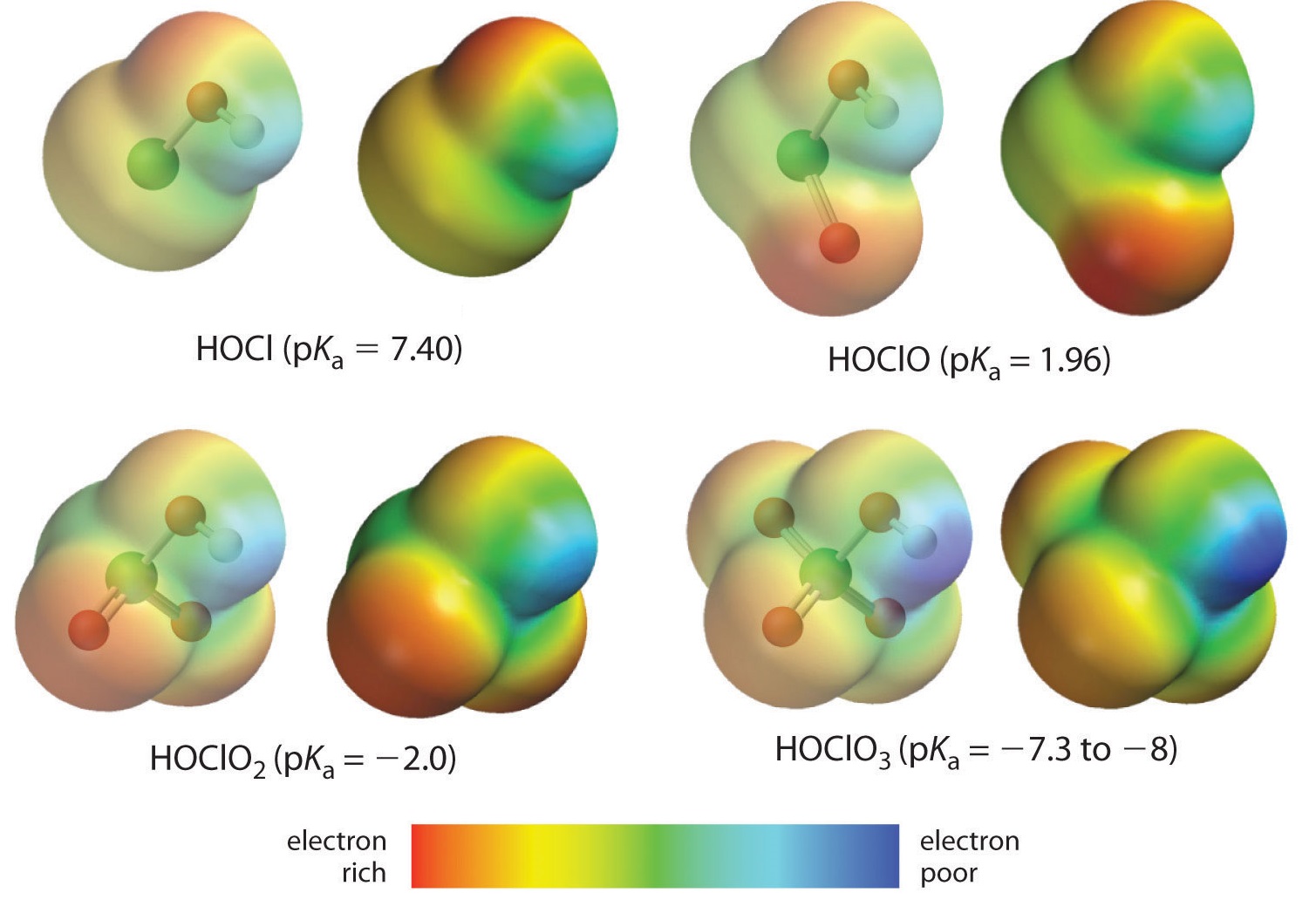
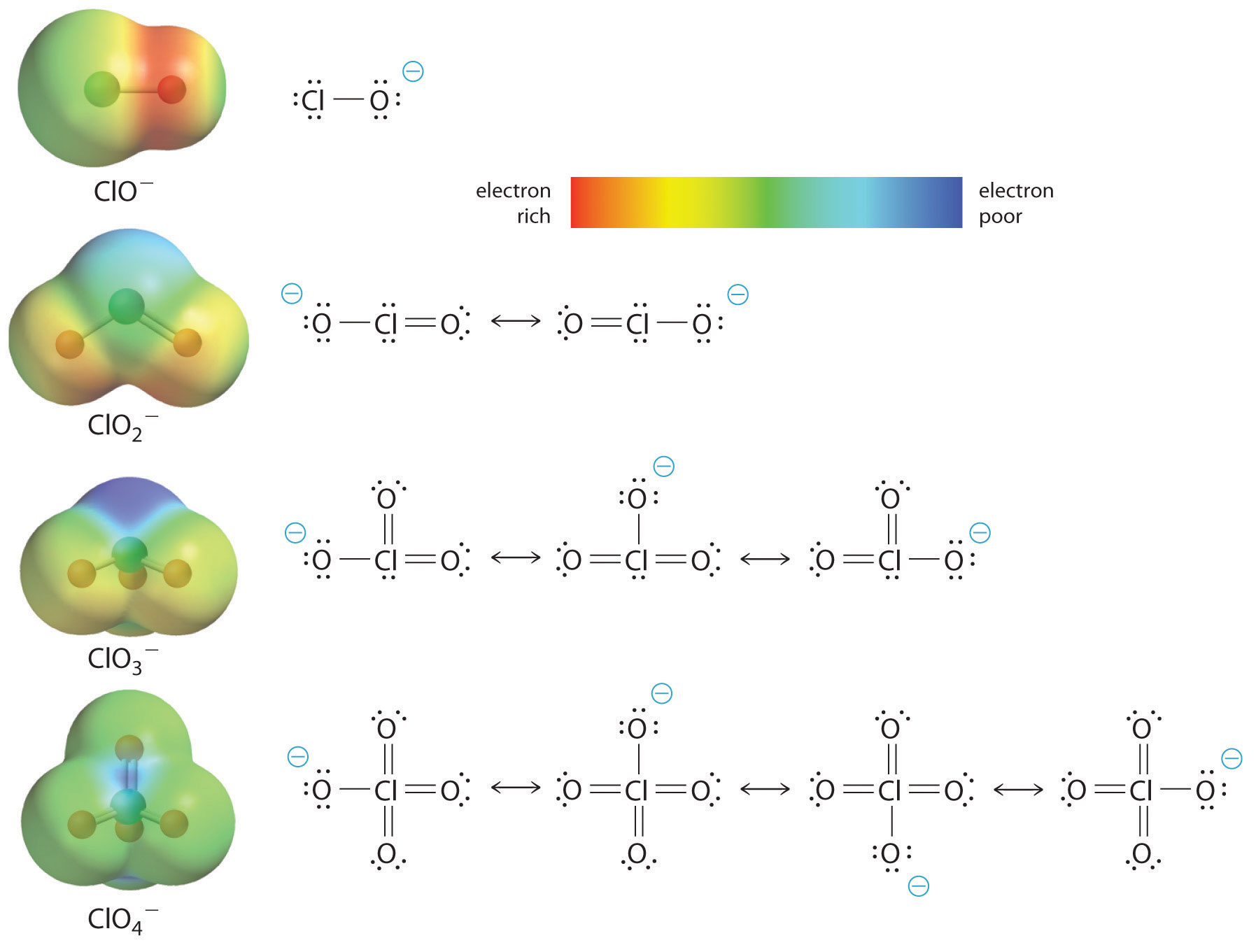
El aumento de la acidez del oxoácido con el número de oxígenos unidos al átomo central también puede verse considerando la estabilidad del oxianión conjugado. Que la estabilidad de la base conjugada aumenta con el número de oxígenos puede verse en los diagramas de distribución de carga y los modelos de enlace de Lewis para los oxianiones de cloro que se muestran en la figura \(\PageIndex{2}\). A medida que la carga negativa se reparte entre más átomos de oxígeno, se vuelve cada vez más difusa.
Ejercicio \(\PageIndex{1})
El azufre y el selenio forman ambos oxoácidos de fórmula \(\ce{H_2EO_4}) donde E es S o Se. Se denominan ácido sulfuroso y selenioso, respectivamente. ¿Qué oxoácido esperarías que fuera más ácido: el ácido selenoso o el sulfuroso?
Respuesta
El ácido sulfuroso debería ser más ácido. Dado que el azufre es más electronegativo que el selenio el azufre polarizará los enlaces OH en mayor medida, haciéndolos más ácidos. Esta predicción es confirmada por una comparación de los valores \ (pK_a) para los ácidos:
| Ácido | (pK_{a1}) | (pK_{a2}) |
|---|---|---|
| Ácido sulfuroso, \(H_2SO_3\) | 1.85 | 7,2 |
| ácido selénico, \(H_2SeO_3\) | 2,62 | 8,32 |