N2O (oxid dusný) je oxid dusíku a nazývá se směšný plyn. V tomto výukovém programu se dozvíme následující informace o plynném oxidu dusném.
- Jak nakreslit Lewisovu strukturu pro N2O
- Kreslení rezonančních struktur podle Lewisovy struktury
- Oxidační čísla atomů dusíku a kyslíku.
Pokud již znáte lewisovu strukturu N2O, můžete první část tohoto učebního materiálu přeskočit a přejít přímo na část s lewisovou strukturou.
- Lewisova struktura N2O
- Počet elektronů valenční slupky
- Centrální atom N2O
- Náboje na atomech
- Struktura 1
- Struktura 2
- Struktura 3
- Tvar molekuly N2O kolem centrálního atomu
- Rezonanční struktury N2O
- Oxidační stavy, čísla N2O
- Oxidační stav N2O
- Oxidační číslo dusíku v N2O je +1. V reálné situaci je však jeden atom dusíku v oxidačním stavu +2 a druhý atom dusíku je v oxidačním stavu 0. Oxidační číslo kyslíku je -2. Oxidační číslo z rovnice
Lewisova struktura N2O
Při kreslení lewisovy struktury N2O je třeba postupovat v několika krocích. aVšechny jsou v tomto tutoriálu podrobně vysvětleny a začátečník se může naučit základy kreslení lewisovy struktury.
Počet elektronů valenční slupky
Nejprve bychom měli vědět, kolik elektronů valenčních slupek atomů kyslíku a dusíku bude dodáno pro vytvoření molekuly.
Počet elektronů valenční slupky atomu dusíku = 5
Počet atomů dusíku v molekule N2O = 2
Počet elektronů dodaných atomy dusíku = 5*2 = 10
Počet elektronů valenční slupky atomu kyslíku = 6
Celkový počet elektronů dodaných všemi. atomy = 10 + 6 = 16
Počet celkových elektronů odpuzujících párů (součet σ + π + osamělých párů ve valenčních slupkách) = 16/2 = 8
Centrální atom N2O
Obvykle má atom dusíku největší možnost být centrálním atomem než atom kyslíku, protože dusík může vykazovat vyšší valenci než kyslík.
Takže jeden z atomů dusíku se nachází jako středový atom a ostatní atomy jsou rozmístěny kolem něj. Nyní si můžeme představit náčrtek pro N2O a ten je vyobrazen níže.
Náboje na atomech
Při kreslení molekuly bychom měli vždy dbát na to, abychom minimalizovali náboje na atomech, protože když jsou náboje atomů nízké, je stabilita této molekuly velká.
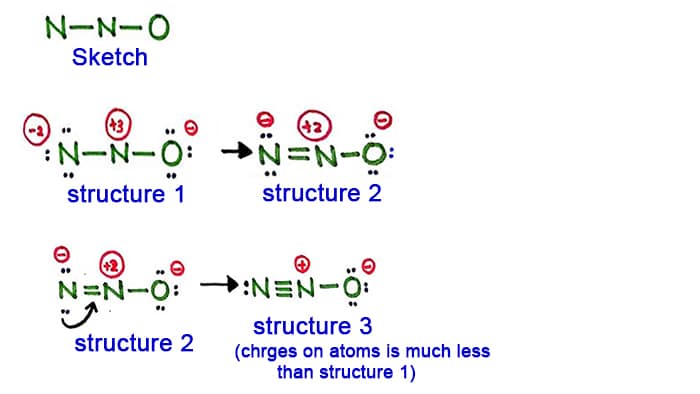
Struktura 1
Podívejte se na strukturu 1, na každém atomu v molekule N2O jsou kladné a náboje. Tato struktura se tedy nejeví jako stabilní struktura. Proto bychom se měli pokusit nakreslit jinou strukturu změnou struktury 1.
Vytvořte novou vazbu přeměnou osamělého páru v bočním atomu dusíku (ne ve středním atomu dusíku).
Struktura 2
Dlouhý pár v atomu dusíku (levá strana) je nyní způsoben vytvořením vazby mezi atomy dusíku. Mezi atomy dusíku tedy nyní vzniká dvojná vazba. Tím se hustota nábojů na atomech sníží.
Ale, jak vidíte, na atomech jsou stále náboje. Zkusme tedy jinou strukturu pro N2O, abychom snížili náboje, pokud je to možné.
Struktura 3
Další dlouhý pár v atomu dusíku (levá strana) je nyní způsoben vytvořením vazby mezi atomy dusíku. Nyní tedy existuje trojná vazbamezi atomy dusíku.
V této struktuře se navíc snižují náboje na atomech. Nyní má středový atom dusíku pouze náboj +1 a atom kyslíku má náboj -1.
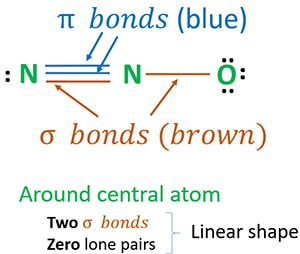
Struktura 3 je nejlepší (nejstabilnější) struktura, kterou můžeme pro N2O nakreslit. Její centrální atom obsahuje kolem sebe
- dvě sigma (σ) vazby
- nulové osamělé páry
Tvar molekuly N2O kolem centrálního atomu
Molekula N2O obsahuje dva atomy dusíku a jeden atom kyslíku. Nejprve bychom se měli pokusit nakreslit nejstabilnější Lewisovu strukturu N2O, abychom mohli rozhodnout o tvaru molekuly N2O.
Počet osamělých párů a počet σ vazeb kolem středového atomu jsou důležité pro zjištění tvaru molekuly.
Díky dvěma vazbám sigma a nulovému počtu osamělých párů kolem středového atomu (dusíku) je tvar molekuly N2O lineární.
K určení nejstabilnější struktury N2O můžeme nakreslit rezonanční struktury N2O. O oxidačních číslech dusíku v N2O rozhodujeme z nejstabilnějších struktur. Nakonec sestavíme tvar molekuly N2O.
Rezonanční struktury N2O
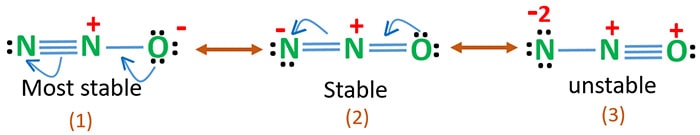
Elektronegativita kyslíku je vyšší než dusíku. To znamená, že záporný náboj na atomu kyslíku je stabilnější než záporný náboj na atomu dusíku. Jinak lze říci, že kyslík má rád elektrony více než dusík.
Struktura 3 je nejnestabilnější rezonance N2O, protože na atomu kyslíku je kladný náboj.
Struktura 2 má určitou stabilitu.
Struktura 1 je nejstabilnější rezonance, protože kyslík má záporný náboj.
Oxidační stavy, čísla N2O
Můžeme vypočítat oxidační stavy N2O pro nejstabilnější rezonanční strukturu.
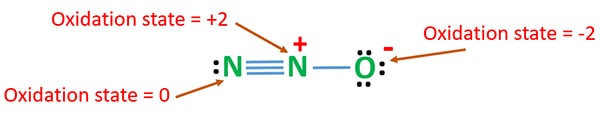
Oxidační stav N2O
Oxidační číslo dusíku v N2O je +1.

Oxidační číslo dusíku v N2O je +1. V reálné situaci je však jeden atom dusíku v oxidačním stavu +2 a druhý atom dusíku je v oxidačním stavu 0. Oxidační číslo kyslíku je -2.
Oxidační číslo z rovnice
Víme, že ve většině případů je oxidační číslo kyslíku -2. V N2O jsou dva atomy dusíku. Vezměme oxidační číslo dusíku x. Celkový náboj molekuly N2O je 0.
Některá oxidační čísla jednotlivých prvků v molekule by měla být rovna nule.