The use and importance of cells and batteries are unquestionable. 日々の生活の中で、私たちは非常に多くの異なる方法で細胞を利用しています。 さて、これまでの数回のコンセプトで、一般的な電池についてすでにご紹介してきました。 しかし、ここではガルバニック電池を徹底的に分析します。 では、さっそく始めましょう。
おすすめ動画
ガルバニ電池
電気化学電池の一種であるガルバニ電池は他の電池と同様に、電気化学的な電池です。 酸化還元反応により電子を移動させ、電流を供給するために使用される。 ガルバニック電池は、いくつかの元素の間の単純な反応を使ってエネルギーを利用できることを示す模範的なアイデアである。 最も簡単な言葉で説明すると、ガルバニック電池は、酸化反応と還元反応が同時に起こる装置として機能するのです。 これらの反応は、化学エネルギーを電気エネルギーに変換するために使用され、あらゆる商業的な目的に利用することができます。
Browse more Topics under Electrochemistry
- 電池
- 電解液のコンダクタンス
- 腐食
- 電気化学セル
- 電解セルと電解
- 燃料電池
- ネルンスト方程式
- 濃度による導電率とモル導電率の変化
の下にあるその他のトピック
ガルバニ電池の働き

ガルバニ電池の働きは非常に単純である。 最終的に電気エネルギーを利用できるようにするための化学反応を伴います。 酸化還元反応の間、ガルバニックセルは電子間のエネルギー移動を利用して、化学エネルギーを電気エネルギーに変換します。
ガルバニックセルは、酸化と還元の過程で電子の流れを分離する能力を利用し、半分反応を引き起こしてそれぞれをワイヤーで接続し、そのワイヤーを通して電子の流れのための道を形成できるようにします。 この電子の流れを、本来は電流という。 このような電流を電線に流して回路を構成し、テレビや時計などの機器に出力することができる。
ガルバニックセルは任意の2つの金属で作ることができる。 この2つの金属は、互いに接触したままにしておくと陽極と陰極を形成することができる。 この組み合わせにより、より陽極的な金属を電解腐食させることができる。 7772>
ガルバニ電池のセットアップ
ガルバニ電池を作るには、次のようなセットアップが必要である。 理想的には2つの電極を持つセルが必要です。 この2つの電極は、ガルバニック電池の2つの重要な構成要素になります。 還元に関する化学反応はカソードで起こり、酸化の半反応はアノードで起こるものとします。 すでに述べたように、化学反応を起こすためにどんな2つの金属でも使うことができます。
ガルバニ電池を例で理解する
化学反応に関わる2つの金属が亜鉛と銅である場合を例にとって説明します。 化学反応が起きると、亜鉛は2個の電子を失うことになります。 これは銅に取り込まれ、元素状銅になります。 この2つの金属は別々の容器に入れられ、導線によって接続されるので、電流が形成され、すべての電子が1つの金属から別の金属に移動します。
同時に、2つの金属は塩溶液、たとえばこの場合は硫酸亜鉛と硫酸銅に浸されるものとします。 この場合、2つの溶液は直接混ぜ合わせるのではなく、ブリッジや媒体を用いて結合させることができます。 この媒体はイオンの移動を担当しますが、2つの溶液が互いに混ざらないようにします。
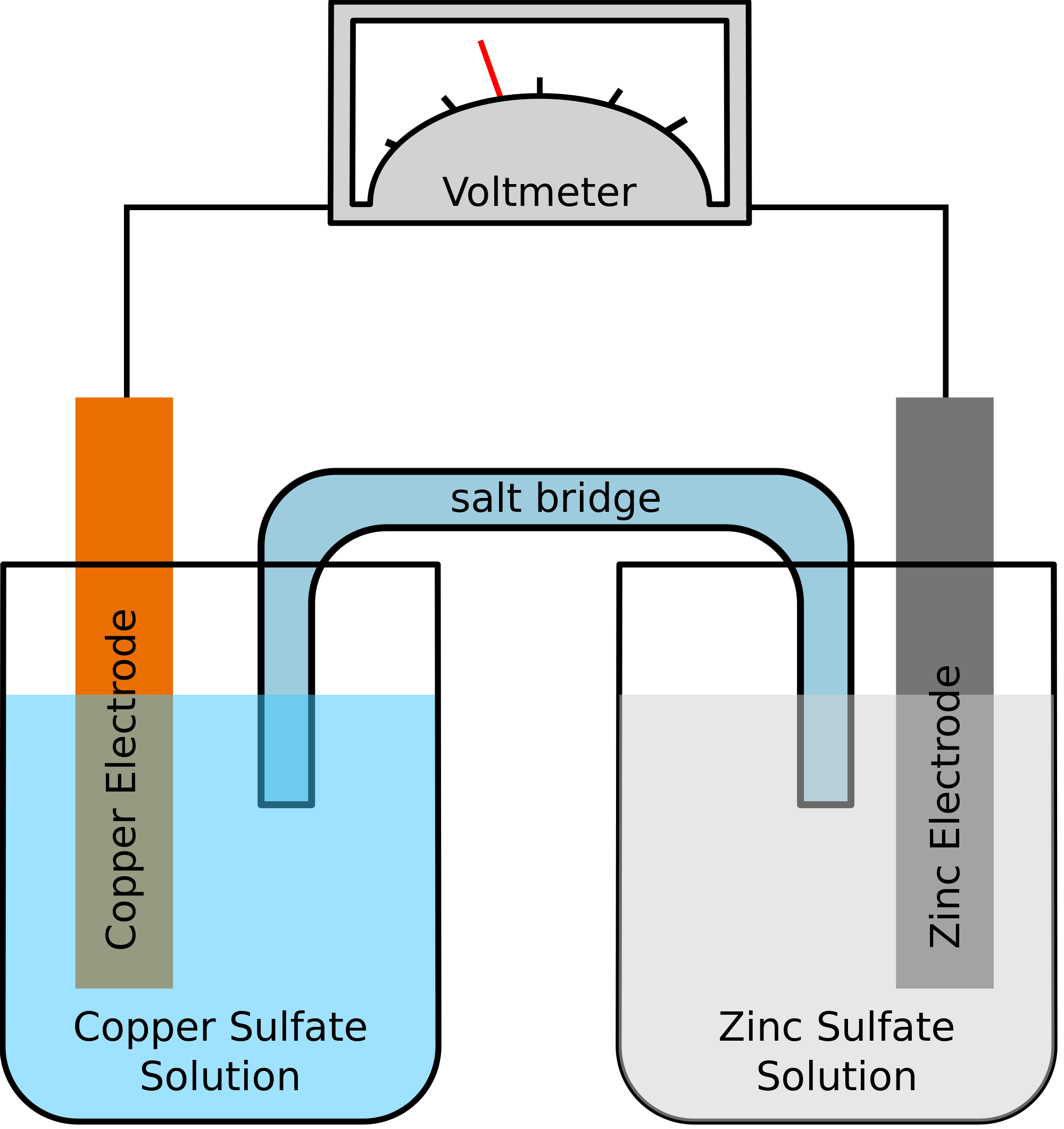
このようなブリッジは、電荷を運ぶための回路の完成に役立ち、また金属の入った容器の溶液が中性のまま、互いに混ざらないようにすることができます。
重要な用語
ガルバニック電池で使用される重要な用語を以下に列挙します:
- 相境界。
- ソルトブリッジ:陰極と陽極として作用する2つの金属を指します。
- 酸化還元反応:酸化還元反応が起こるようにする連結橋または媒体。
Solved Examples for You
Question: 電流を形成しガルバニックセルを流れるようにする化学プロセス。 ガルバニック電池で、酸化還元反応が起こっている間に塩橋を使用しない場合、何が起こるでしょうか。
Solution 金属を入れた各容器内に塩橋がない場合、酸化還元反応はほとんど同じように始まるでしょう。 しかし、塩橋がない場合、同じことが突然終了する。 それぞれの溶液は電気的中性を保つことができなくなる。 これ以外には、塩橋や媒体がないために、化学反応に変化はなく、どのようなタイプの変化もありません。