General Overview
多くの微生物が人間の体内に存在するだけでなく、人間の体内にも生息している。 実際、ヒトの皮膚には、ほとんどが非病原性の細菌、真菌およびウイルスが異種混合で生息しており、おそらく皮膚表面の健康に寄与していると考えられる(図1)。 プロピオニバクテリウム・アクネス(P. acnes)は、顔や首の皮脂腺毛包を含む体の部位全体に存在する、成長が遅く、棒状の、胞子を形成しない、グラム陽性嫌気性菌(図2)です(Funke et al, 1997; Grice and Segre, 2011; Findley and Grice, 2014)。 それはしばしば、新生児期の初期に適応免疫寛容のメカニズムを介して確立されるバリア部位(Cogenら、2008)の我々の常在微生物叢の一部と考えられている(Scharschmidtら、2015)。 皮脂腺部位における嫌気性菌の地形的分布は重要であるが、P. acnesの空間的・個人的分布は部位特異的というより個人特異的である(Oh et al.、2014)。 さらに、健康状態の変化やpH、温度、水分および/または皮脂量の変化も、この微生物が占有するニッチの範囲に影響を与える可能性があるため、P. acnesの生物地理学および個人性は非常に動的である(Griceら、2009年)。 皮膚微生物の分布と同様に、皮膚の状態も、疾患における病原体の拡大という観点から、P. acnesの機能を形成することができる。 例えば、P. acnesは、顔や首の尋常性ざ瘡や背中の進行性斑状過色素症などの皮膚障害に関連している(Bojar and Holland, 2004; Kurokawa et al., 2009; Barnard et al., 2016)。 さらに、P. acnesの特定の疾患関連系統型は、身体インプラントや手術器具に残留する能力を有し、心内膜炎、眼内炎、血管内神経系感染症などの広範囲の術後感染症状態を引き起こす(Perry and Lambert, 2011; Portillo et al, 2013)。 P. acnesの好ましくない特徴は、前立腺にも及び、前立腺上皮細胞および循環マクロファージにおいて、細菌の組織侵襲および細胞内沈着が頻繁に指摘されている。 2006; Alexeyev et al., 2007; Fassi-Fehri et al., 2011; Mak et al., 2012; Bae et al., 2014; Davidsson et al., 2016)があります。 しかしながら、P. acnesが皮膚外への感染、炎症及び/又は転移を誘発するために用いる基礎的なメカニズムが何であるかは、明らかではない。 ある程度確実に知られていることは、細菌に感染したケラチノサイト、皮脂細胞及び/又は脂肪細胞が、いくつかの炎症性ケモカイン及びサイトカイン、並びに抗菌因子(例えば、. Grahamら、2004;Nagyら、2006;Leeら、2010;Zhouら、2015;Sanfordら、2016;Yuら、2016)特定の疾患機構を示唆する。 P.acnesを含む、ヒトのバリア部位に見られる一般的な微生物の模式図である。 P. acnesは、すべての外部および内部表面(すなわち、口腔および胃腸上皮、結膜)に存在するが、ヒトの皮膚に最も多く存在する。 顔や背中の毛包に存在し、一般的な皮膚病である尋常性ざ瘡と関連している。 しかし、その悪質な日和見主義的側面に関する報告も増えてきている。 Bryan Christie Design (http://bryanchristiedesign.com/) から引用し、許可を得ています。
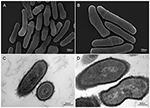
Figure 2.にあるように、P.acnesの皮膚病は、皮膚病である。 P. acnes KPA株の走査型および透過型電子顕微鏡(SEMおよびTEM)画像(A、B=SEM;C、D=TEM)。 近年の分離・培養技術の進歩により、これまで過小評価されてきたP. acnes感染が、この日和見菌に新たな光を当てていることが明らかになりつつある。 顕微鏡撮影:Volker Brinkmann(マックス・プランク感染生物学研究所、ベルリン、ドイツ)。
Sarcoidosis
Sarcoidosis は、肺、肝臓、皮膚、リンパ管など多様な器官に炎症を引き起こす原因不明の疾患である。 サルコイドーシスとP. acnesの関係は、皮膚やリンパ節のサルコイド病変からこの細菌が分離されたときに初めて提唱されました(Eishiら、2002; Yamadaら、2002)。 これらの知見は、有意に裏付けられ(de Brouwer et al., 2015)、HEK293T(ヒト胚性腎臓)およびA549(ヒト肺胞上皮癌)細胞株におけるP. acnesの侵入能力を示す様々なin vitro実験によってさらに拡大した(Tanabe et al., 2006)。 サルコイド気管支肺胞洗浄液(BAL)液および細胞における最も最近の研究は、P. acnes特異的免疫応答の有意なアップレギュレーションを示した(Schupp et al.、2015)。 さらに、マウスを用いた実験では、生存しているP. acnesがサルコイドーシス患者で観察されるものと同様の肺肉芽腫を誘発することが示されています(Werner et al.、2017年)。 サルコイドーシスとP. acnesの間の関連を詳述する一般的な概要は、さらにEishi(2013)によって示されている。
感染中にP. acnesによって活性化されるシグナル伝達経路を特徴付けようとする研究により、免疫および炎症カスケードに関わる遺伝子の発現を制御する転写因子、nuclear factor-kappaB が、P. acnesによって活性化することが分かった(Kimら、2002年)。 より広範には、Toll-like receptor 2 (TLR2) がP. acnesに対するNF-κB依存性の反応に重要な受容体であることが示され、この細菌が自然免疫遺伝子の選択的活性化を引き起こす能力があることが明らかになりました (Inohara and Nuñez, 2001; Chamaillard et al., 2003; Moreira and Zamboni, 2012)。 さらに、P. acnes感染と関連するサルコイドーシス症例において、宿主遺伝学の役割について検討した。 52の間質性肺炎を有するサルコイドーシス患者73人と健常対照者215人において、タンパク質NOD1およびNOD2のヌクレオチド結合オリゴマー化ドメイン(NOD)における一塩基多型(SNPs)がP. acnes感染と相関した(Tanabe et al, 2006)。 NOD1 と NOD2 は、ペプチドグリカンなどの細菌分子を感知する細胞内パターン認識受容体である。 これと同様に、P. acnesがHEK293T細胞に内在化すると、NOD1およびNOD2が活性化することがin vitroの実験で示されており、慢性炎症あるいは局所の免疫抑制に基づく疾患メカニズムが示唆されている(Tanabe et al.、2006年)。 また、これらの知見は、侵襲性P. acnesが細菌のリガンドとして作用し、サルコイドーシスに対する感受性が長期間持続する特定の個体に異常なNOD受容体活性化を引き起こす可能性を示唆するものである。
侵襲性P. acnesはサルコイドーシスや他の疾患の病因である可能性があるが、P. acnesとの因果関係や相関関係を明らかにすることはできない。
Benign Prostate Hyperplasia (BPH) and Prostate Cancer
慢性または再発性の炎症プロセスがBPHおよび前立腺がんの進行に長く関与しています(De Marzo et al.著「BPHと前立腺がん」)。 1999; Nelsonら、2004; Sfanosら、2014)。 炎症は、インターロイキン(IL)-6、腫瘍壊死因子α(TNFα)および急性期タンパク質、C反応性タンパク質(Mecherguiら、2009;Menschikowskiら、2013;Yuら、2015)の上昇などの特定のバイオマーカーの存在に帰結する。 前立腺生検だけでなく、泌尿器科液(すなわち、尿、精液、前立腺分泌物)についての最近の研究は、診断指標として使用され得る特定の微生物種への著しい条件シフトを示唆している(Yuら、2015;Niら、, 2016)。
かなりの量の研究が、P. acnesの前立腺との特異的な関連、特に前立腺上皮細胞への侵入(図3)が、炎症成分を有するBPHまたは前立腺がんの病態に寄与し得ることを示唆している(Sfanosら、2013; Davidssonら、2016)。 しかしながら、P. acnesが前立腺の真の感染性物質、常在菌、または偶発的な前立腺微生物群を表すかどうかは、現在のところ不明である。 前立腺に位置するP. acnesが、例えば前立腺生検中に誤って導入された皮膚に由来することはもっともらしいが、この視点は特定の診断ワークアップシナリオに懸念をもたらすはずだ」
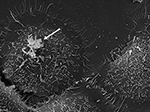
FIGURE 3. 培養前立腺上皮細胞RWPE1に対するP. acnes株P6(矢印)のin vitroでのSEM。 P. acnes の前立腺上皮細胞侵入挙動は、in vivo および細胞ベースの研究の両方において、ビメンチンを介した侵入プロセスの可能性が高いことがよく立証されている (Mak et al., 2012)。 顕微鏡撮影:Volker Brinkmann, Max Planck Institute for Infection Biology, Berlin, Germany. スケールバー=2μm.
侵入経路または病原性が何であれ、BPHの経尿道切除、または癌の根治的前立腺切除によって得られた相当数の前立腺組織が、遊走マクロファージ内に明らかに存在するP. acnes凝集体に対して以前に陽性であった(アレクシエフら、2007;ベーら、2014)。 ヒト試料に基づく追加の報告は、培養、細菌の可視化のための共焦点顕微鏡およびin situハイブリダイゼーション、免疫組織化学(図4)および細菌16S rRNAのPCRベースのプロファイリングを含む種々の技術的アプローチを用いて、BPHまたは前立腺癌とP. acnesとの間の関連についてのさらなる証拠を提供している(Hochreiterら、2000;Cohenら、2005;Sfanosら、2008;Fassi-Fehriら、2011;Baeら、2014;Davidssonら、2016)。 さらなる証拠は、マウスまたはラットの前立腺および膀胱へのP. acnesの接種が、前立腺内の明白な、長期の炎症反応および広範囲の細胞障害をもたらすことを示す動物研究から得られる(Olssonら、2012;Shinoharaら、2013)
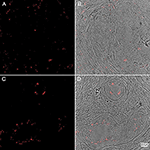
FIGURE 4. P. acnes抗体(赤色)で染色したヒト前立腺組織サンプルの免疫組織化学。 Fassi-Fehri et al., 2011(補足図2B)からの許可を得て引用した。 前立腺肥大症(A,B)、または前立腺腺癌(C,D)のヒト前立腺組織サンプルにおけるP. acnesの存在。 いずれの場合も広範な細菌負荷が検出された。
癌性前立腺腺からの疾患関連P. acnes株を系統的に分析する試みは、ほとんどの前立腺分離株がヒト皮膚ではまれな系統群に属することを明らかにし、サンプリング中の皮膚由来の汚染はあり得ないことを示している(Mcら、2013; Davidssonら、2016)。 同じラインに沿って、NF-κB、IL-6、STAT3及びCOX2を含むサルコイドーシスについて記載されたものと同様の炎症経路が、in situ及びin vitro条件の両方においてP. acnesによって活性化されるように見える(Drottら、2010; Fassi-Fehriら、2011; Makら、2013; Tsaiら、2013; Baeら、2014)。 これらの炎症性変化の正確な病因はまだ明らかではないが、いくつかの膜結合型パターン認識受容体経路が、細菌およびウイルス成分を熱心に認識する哺乳類の尿および生殖器系に広く分布している(Jorgensen and Seed, 2012; Gambara et al, 2013)。 これらの宿主細胞受容体、例えばTLRは、微生物病原体に対する自然免疫の中核的な特徴であるサイトカイン産生を促進します。
Spondylodiscitis and Back Pain
P. acnes が関与するいくつかの術後合併症の1つは、椎間板切除術後の椎間板および周囲の椎間スペースの炎症(椎間板炎)です(Harris et al.、2005)。 隣接する椎骨の変性感染(脊椎円板炎)を併発することもあり、治療が遅れると深刻な神経障害や痛みの根本原因となる(Uçkayら、2010)。 意図せず外科手術で脊椎に侵入する以外に、動脈および静脈の脊髄血液供給を通じて病原体が侵入することもある(血行性伝播)。 黄色ブドウ球菌、大腸菌、プロテウス菌が最もよく分離されるが、P. acnesはこの文脈では最も豊富な嫌気性病原体で、培養の難しさゆえに報告されていない可能性が高い。 一般的に嫌気性病原体、特にP. acnesに感染した核(髄核)ディスクヘルニア患者は、隣接する椎骨の炎症と浮腫(Modic changes type I)および腰痛を発症しやすいという臨床エビデンスもある(Albertら、2013年、Urquhartら、2015年)。 現在、臨床および動物ベースの追跡調査により、局所的なP. acnesの増殖がModic変化と一致する炎症マーカーのアップレギュレーションおよびディスク変性を引き起こすという最初の知見が裏付けられつつあります(Aghazadehら、2016; Dudliら、2016)。 P. acnes及び/又はStaphylococcus epidermidisによる椎間板の細菌感染が、ディスクヘルニア及び関連する病理学的変化の根本原因として他の全ての問題に実際に先行する可能性を示唆する最初の臨床証拠さえ現在存在する(Rajasekaran et al, 2017)。
パーキンソン病(PD)
変性する脳は、特発性PDで明確に記録されているように、変異タンパク質またはミスフォールドしたタンパク質(例えば、レビー小体とレビー神経突起)の異型凝集と堆積に起因すると考えられる神経系損傷によって特徴づけられる(Taylor et al.、2002年)。 一般にあまり理解されていないが、脳はウイルスやバクテリアから真菌に至るまで、様々な病原体の侵入を受けやすい。 これらの病原体、またはより具体的にはそれらの内因性成分および/または代謝産物は、慢性的な再発性感染に起因する認知症およびジストニアの微妙な兆候(De Chiaraら、2012;Bibiら、2014)から、例えばヒト内因性レトロウイルスK(Liら、2015)で観察されるより重度の運動ニューロン疾患まで、中枢神経障害を生じさせる可能性がある。 このように、ヒトは微生物の全身的負担がとてつもなく大きいことは明らかであり(Potgieter et al., 2015; Spadoni et al., 2015)、それが付随的に非定型タンパク質成分を有する進行性神経変性疾患の病態に寄与している可能性があります。 確かに、認知、感情または病理学的行動は、腸-脳軸(図5)を介して作用する微生物の空間的および個人的分布によって間接的に影響を受けるように見えるので、この作業仮説はかなりの支持を得ている(Collinsら、2012、Dinanら、2013、Mayerら、2014、Burokasら、2015)。 実際、最近の症例対照研究では、個人間および個人内の消化管における微生物の変動が、PDの表現型の変動に最も有意に対応することが示された(Scheperjansら、2015年;Vizcarraら、2015年)。 微生物叢の組成とPDの差異を結びつける根本的なメカニズムは明らかではないが、上記の知見は、少なくともPD患者に見られる消化管異常の高い有病率を説明するかもしれない(Dobbsら、2016年)。 微生物叢とPDの重症度をさらに関連付けると、PD患者から採取したS状結腸粘膜生検と糞便材料は、慢性便秘、過敏性腸症候群および潰瘍性大腸炎をしばしば引き起こす日和見および炎症性細菌種の存在を示した(Keshavarzianら、2015年)。 集合的に、これらの最初の結果は、腸内の異なる微生物コミュニティ間の関係がPDにおける共通の併存症であり、腸内生態系のユニークな個々のシグネチャーがPDの古典的な運動障害を強化し得ることを示唆している」
FIGURE 5. 一端が微生物で満たされた消化器系、他端が恒常性維持中枢(視床下部と下垂体)のある脳である腸脳軸の模式図(色付けあり)。 両者は迷走神経(脳神経X)を含む循環器系と自律神経系を介してつながっており、微生物の中枢神経系(CNS)への移行を促進する可能性がある。 Bryan Christie Design (http://bryanchristiedesign.com/) の許可を得て掲載しています。
このような背景から、問うべきは P. acnes が PD の病態生理に何らかの役割を果たすという証拠があるのかどうかということである。 この可能性があるためには、2つの条件が満たされていなければならない。 (1)P.acnesの感染が、震え、運動開始、動作緩慢などの古典的な疾患の症状の発生に先立っていること、(2)P.acnesの接種によってPDの症状が十分に誘発され、かつ/または黒質傍核と呼ばれる中脳核におけるドーパミン投射ニューロンの喪失に至ることである。 これまでのところ、我々の研究室では、剖検したPDの脳の中脳とその近くの皮質構造の神経細胞に限局したP. acnesのクラスターを検出している(図6)。 この予想外の発見により、サルコイドーシスやBPHで見られるような局所的な炎症にP. acnesが間接的に寄与していることの信憑性がさらに高まったと言える。 未解決の問題は、P. acnesが間接的にPDの特定の病的特徴を増強する可能性がどの程度あるかである。 PDは非常に異質な疾患であるため、1つの疾患メカニズムがすべてのPDの表現型に当てはまるとは考えにくい。 それにもかかわらず、皮膚常在菌が炎症および/または遺伝的素因を通じて PD の進行を開始または増幅する可能性があると推測するのは興味深いことである。 ヒトPD中脳組織サンプルのP. acnes(緑;A+B)、神経細胞微小管(MAP2;赤;A)および核(DAPI;青;A+B)を染色した免疫組織化学的染色。 加齢に伴うリポフスチン蛍光はSudan Black Bで消した。ヒト神経細胞のペリプラズム空間における核(n)と細胞骨格の間のアクネ菌(矢印)の存在(A)、または中脳毛細管内の特徴的な多葉状核を持つ好中球(B)(CAP)。 これらの所見はPDに典型的であり、ほとんどの対照区間では見られない。
P. acnes が中脳のドーパミン細胞にアクセスできるとすれば、その接種および感染の最も可能性の高い経路は何であろうか。 皮膚は物理的に脳と区分されているが、交差接種は依然として危険因子である。 例えば、鼻腔には病原性のP. acnes株が潜んでいる可能性があり、それが脳実質に移動してミクログリアと呼ばれる局所マクロファージを過活性化させるという現象は、PD病理の一貫した特徴です(Chaoら、2014の総説)。 院内感染の研究では、肺炎球菌(Zwijnenburgら、2001)およびサルモネラ菌(Bollenら、2008)といった多様な細菌種が、嗅神経(脳神経1;CN1)に沿って容易に移動し、最終的に嗅球に入ることが実証されています。 有害な微生物や危険なミスフォールドタンパク質のもう一つの侵入経路は、迷走神経(脳神経10;CN10)である。 実際、ある状況下では、レビー小体およびレビー神経突起の形態のミスフォールドした凝集体が迷走神経から脳へ移動するようであり、毒性タンパク質と関連した病原性細菌が、選択的な神経細胞の脆弱性に寄与する可能性があるというさらなる証拠を提供している(Holmqvist et al.、2014)。 興味深いことに、CN 1およびCN 10の脳核は、PD進行の過程でレビー小体およびレビー神経突起の沈着を優先的に示す最初の部位の一つである(Braakら、2004年)。 この特別な観察は、脳への細菌の入り口と思われるルートを強調するだけでなく、切断迷走神経切断がPDリスクを有意に減少させるという観察に潜在的なメカニズムを提供します(Svenssonら、2015年)。 頭部外傷とPDとの間の関連(Harrisら、2013;Jafariら、2013;Pearceら、2015)は、多様な血液マイクロバイオームの概念(Potgieterら、2015)とともに、血液脳関門の外傷性破壊が発生すると、病原性日和見主義の膨大な可能性を意味する。
これらを総合すると、PDの発生率または重症度に影響を及ぼす独立変数としてP. acnesを間接的に関与させる前臨床およびいくつかの臨床的証拠が存在する。 この証拠は、重度の皮膚疾患である逆性痤瘡とアルツハイマー病を関連付ける報告によって補完されている(Wang et al.) 治療の観点からは、P. acnesがPDの中核的な特徴を促進または増幅する可能性は、神経変性疾患に対する抗生物質のアプローチにとって重要な資源となる。 また、研究の観点からは、皮膚疾患を持つ患者をより詳細に調べ、より早い発症とより重篤な疾患表現型の神経病理学の証拠を得ることは価値があるだろう。
Future Outlook
この論文で紹介したレビューでは、病理に関してP. acnesの予想外のダークサイドを概説した。 P. acnesの細胞内残留は、肺や前立腺の疾患、そしておそらく脳の疾患に関与している。 これは、特定の疾患表現型における皮膚由来細菌の病原性を明確に証明するものである。 今後、P. acnesの生物学におけるいくつかの疑問に焦点を当てた研究が必要であろう。 (1)疾患感受性におけるP. acnesの重要な相互作用は何か? (2) 疾患の進行に影響を与えるP. acnesのメカニズムとは何か? (3) もしP. acnesのある集団が疾患の重症化に対する感受性を高めることができるなら、P. acnesの他の構成が保護的であるのか? (4) P. acnes感染が疾患の病態に直接関連するという概念の証明、より具体的には、概念の研究は因果関係を示すのか、それとも単なる相関関係を示すのか? (5)P.acnesが引き起こす疾患病態を従来の抗生物質治療や診断薬で治療できるのか。
Author Contributions
JL, KER, JC, KR, CH, AM, HB, and GT wrote the manuscript prepared.
Funding
JLへの学内資金はNYIT College of Osteopathic Medicineから提供された。
Conflict of Interest Statement
著者は、本研究が利益相反となりうるいかなる商業または金銭的関係からも解放されて行われたと宣言している。