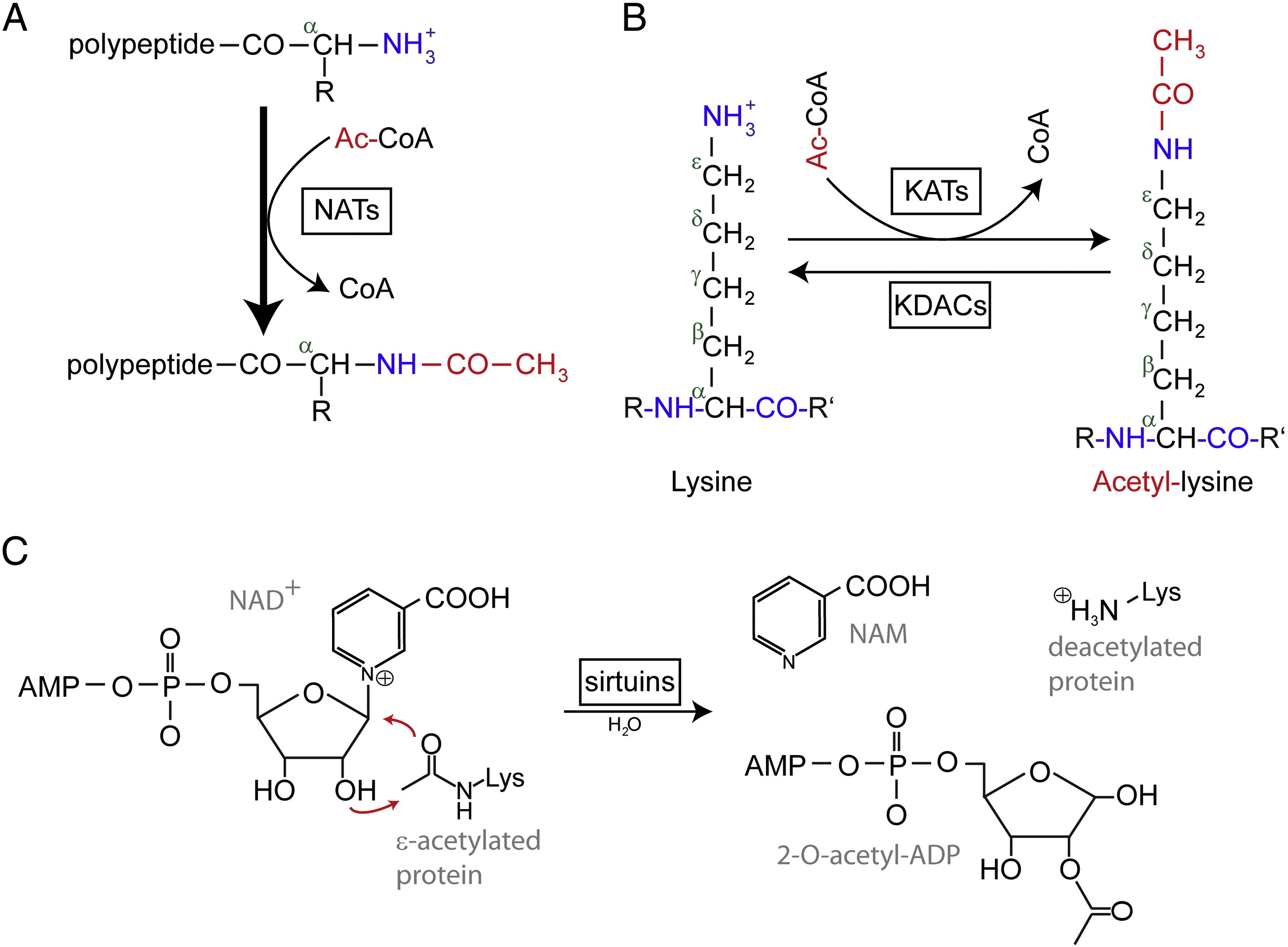
アセチル化とは、化合物にアセチル官能基を導入する反応のことで、水酸基の水素原子をアセチル基(CH3 CO)に置換して特定のエステルとすることで、アセテートを得ることができます。 タンパク質のアセチル化には、一般に2種類の形態がある。 ヒトでは、ほとんど(80%-90%)のタンパク質が、新生ポリペプチド鎖のNα-末端で共翻訳的にアセチル化される。 426>
N末端アセチル化
N末端アセチル化はNt-アセチルトランスフェラーゼ(NAT)によって触媒され、これまでのところ不可逆であることが判明している。 NATは、触媒サブユニットと最大2つの補助サブユニットからなるモノまたはマルチサブユニット酵素で、アセチル-コエンザイムA(Ac-CoA)からタンパク質の第一アミノ酸残基のα-アミノ基へアセチル基を転移することができます。 NATでは、主要な補助サブユニットが触媒サブユニットの活性と基質特異性を調節している。 Ntのアセチル化には、異なるNATが関与している。 ヒトでは、これまでにNatA, NatB, NatC, NatD, NatE, NatFの6種類のNATが見つかっている。 NATはサブユニット組成の違いに加え、基質特異性にも違いがある
Ntのアセチル化は分子作用において異なる役割を担っている。 まず、Ntアセチル化によって特定のタンパク質の細胞内局在が決定される。 例えば、Arl3やGrh1などのゴルジ体関連タンパク質は、Nt-acetyl基を欠くとゴルジ体に結合できない。 次に、Nt-アセチル化はタンパク質を細胞質で拘束し、翻訳後の小胞体や分泌経路への移行を抑制することが報告されている。 また、Ntアセチル化によってN末端の性質が変化し、タンパク質間相互作用が調節されるようになる。 いくつかのタンパク質では、Ntアセチル化によって結合相手との親和性が増大することが示されている。 例えば、E2ユビキチン結合酵素であるUbc12は、NatCによってNt-アセチル化を受けると、その相互作用パートナーであるE3ユビキチンリガーゼDcn1に対する親和性が増加することが示された。 さらに、Nt-アセチル化はタンパク質の品質と寿命を制御し、N末端ルール経路によってタンパク質の化学量を調節している
N末端アセチル化は生理的に多くの機能を持っている。 NATは正常な発生、骨や血管の発達に不可欠である。 N末端アセチル化は、血圧、プロテアソーム局在、ホルモン、オルガネラの構造と機能を制御することができる。 ヒトの疾患では、神経変性疾患(アルツハイマー病、パーキンソン病、レビー小体型認知症など)、癌(肺癌、乳癌、大腸癌など)に関連していることが知られている。 しかし、リジンのアセチル化はヒストンだけにとどまらない。 リジンアセチル化はNtアセチル化とは異なり、可逆的である。 アセチル化はリジンアセチルトランスフェラーゼ(KAT)、リジン残基の脱アセチル化はリジンデアセチラーゼ(KDAC)によって触媒される。
ヒトゲノム上には17-22のKAT遺伝子が同定されており(正確な数は不明)、GCN5(general control non-derepressible 5)関連アセチルトランスフェラーゼ(GNAT)ファミリー、MYSTファミリー、p300/CBP(CREB binding protein)ファミリーの3つに分類されることが報告されている。 KAT複合体の基質としては、ヒストン蛋白質だけでなく、いくつかの異なる転写因子、転写共調節因子、そしてp53、β-カテニン、NF-κB、MyoD、Rbなどの特定の細胞内シグナル伝達経路の蛋白質が知られています。 また、RNA分子でさえもアセチル化されることがある。 KDACには、クラスI、II、III、IVの4つのタイプがある。 クラスI、II、IVはZn2 +依存性アミド加水分解酵素であり、クラスIII(サーチュインとも呼ばれる)はNAD+を共基質として触媒活性を発揮するZn2 +依存性アミド加水分解酵素である
ヒストンは最初に見つかったアセチル化タンパク質である。 ヒストン分子はリン酸化、メチル化、アセチル化などの修飾を受けており、ヒストンのアセチル化はヒストンの集合、DNA-ヒストン相互作用の折りたたみやコンパクトさを決定し、クロマチン構造の寛容と抑制の切り替えをもたらすと考えられている。 ヒストンだけでなく、細胞骨格タンパク質も触媒することができる。 また、HMGタンパク質、c-Myc、エストロゲン受容体、アンドロゲン受容体、E2F/Rbなど、他のタンパク質においてもアセチル化部位が新たに同定されている。 ヒストン蛋白は、転写、複製、組換え、修復、翻訳、特殊なクロマチン構造の形成など、DNAを介したあらゆるプロセスに密接に関連している。 したがって、タンパク質リジンアセチル化は、代謝、ストレス応答、アポトーシス、膜輸送と同様に、さまざまな細胞シグナル伝達経路に影響を及ぼします。 質量分析計の発達により、リジンアセチル化の同定や定量を行う重要なツールとなってきている。 ヒストンのリジンアセチル化を解析するためには、細胞ライセート、ヒストンの抽出、ヒストンの分離、質量分析、データ解析などいくつかのステップが必要である。 全細胞からのタンパク質のリジンアセチル化の解析には、細胞溶解液、タンパク質分離、リジンアセチル化ペプチドの濃縮、リジンアセチル化ペプチドの分離、質量分析、データ解析のステップがある
。