高齢者や高血圧、糖尿病、心臓病などの合併症を持つ患者は、COVID-19の危険にさらされます。1 抗糸球体基底膜疾患(抗GBM)は、急速に進行する糸球体腎炎と肺胞出血を特徴とする自己免疫疾患です2。 非造影胸部CTで肺胞出血を認め、肺炎が疑われた。 呼吸器系病原菌の鼻咽頭スワップ、COVID-19のPCRを行ったが、陽性は得られなかった。 ANA、ANCAは陰性、C3、C4値も正常であった。 腎生検では,限局性壊死性毛細血管外増殖性糸球体腎炎と急性尿細管間質性腎炎を認めた. 免疫蛍光顕微鏡で糸球体基底膜に沿った線状のIgGの存在を確認した。 抗GBM抗体病と診断し,薬物反応の可能性を指摘した(図1)。
糸球体にフィブリノイド壊死のあるもの(A、ヘマトキシリン・エオジン)、銀染色(B、ジョーンズ・メテナミン銀)でピンク色のargyrophobic領域として見ることができるフィブリノイド壊死のある別の糸球体。 部分的に細胞の三日月形成が見られる糸球体(C、ヘマトキシリン・エオジン染色)、ボーマン腔を満たす広範な毛細管外増殖と赤血球の鋳型で満たされた尿細管の一部が見られる別の糸球体(D、ヘマトキシリン・エオジン染色)。 好酸球の多い間質性炎症を伴う(E, ヘマトキシリン-エオジン染色)。 免疫蛍光顕微鏡で糸球体基底膜に沿ってlineer IgGを認める(F).
500mgのmetyprednisolone(mps)3日間静注と500mg週1回のcyclophosphamide治療開始した. 退院後3日目に頻呼吸と喀血で救急受診。 集中治療室に入院した。 コントロールの胸部CTでは前回と同様の所見を示した(図2)
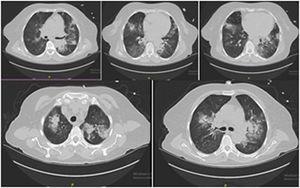
胸部CTで抗GBM病変を認めたが、随伴感染を否定できなかった。
コビッド19流行時の入院歴とCT所見を考慮してコビッド19の対照PCRを送付し陽性と報告された。 リンパ球減少を伴う白血球増加、急性期反応高値を認めた。
ヒドロキシクロロキンとアジスロマイシンの併用療法を開始した。 治療5日目には挿管を余儀なくされ、バソプレッサーによる治療が開始された。 COVID-19の耐性化により,ファビプラビルと免疫グロブリン静注を追加した。
本例は,免疫抑制療法下でCOVID-19感染症を発症し,短期間で死亡した抗GBM症患者を対象とした報告である。 免疫抑制療法は,理論的には感染症の経過を複雑にする可能性があるが3,免疫抑制療法中の患者においてCOVID-19感染症の合併症が増加したという確固たる証拠はない4-6。しかし,抗GBM病のような特定の疾患に対する免疫抑制がCOVID-19感染症に対して有害であることを完全に否定することは不可能である。 COVID-19のPCR検査は,約30%の患者が初回偽陰性を示すなど,完全とは言い難い。7 このことは,免疫抑制を必要とする別の診断を受けている,あるいはその可能性がありながらCOVID-19感染の特徴を有する患者に遭遇した場合,臨床医のジレンマとなる。 この患者の場合,初回のPCRでCOVID-19が陰性であったこと,抗菌薬治療が速やかに奏効したこと,対照CT画像で進行が認められなかったことから,初回入院時にはCOVID-19を除外した. しかし,2回目の入院時に症状が悪化したため,過去に同じ病棟でCOVID-19陽性患者の入院歴があることと,重度のリンパ球減少を考慮して,COVID-19のPCR検査を再度依頼したところ陽性と判定された. しかし,もう一つ考慮すべき点は,COVID-19感染による腎臓への直接的な病原性の可能性である. 抗GBM病は感染性の誘因となることが知られており,インフルエンザの流行と同時にミニエピデミックを示すことがある。8-9 最初のPCR検査で患者が偽陰性になるという報告を考慮すると,COVID-19が抗GBM病の原因因子となる可能性がある。 しかし、COVID-19感染者26例の死後腎生検所見を検討した中国の研究では、抗GBM腎症の可能性を示唆する壊死性毛細管外増殖性糸球体腎炎を認めた症例はなかった(10)。 6830>倫理的承認<7550>本論文には、著者らによるヒトを対象とした試験や動物を用いた試験は含まれていない。
インフォームドコンセント
症例報告に記載された患者は死亡したため、その娘から掲載の承諾を得た
資金
この研究は、公的、営利、非営利のいずれの分野の助成機関からも特定の助成を受けていない
利益相反
著者は、利益相反がないことを宣言している
。