
トマトジュースの入った円筒に塩素ガスをバブリングすると、塩素とトマトジュースの混合物は5分以内にほとんど真っ白になってしまう。 この驚くべき変化は、酸化漂白剤として働く塩素が、トマトジュースの色素に化学的作用を及ぼした結果である。 また、経年変化や光によって変色した新聞の切り抜きを、1%の水素化ホウ素ナトリウム水溶液で処理すると、20分以内に劇的に白くなる。 この例では、還元性漂白剤として作用する水素化ホウ素ナトリウムの働きで、紙が元の白さに戻っているのです。
漂白剤とは、他の物質を白くしたり、脱色したりすることができる物質です。 着色物質は一般に発色団と呼ばれる原子団を含み、特定の特徴的な波長を持つ可視光を吸収し、吸収されなかった光の部分を反射または透過させることができる。 例えば、発色団が青色の光を吸収すると、その補色の光を反射し、発色団を含む物質は黄色に見える。 漂白剤は、これらの吸収基を酸化または還元することにより、発色団を本質的に破壊する(それによって色を除去する)。 したがって、漂白剤は、酸化剤または還元剤のいずれかに分類されます。
漂白剤の用途のいくつかは以下の通りである。
- 織物の漂白
- 木材パルプの漂白
- 汚れの除去
- 商業および家庭洗濯・クリーニング
- 精練洗浄剤および食器洗浄剤の成分として
- 毛髪の漂白
酸化性漂白剤
多くの酸化性漂白剤が、Jules A.によってレビューされている。 SzilardがBleaching Agents and Techniques (1973)の中でレビューしています。 今日、一般に使用されている酸化性漂白剤(および漂白剤)は、塩素、二酸化塩素、アルカリ性次亜塩素酸塩、過酸化水素、過酸素化合物、および日光と人工光である。
塩素(Cl 2 )。 1774年、スウェーデンの化学者カール・ヴィルヘルム・シーレによる塩素の発見が、近代的な漂白の始まりとなった。 Sidney M. Edelsteinが1948年に発表した「The Role of Chemistry in the Development of Dyeing and Bleaching」という雑誌の記事によると、フランスの化学者Claude-Louis Bertholletが初めて塩素を使って綿や麻の布を漂白したとのことです。
塩素は木材パルプの漂白にも使われた。 クラフトパルプを使用する多くのパルプ工場では、塩化ナトリウムの濃縮水溶液である食塩水の電気分解によって、木材チップの消化に必要な水酸化ナトリウムを工場内で調合している。
2NaCl + 2H 2 O → 2NaOH + H 2 + Cl 2 (1)
塩素は副生成物である。 その後、褐色パルプを塩素漂白すると、筆記用紙や印刷用紙の製造に使用できる製品が得られる。 残念ながら、パルプ中の有機化合物は酸化され塩素化されるため、
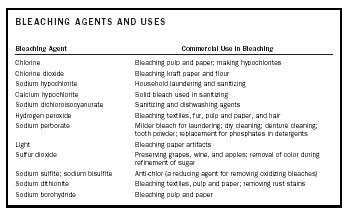
| 漂白剤とその用途 | |
| 漂白剤 | 商業的用途 |
| 塩素 〈1899> 〈5434〉 パルプおよび紙を漂白すること。 次亜塩素酸塩の製造 | |
| 二酸化塩素 | クラフト紙、小麦粉の漂白 |
| 次亜塩素酸ソーダ | 家庭洗濯・除菌 |
| カリウム 次亜塩素酸塩 | 除菌に用いる固体漂白剤 |
| ジクロロイソシアヌレートナトリウム | 除菌・食器洗浄剤 |
| 過酸化水素 | テキストの漂白剤, 毛皮、紙パルプ、毛髪 |
| 過ホウ酸ナトリウム | 洗濯用マイルドブリーチ剤。 ドライクリーニング;義歯洗浄;歯磨剤;洗剤のリン酸塩の代替品 |
| ライト | 紙器類の漂白 |
| 二酸化硫黄 | ぶどう・ワイン・りんご類の保存、砂糖精製の際の着色除去 |
| 亜硫酸ナトリウム | |
| 亜硫酸ナトリウム | |
| アンチクロル(酸化性漂白剤を除去するための還元剤) | |
| ジチオン酸ナトリウム | 織物、パルプおよび紙の漂白剤。 サビ汚れ除去 |
| 水酸化ホウ素ナトリウム | パルプおよび紙の漂白 |
ダイオキシン類。 実際、パルプの漂白工程で最も多く発生するダイオキシン、2,3,7,8-tetrachlorodibenzo-p -dioxin (2,3,7,8-TCDD) は、発がん性と猛毒の両方を持つことが判明しています 。 そのため、漂白剤としての塩素は、より安全性の高い二酸化塩素や過酸化水素に置き換わりつつある。 実際、紙パルプ業界では、TCF(Total Chlorine Free)漂白が主流となっている。 現在、漂白業界では、塩素は主に次亜塩素酸塩溶液や次亜塩素酸カルシウムなどの乾式漂白剤を調製するために使用されています。
二酸化塩素(ClO 2 ). 二酸化塩素は気相および水溶液の両方で漂白剤として使用されてきた。 爆発性があるため、気相の二酸化塩素は窒素や二酸化炭素で希釈されることが多い。 貯蔵・出荷する場合は、二酸化塩素を冷水に通し、冷蔵で保管する。
二酸化塩素は、工業的には水溶液中の二酸化硫黄による塩素酸ナトリウムの還元によって調製される。
2NaClO 3 + SO 2 + H 2 SO 4 → 2ClO 2 + 2NaHSO 4 (2)
ClO 2を比較的安全に調製する方法として、亜塩素酸ナトリウム (NaClO 2 ) とホルムアルデヒド (H 2 CO) を反応させる方法がある。
H 2 CO + H + + ClO 2 – → HOCl + HCOOH (3)
3 の反応が進むと、溶液のpHが下がる(蟻酸が生成するため)。 溶液の酸性度が上がると、式4で示されるClO 2の生成が促進される。
HCOOH + HOCl + 2ClO 2 – → 2ClO 2 + Cl – + H 2 O + HCOO – (4)
酸性溶液中では二酸化塩素は酸化剤として作用する。 ClO 2の完全な還元は式5のようになる。
ClO 2 + 4H + + 5 e – → Cl – + 2H 2 O (5)
この全体の還元反応の各段階では、HClO 2, HOCl, Cl 2が生成し、これらはすべて酸化剤として作用する。 Cl 2 はアルカリ性溶液では式6のように不均化するので、酸性媒体が必要である。
2ClO 2 + 2OH – → ClO 3 – + ClO 2 – + H 2 O (6)
二酸化塩素は主にパルプ漂白に使用されます。
次亜塩素酸塩(OCl – )。 次亜塩素酸塩漂白液はNaOClと、より少ない量ではあるがCa(OCl) 2から作られる。 次亜塩素酸塩は洗濯、殺菌、パルプや繊維の漂白、古紙からのインク除去などに用いられる。 市販の漂白液は、式7に示すように、冷えた希薄な水酸化ナトリウム水溶液に塩素ガスを通過させることによって得られる。
Cl 2 + 2OH – → OCl – + Cl – + H 2 O (7)
また、次亜塩素酸イオンは有機窒素-塩素化合物の加水分解で生成することもできる。 この方法で使用されるより重要な窒素-塩素化合物には、塩素化イソシアヌレートがある。 これらは、クレンジングや食器洗い機製品に使用されています。
効果的な漂白剤とするためには、次亜塩素酸塩溶液をアルカリ性(pH > 9.0)に保ち、OCl -(式8参照)の加水分解を抑制し、不安定なHOClの生成を防ぐ必要がある。
OCl – + H 2 O → HOCl + OH – (8)
酸性溶液中ではHOClが生成し分解される。
3HOCl → HClO 3 + 2HCl (9)
HOClは分解生成物の1つであるHClとも反応する。
HOCl + HCl → H 2 O + Cl 2 (10)
次亜塩素酸塩漂白液は重金属カチオンを含んでいてはならない。これらのカチオンは式11に示すように(光や熱と同様に)HOClの分解を促進するためである。
2HOCl → 2HCl + O 2 (11)
次亜塩素酸塩漂白剤の有効成分はpHによって変化する。 pH < 2ではCl 2が溶液中の主成分、pH 4から6ではHOClが主成分、pH > 9ではOCl – が唯一の成分として存在する。 家庭用漂白剤の有効成分は塩基性溶液中の次亜塩素酸イオンであり、通常約5~6%のNaOClである。 OCl – イオンは色材中の発色団を酸化させ、それ自身は塩化物イオンと水酸化物イオンに還元される。
OCl – + H 2 O + 2 e – → Cl – + 2OH – (12)
市販の次亜塩素酸漂白剤による白化処理は、しばしば蛍光増白剤(入射紫外線を吸収して可視光を放出し、布地をより明るく白く見せる化合物)の使用によって強化されています。
過酸化水素 (H 2 O 2 ) . 過酸化水素は過酸化バリウムと硫酸を反応させて作ることができる(式13参照)。 硫酸バリウムが析出するため、過酸化水素は容易に分離できる。
BaO 2 + H 2 SO 4 → BaSO 4 + H 2 O 2 (13)
過酸化水素は紙パルプ工業で用いられる漂白剤として、無公害であることが利点である。 純粋な過酸化水素は不安定であるため、漂白には水溶液が使用される。 室温では、過酸化水素は非常にゆっくりと水と酸素に分解される。
2H 2 O 2 → H 2 O + O 2 (14)
しかし、遷移金属カチオン(特にFe 3+ , Mn 2+ , Cu 2+ )や他の触媒の存在はこの反応を劇的に促進させる。 そのため、過酸化水素水には、遷移金属カチオンを封鎖する錯化剤を用いて安定化させる必要がある。
過酸化水素の漂白活性種は、H2 O2 のイオン化により生成するペルヒドロキシルアニオン、OOH – である。
H 2 O 2 + H 2 O → H 3 O + + OOH – (15)
過酸化水素の酸イオン化定数は非常に小さい(K a = 2 × 10 -12 )ので、H 2 O 2の溶液はアルカリ性にしなければならない

OOHの濃度を上げるために – 。 アルカリ性の媒体がない場合、過酸化水素は漂白剤としての効果を発揮しなくなる。 例えば、毛染めの漂白段階では、過酸化水素(5〜6%)を用いることが多いが、アルカリ性媒体を提供するためにアンモニアも用いる。
同時にpHが11以上に上がってはならない。この時点でOOH – の分解が始まるからである。
2OOH – → O 2 + 2OH – (16)
過酸化水素化合物. 水に溶かすと過酸化水素を放出する固体の過酸化水素化合物は多数存在する。 過ホウ酸ナトリウム(NaBO 3 z 4H 2 O または NaBO 2 z H 2 O 2 z 3H 2 O)、炭酸ナトリウム過酸化水素(2Na 2 CO 3 z 3H 2 O 2 )などである。 過ホウ酸ナトリウムの構造は、ペルオキソアニオンB 2 (O 2 ) 2 (OH) 4 2- を含み、2つの四面体BO 2 (OH) 2- 基を結合する2つのO-O結合を含んでいます。 これらのペルオキシゲン化合物は、洗剤、義歯洗浄剤、歯の粉などに使用されています。
光による漂白。 自然の太陽光や人工の光を利用した漂白は、紙の工芸品から汚れを除去したり、織物を処理するのに利用されてきた。 漂白する素材は、まず炭酸水素カルシウムやマグネシウムのアルカリ溶液に浸し、プレキシガラスやレキサン、マイラーで覆って紫外線から保護する。 その後、自然光の場合は2~4時間、人工光の場合は2~12時間、光にさらす。
還元型漂白剤
漂白に用いられる還元剤としては、亜硫酸塩、重亜硫酸塩、ジチオン酸塩、水素化ホウ素ナトリウムなどがあり、いずれもパルプや繊維の漂白に用いられているものである。
亜硫酸塩(SO 3 2-)と重亜硫酸塩(HSO 3 -)。 SO 3 2-、HSO 3 -とも硫黄の酸化状態は+4であり、+6への酸化が容易で、それぞれSO 4 2-、HSO 4 -を生成するため、亜硫酸塩、重亜硫酸塩は優れた還元剤となる。
亜鉛鉱(S 2 O 4 2- ). 亜ジチオン酸ナトリウムと亜ジンクは機械パルプや織物の漂白に使用されている。 亜ジチオン酸イオンの調製は、亜硫酸水素イオンと二酸化硫黄を亜鉛ダストで還元することにより行われる。
2HSO 3 – + SO 2 + Zn → Zn 2+ + S 2 O 4 2- + SO 3 2- + H 2 O (17)
酸化状態が+3である亜ジチオン酸イオンS 2 O 4 2-はアルカリ溶液中で強還元剤として挙動する。
S 2 O 4 2- + 4OH – → 2SO 3 2- 2H 2 O + 2 e – (18)
ルシャトリエの原理で予測されるように、pHが低くなると亜ジチオン酸イオンの還元力は低下する。
亜ジチオン酸塩は錆び汚れの除去に有用であり、Na 2 S 2 O 4の中性クエン酸溶液はタイタニック号からの回収物から鉄腐食生成物を除去するのに用いられた。
水酸化ホウ素ナトリウム(NaBH 4 )。 水素化ホウ素ナトリウムは、主に機械パルプの工業的漂白に使用されてきた。 BH 4 – イオンはアルカリ溶液中では強い還元剤となる。
BH 4 – + 10OH – → BO 3 3- + 8 e – + 7H 2 O (19)
水酸化ホウ素ナトリウムを用いる場合の問題点は、BH 4 – イオンが水溶液中でゆっくりと分解していくことである。
BH 4 – + 4H 2 O → B(OH) 4 – + 4H 2 (20)
別の方法として、BH 4 – 塩をCH 3 OHまたは毒性の低いC 2 H 5 OHに溶解させることもできます。 アルコール中のBH 4 – イオンの分解ははるかに遅い速度で起こる。
BH 4 – + 4ROH → B(OR) 4 – + 4H 2 (R = CH 3 , C 2 H 5 ) (21)
結論
漂白剤は物質の色の元である発色団と反応することによって物質を白くしたり脱色したりすることができます。 発色団の性質によって、漂白剤は酸化剤または還元剤になります。 つまり、発色団は酸化または還元され、無色または白色の物質が生成される。 漂白剤とその商業的用途を表1にまとめた。