このシリーズでは、ベッドフォードスクールのコリン・ベイカーが、学生の想像力をかき立てるような華やかなデモンストレーションを披露しています。
Nothing tend to imprint the chemical facts on the mind so much as the exhibition of interesting experiments – Samuel Parkes, 1816
1931年9月、アメリカの化学者ウォレス・カロザースは、デュポンの研究所で、ウールの化学構造の理解に基づいてポリマーという「巨大」分子についての研究報告を行いました。 キャロザースは、その分子構造から単純に「66」と呼ばれる繊維を研究対象とした。 1935年には、「奇跡の繊維」と呼ばれるナイロンが誕生し、当初の市場である女性用靴下で大成功を収めた。 1941年12月、アメリカが第二次世界大戦に参戦すると、戦争生産委員会はナイロンの全生産量をパラシュートやB29爆撃機のタイヤなどの軍事用途に割り振った。

Source: Colin Baker
デカンジオイルジクロライドと1,6-ジアミノヘキサンの反応
有機溶剤中の二酸塩化物は水中で脂肪族ジアミンと非混和層を形成する。 2つの無色の溶液が交わる界面では、白色の長鎖ポリマーが形成される。 このポリマー膜は界面から引き剥がすことができ、引き剥がすとすぐに入れ替わる。 引っ張るのを止めると何も起こらないように見えるが、再び引っ張り始めるとすぐに反応が再開される。 数時間かけて反応することもあります。

Source: Colin Baker
Kit
- シクロヘキサン、100cm3(刺激性、高可燃);
- デカンジオイルジクロライド、5.0cm3;
- 蒸留水, 100cm3;
- 無水炭酸ナトリウム, 10g;
- 1,6-diaminohexane, 5.0g;
- 250cm3のビーカー2個 ;
- 5cm3のビーカー ;
- ピンセット ;
〈6477〉ガラスの棒.
Safety
Decanedioyl dichlorideと1,6-diaminohexaneは腐食性があります。 飲み込んだり、吸い込んだりすると有害であり、皮膚に触れると火傷の原因となります。 また、皮膚に付着すると火傷を負います。 シクロヘキサンは引火性が高く、刺激性があります。
手順
次の2つの溶液を用意します。
溶液A:シクロヘキサン中のデカンジオイルジクロライド。 250cm3のビーカーに100cm3のシクロヘキサンを入れ、5.0cm3のデカンジオイルジクロライドを加え、かき混ぜて溶かします。 この溶液は約4週間保存できます。
溶液B:1,6-ジアミノヘキサン、炭酸ナトリウム水溶液。 250cm3のビーカーに蒸留水100cm3を入れ、無水炭酸ナトリウム10gを加え、かき混ぜて溶かす。 固体の1,6-ジアミノヘキサン5.0gを加え、かき混ぜて溶かす。
A液2cm3を5cm3ビーカーに注ぎます。 溶液Aは有機溶媒を含み、水層より密度が高いので、最下層になります。 この2つの溶液の界面にでき始めたポリアミド膜(白色の固体)をピンセットでつかみ、ゆっくりとビーカーから引き抜きます。 ガラス棒に繊維を巻きつけ、引っ張り続ける。 反応物の1つを使い切ったところで、処理を停止する。
Special tips
2つ目の溶液を加えるときは、混ざらないように注意する必要があります。 繊維が一続きの糸で引き出される様子を実演し、どのペアが最も長い繊維を作れるか競争させる。 ファイバーが切れる前に、5メートルまで出せるようにする。 私はクラスを2つの大きなグループに分け、それぞれにガラス棒を持たせています。 私の生徒たちは、30mを超えるファイバーを作り、角を曲げようとさえしています。 各溶液の最大容量は10cm3に制限する必要があります。 生徒は手袋を着用し、ファイバーに触れないようにしなければなりません。 ファイバーが折れてしまった場合は、吸収性のある紙で包む必要があります。 こぼれた場合は、吸水紙で拭き取り、ゴミ箱に入れること。
教育目標
ポリアミドは、繰り返し単位がアミド結合、-CO-NH-によって結合されている高分子である。
Nylon-6,10
Nylon-6,10 は2つのモノマーから作られ、一方は6個の炭素原子を含み、他方は10個-それが名前の由来になっています。 炭素数10のモノマーはデカンジオイルジクロライド(ClOC(CH2)8 COCl)で、両端に-COCl基を持つ酸クロライドである。 もう1つのモノマーは、両末端にアミノ基である-NH2を持つ炭素数6の鎖である。 これが1,6-ジアミノヘキサン(H2 N(CH2)6 NH2、ヘキサン-1,6-ジアミンとも呼ばれる)である。
この2つの化合物が重合するとき、アミン基と酸基が結合し、そのたびに塩化水素1分子が失われる。
n ClOC-(CH2)8-COCl + n H2N-(CH2)6-NH2 → -(CO-(CH2)8-CONH-(CH2)6-NH)n – + n HCl
この小さな分子の損失を伴うポリマー形成過程は縮重合として知られています。
ナイロン6,6
このポリマーは2つの炭素数6の分子、ヘキサンジオ酸と1,6-ジアミノヘキサンを縮合することによって作られる。 工業的にはシクロヘキサンを使って両方のモノマーを作る。 シクロヘキサンを酸化すると、環が開き、鎖の両端に酸基を持つヘキサン二酸が生成される。 この酸をアンモニアで中和すると、ジアンモニウム塩 (NH4 OOCCH2 CH2 CH2 COONH4) が生成され、脱水(350℃に加熱)および還元(H2/Ni使用)して1,6-ジアミノヘキサンへと変換することが可能です。 二酸とジアミンの縮合重合は、水が失われることで起こります。
n HOOC-(CH2)4 -COOH + n H2 N-(CH2)6 -NH2 → -(CO-(CH2)4 -CONH-(CH2)6 -NH)n – + n H2 O
Nylon-6
単一モノマーのカプロラクタム (hexahydro-2H-azepin-2-one, 1) からナイアンを作ることが可能である。
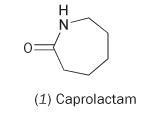
カプロラクタムは内部にアミド結合を持つ。 この分子の重合により開環し、結合して連続した鎖を形成する。
-(NH-(CH2)5 -CONH-(CH2)5 -CONH-(CH2)5 -CO)n –
ナイロンは繊維産業に革命を起こし、今日の多くの現代的な合成繊維の先駆者である。 現在も製造業において重要かつ広く使用されている素材です。