
Ha klórgázt buborékosítunk egy palack paradicsomlében, a klór/paradicsomlé keverék öt percen belül szinte teljesen fehérré válik. Ez a látványos változás a klór oxidáló fehérítőszerként ható kémiai hatásának eredménye, amely a paradicsomlé pigmentjeire hat. Amikor az öregedés és a fénynek való kitettség miatt elszíneződött régi újságkivágásokat 1 százalékos vizes nátrium-borohidrid-oldattal kezelik, a papír húsz percen belül drámaian kifehéredik. Ebben az esetben a redukáló fehérítőszerként ható nátrium-borohidrid hatására a papír visszanyerte eredeti fehér színét.
A fehérítőszer olyan anyag, amely képes fehéríteni vagy elszínteleníteni más anyagokat. A színes anyagok általában olyan atomcsoportokat, úgynevezett kromofórokat tartalmaznak, amelyek képesek elnyelni a látható fényt meghatározott, jellegzetes hullámhosszúsággal, és a fény el nem nyelt részét visszaverik vagy áteresztik. Ha például egy kromofór elnyeli a kék fényt, akkor a komplementer színű fényt visszaveri, és a kromofórt tartalmazó anyag sárgának tűnik. A fehérítőszerek lényegében elpusztítják a kromofórokat (ezáltal eltávolítják a színt), ezen elnyelő csoportok oxidációja vagy redukciója révén. Így a fehérítőszerek vagy az oxidálószerek vagy a redukálószerek közé sorolhatók.
A fehérítőszerek néhány felhasználási módja:
- Textíliák és szövetek fehérítése
- Fapép fehérítése
- Foltok eltávolítása
- Kereskedelmi és háztartási mosás és tisztítás
- . Súroló tisztítószerek és mosogatószerek összetevőjeként
- A haj fehérítése
Oxidáló fehérítőszerek
Számos oxidáló fehérítőszert vizsgált meg Jules A. Szilárd a Fehérítőszerek és technikák című könyvében (1973). A ma általánosan használt oxidáló fehérítők (és fehérítőszerek) a következők: klór, klór-dioxid, alkáli hipokloritok, hidrogén-peroxid, peroxigénvegyületek, valamint napfény és mesterséges fény.
Klór (Cl 2 ). A klór felfedezése Carl Wilhelm Scheele svéd kémikus által 1774-ben jelentette a fehérítés modern korszakának kezdetét. Sidney M. Edelstein 1948-as, “A kémia szerepe a festés és fehérítés fejlődésében” című folyóiratcikkében írt cikke szerint Claude-Louis Berthollet francia kémikus volt az első, aki klórt használt pamut- és vászonszövetek fehérítésére.
A klórt használták a fapép fehérítésére. Sok cellulózgyár, amely a kraft cellulózgyártási eljárást alkalmazza, a nátrium-hidroxidot (amely a faforgács feltárásához szükséges) a helyszínen állítja elő sósav , nátrium-klorid koncentrált vizes oldatának elektrolízisével.
2NaCl + 2H 2 O → 2NaOH + H 2 + Cl 2 (1)
A klór melléktermék. A barna cellulóz utólagos klóros fehérítése olyan terméket ad, amelyet író- és nyomdapapír gyártására lehet felhasználni. Sajnos a cellulózban lévő szerves vegyületek oxidálódnak és klórozódnak is, így kis mennyiségben klórorganikus vegyületek keletkeznek, többek között
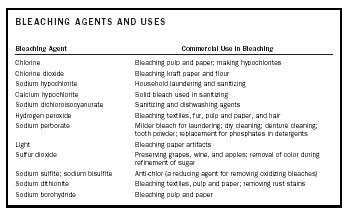
| FEHÉRÍTŐANYAGOK ÉS HASZNÁLATOK | |
| Fehérítőszer | Kereskedelmi felhasználás a fehérítésben |
| Klór | Fehérítőanyag cellulóz és papír fehérítésére; Hipokloritok előállítása |
| Klór-dioxid | Kraftpapír és liszt fehérítése |
| Nátrium-hipoklorit | Háztartási mosás és fertőtlenítés |
| Kalcium. hipoklorit | Fertőtlenítéshez használt szilárd fehérítő |
| Nátrium-diklór-izocianurát | Fertőtlenítő és mosogatószerek |
| Hidrogén-peroxid | Textíliák fehérítése, szőrme, cellulóz és papír, valamint haj |
| Nátrium-perborát | Enyhébb fehérítőszer mosáshoz; száraz tisztítás; műfogsor tisztítás; fogpor; foszfátok helyettesítése mosószerekben |
| Fény | Fehérítő papírtárgyak |
| Kén-dioxid | Szőlő, bor és alma tartósítása; szín eltávolítása a cukor finomítása során |
| Nátrium-szulfit; Nátrium-biszulfit | Anti-klór (redukálószer oxidáló fehérítőszerek eltávolítására) |
| Nátrium-ditionit | Textil, cellulóz és papír fehérítése; rozsdafoltok eltávolítása |
| nátrium-borohidrid | cellulóz és papír fehérítése |
dioxinok. Valójában a cellulóz- és fehérítési folyamat során keletkező leggyakoribb dioxin, a 2,3,7,8-tetraklór-dibenzo- p -dioxin (2,3,7,8-TCDD) egyszerre bizonyult rákkeltőnek és halálos méregnek . Ezért a klórt mint fehérítőszert a biztonságosabb fehérítőszerek, a klór-dioxid és a hidrogén-peroxid váltják fel. Valójában a cellulóz- és papíriparban a trend a teljesen klórmentes (TCF) fehérítés irányába mutat. A klórt a fehérítőiparban jelenleg főként hipokloritoldatok és száraz fehérítőszerek, például kalcium-hipoklorit előállítására használják.
Klór-dioxid (ClO 2 ). A klór-dioxidot fehérítőszerként használták mind gázfázisban, mind vizes oldatban. Robbanásveszélyes jellege miatt a gázfázisú klór-dioxidot gyakran nitrogénnel vagy szén-dioxiddal hígítják. Ha tárolják vagy szállítják, a klór-dioxidot hideg vízen keresztül vezetik át, és hűtve tartják.
A klór-dioxidot iparilag nátrium-klorát kén-dioxiddal történő redukciójával állítják elő vizes oldatban.
2NaClO 3 + SO 2 + H 2 SO 4 → 2ClO 2 + 2NaHSO 4 (2)
A ClO 2 előállításának viszonylag biztonságos módszere a nátriumklorit (NaClO 2 ) és a formaldehid (H 2 CO) közötti reakció.
H 2 CO + H + + ClO 2 – → HOCl + HCOOH (3)
A 3. reakció előrehaladtával az oldat pH-ja csökken (hangyasav keletkezése miatt ). Az oldat megnövekedett savassága elősegíti a ClO 2 képződését, amit a 4. egyenlet mutat.
HCOOH + HOCl + 2ClO 2 – → 2ClO 2 + Cl – + H 2 O + HCOO – (4)
Savas oldatban a klór-dioxid oxidálószerként viselkedik. A ClO 2 teljes redukcióját az 5. egyenlet mutatja.
ClO 2 + 4H + + + 5 e – → Cl – + 2H 2 O (5)
A teljes redukciós reakció egyes lépései HClO 2 -t, HOCl-t és Cl 2 -t eredményeznek, amelyek mind oxidálószerként viselkednek. Savas közegre van szükség, mivel a ClO 2 lúgos oldatban aránytalanná válik, amint azt a 6. egyenlet mutatja.
2ClO 2 + 2OH – → ClO 3 – + ClO 2 – + H 2 O (6)
A klór-dioxidot elsősorban cellulózfehérítésre használják.
Hipokloritok (OCl – ). A hipoklorit fehérítőoldatokat NaOCl-ból és kisebb mértékben Ca(OCl) 2 -ből készítik. A hipokloritokat a mosásban, fertőtlenítőszerként, a cellulóz és a textíliák fehérítésére, valamint az újrahasznosított papírból a festék eltávolítására használják. A kereskedelmi forgalomban kapható fehérítőoldatokat úgy nyerik, hogy klórgázt vezetnek át hideg, hígított, vizes nátrium-hidroxidon, amint azt a 7. egyenlet mutatja.
Cl 2 + 2OH – → OCl – + Cl – + H 2 O (7)
Alternatívaként a hipoklorition szerves nitrogén-klórvegyületek hidrolízisével is előállítható. Az így felhasznált fontosabb nitrogén-klórvegyületek közül néhány fontosabb a klórozott izocianurátok. Ezeket tisztító- és mosogatószerekben használják.
Ahhoz, hogy hatékony fehérítőszer legyen, a hipokloritoldatot lúgosnak kell tartani (pH > 9,0), hogy elnyomja az OCl – hidrolízisét (lásd a 8. egyenletet) és megakadályozza az instabil HOCl képződését.
OCl – + H 2 O → HOCl + OH – (8)
Savas oldatokban HOCl képződik és bomlik.
3HOCl → HClO 3 + 2HCl (9)
A HOCl reakcióba lép a HCl-lel is, ami az egyik bomlástermék.
HOCl + HCl → H 2 O + Cl 2 (10)
A hipokloritos fehérítőoldatok nem tartalmazhatnak nehézfém kationokat, mivel ezek a kationok (akárcsak a fény vagy a hő) elősegítik a HOCl bomlását, amint azt a 11. egyenlet mutatja.
2HOCl → 2HCl + O 2 (11)
A hipoklorit fehérítőszerek hatóanyagai a pH függvényében változnak. pH < 2-nél a Cl 2 a fő komponens az oldatban; pH 4-6-nál a HOCl a domináns faj; pH > 9-nél az OCl – az egyetlen jelenlévő komponens. A bázikus oldatban lévő hipoklorit-ion a háztartási fehérítőszer hatóanyaga, amely jellemzően 5-6% NaOCl-t tartalmaz. Az OCl – ion oxidálja a színes anyagok kromofórjait, és maga is klorid- és hidroxidionokká redukálódik.
OCl – + H 2 O + 2 e – → Cl – + 2OH – (12)
A kereskedelmi hipoklorit fehérítőszerrel végzett fehérítési folyamatot gyakran fokozzák optikai fehérítőkkel, olyan vegyületekkel, amelyek elnyelik a beeső ultraibolya fényt és látható fényt bocsátanak ki, így a szövet világosabbnak és fehérebbnek tűnik.
Hidrogén-peroxid (H 2 O 2 ) . A hidrogén-peroxid bárium-peroxid és kénsav reakciójával állítható elő (lásd a 13. egyenletet). Mivel a bárium-szulfát kicsapódik, a hidrogén-peroxid könnyen elválasztható.
BaO 2 + H 2 SO 4 → BaSO 4 + H 2 O 2 (13)
A hidrogén-peroxid, mint a cellulóz- és papíriparban használt fehérítőszer, előnye, hogy nem szennyező. A tiszta hidrogén-peroxid instabilitása miatt a fehérítésben vizes oldatokat alkalmaznak. Szobahőmérsékleten a hidrogén-peroxid nagyon lassan bomlik vízzé és oxigénné.
2H 2 O 2 → H 2 O + O 2 (14)
Átmeneti fémkationok (különösen Fe 3+ , Mn 2+ és Cu 2+ ) és más katalizátorok jelenléte azonban drámaian felgyorsítja ezt a reakciót. Ennek eredményeként a vizes hidrogén-peroxidot olyan komplexképző anyagokkal kell stabilizálni, amelyek az átmeneti fémkationokat megkötik.
A hidrogén-peroxid aktív fehérítő faja a perhidroxil-anion , OOH – , amely a H 2 O 2 ionizációja révén keletkezik.
H 2 O 2 + H 2 O → H 3 O + + OOH – (15)
A hidrogén-peroxid savas ionizációs állandója nagyon alacsony ( K a = 2 × 10 -12 ), aminek következtében a H 2 O 2 oldatait lúgossá kell tenni ahhoz, hogy

hogy növelje az OOH koncentrációját – . Lúgos közeg hiányában a hidrogén-peroxid már nem hatékony fehérítőszerként. Például a hajfestés fehérítési szakaszában gyakran alkalmaznak hidrogén-peroxidot (5-6%), de ammóniát is, hogy lúgos közeget biztosítsanak.
Ugyanakkor a pH nem emelkedhet 11 fölé, mivel ezen a ponton az OOH – bomlása kezdődik.
2OOH – → O 2 + 2OH – (16)
Peroxigénvegyületek. Számos szilárd peroxigénvegyület létezik, amelyek vízben oldva hidrogén-peroxidot bocsátanak ki. Ezek közé tartozik a nátrium-perborát (NaBO 3 z 4H 2 O vagy NaBO 2 z H 2 O 2 z 3H 2 O) és a nátrium-karbonát-peroxihidrát (2Na 2 CO 3 z 3H 2 O 2 ). A nátrium-perborát szerkezete a B 2 (O 2 ) 2 (OH) 4 2- peroxoaniont tartalmazza, amely két O-O kötést tartalmaz, amelyek két tetraéderes BO 2 (OH) 2-csoportot kötnek össze. Ezeket a peroxigénvegyületeket mosószerekben, műfogsor tisztítószerekben és fogporokban használják.
Fénnyel történő fehérítés. A természetes napfényt vagy mesterséges fényt alkalmazó fehérítést használták a foltok eltávolítására a papírtárgyakról és a textíliák kezelésére. A fehérítendő anyagot először kalcium- vagy magnézium-bikarbonát lúgos oldatába merítik, majd plexivel, Lexannal vagy Mylarral lefedve védik az ultraibolya sugárzástól. Ezután természetes napfény esetén 2-4 órán keresztül, mesterséges fény esetén pedig 2-12 órán keresztül hagyják, hogy a fénynek kitegyék.
Redukáló fehérítők
A fehérítéshez használt redukálószerek közé tartoznak a szulfitok, biszulfitok, ditionitok és nátrium-borohidrid, amelyeket a cellulóz- és textilfehérítésben használnak.
Szulfitok (SO 3 2- ) és biszulfitok (HSO 3 – ). A kén oxidációs állapota mind az SO 3 2-ben, mind a HSO 3 -ban +4, és könnyen oxidálódik +6-ra, SO 4 2-, illetve HSO 4 – képződésével, ami a szulfitokat és biszulfitokat jó redukálószerré teszi.
Ditionitok (S 2 O 4 2- ) . Mind a nátrium-, mind a cink-ditionit felhasználásra került a mechanikai cellulózok és textíliák fehérítésében. A dithionit-ion előállítása a biszulfit-ion és a kén-dioxid Zn-porral történő redukciójával történik.
2HSO 3 – + SO 2 + Zn → Zn 2+ + S 2 O 4 2- + SO 3 2- + H 2 O (17)
A dithionit-ion, S 2 O 4 2- , amelynek kénje a +3 oxidációs állapotban van, lúgos oldatban erős redukálószerként viselkedik.
S 2 O 4 2- + 4OH – → 2SO 3 2- 2H 2 O + 2 e – (18)
A pH csökkentésével a dithionition redukáló ereje csökken, ahogy azt a LeChatelier-elv megjósolja.
A ditionitok hasznosak a rozsdafoltok eltávolítására, és a Na 2 S 2 O 4 semleges citrátoldatait használták a vas korróziós termékeinek eltávolítására a Titanicról előkerült tárgyakról.
Nátrium-borohidrid (NaBH 4 ). A nátrium-borohidridet elsősorban a mechanikai cellulózok ipari fehérítésére használták. A BH 4 – ion lúgos oldatban erős redukálószer.
BH 4 – + 10OH – → BO 3 3- + 8 e – + 7H 2 O (19)
A nátrium-borohidrid használatának egyik problémája, hogy a BH 4 – ion vizes oldatban lassan bomlik.
BH 4 – + 4H 2 O → B(OH) 4 – + 4H 2 (20)
Alternatív módszerként a BH 4 – sókat CH 3 OH-ban vagy a kevésbé mérgező C 2 H 5 OH-ban is feloldhatjuk. A BH 4 – ion bomlása alkoholokban sokkal lassabban megy végbe:
BH 4 – + 4ROH → B(OR) 4 – + 4H 2 (R = CH 3 , C 2 H 5 ) (21)
Következtetés
A fehérítőszer az anyag színéért felelős kromofórokkal reagálva fehéríti vagy színteleníti az anyagot. A kromoforok természetétől függően a fehérítőszer oxidáló vagy redukáló szer lesz. Ez azt jelenti, hogy a kromofórt vagy oxidálja, vagy redukálja, hogy színtelen vagy fehérített anyagot kapjon. A fehérítőszereket és kereskedelmi felhasználásukat az 1. táblázat foglalja össze.