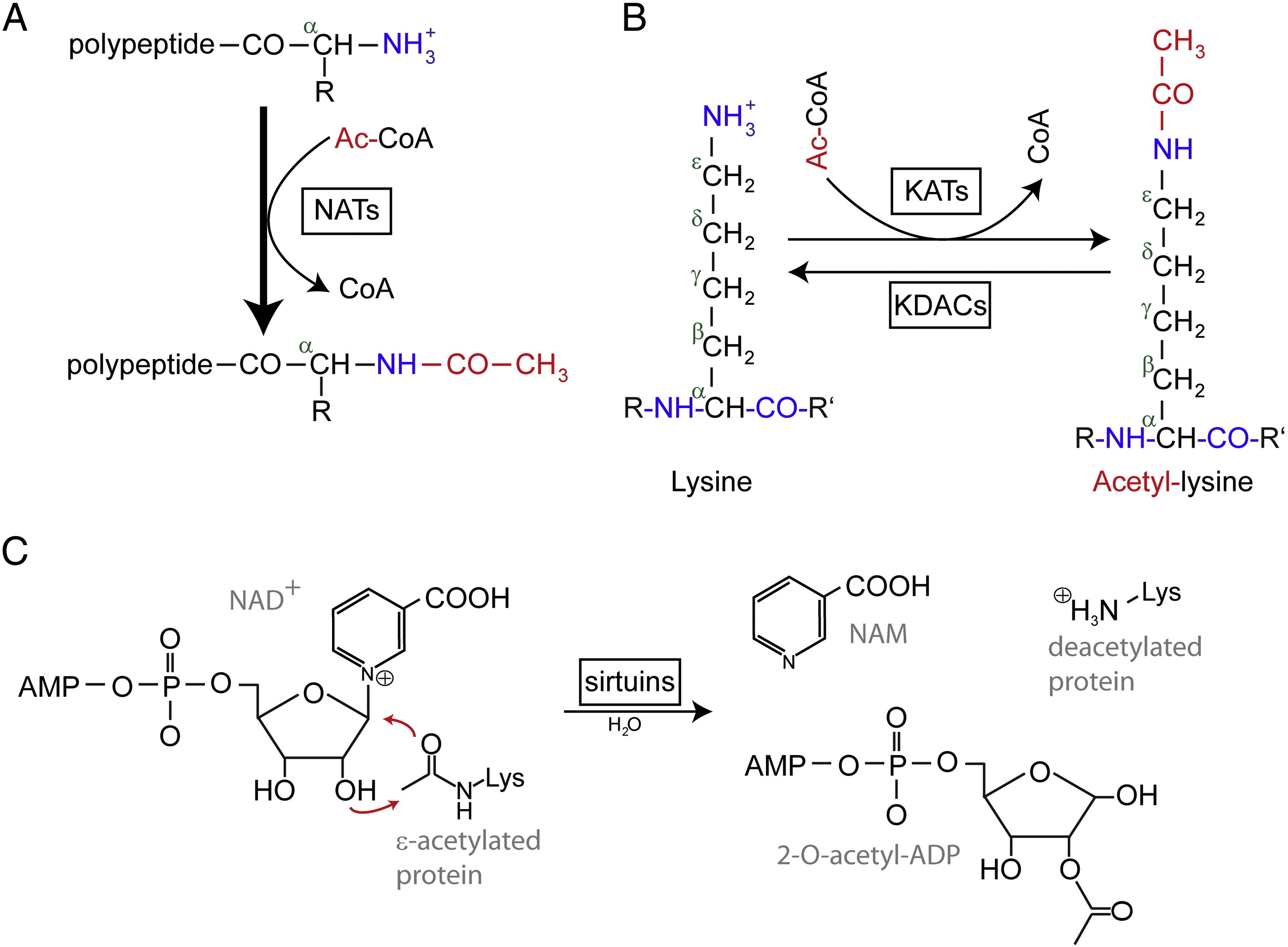
Acetilezés egy olyan reakció, amely egy acetil funkciós csoportot vezet be egy kémiai vegyületbe, amelyben a hidroxilcsoport hidrogénatomját egy acetilcsoportra (CH3 CO) cserélik, így egy specifikus észter, az acetát keletkezik. A fehérje acetilezésnek általában két különböző formája van. Emberben a fehérjék majdnem (80%-90%) ko-transzlációsan acetilálódnak a születő polipeptidláncok Nα-terminálisánál. A másik típus jellemzően lizinmaradványokon acetilálódik.
N-terminális acetiláció
Az N-terminális (Nt) acetilációt Nt-acetiltranszferázok (NAT) katalizálják, és eddig irreverzibilisnek találták. A NAT-ok, mono- vagy több alegységből álló enzimek, amelyek egy katalitikus alegységből és legfeljebb két segéd alegységből állnak, képesek acetilcsoportot átvinni az acetil-koenzim-A-ból (Ac-CoA) a fehérje első aminosavmaradékának α-aminocsoportjára. A NAT-okban a fő segéd alegység modulálja a katalitikus alegység aktivitását és szubsztrátspecifikusságát. Az Nt acetilezéséért különböző NAT-ok felelősek. Emberben eddig hat NAT-ot találtak, köztük a NatA, NatB, NatC, NatD, NatE és NatF-et. Az alegység összetételének különbsége mellett a különböző NAT-ok szubsztrátspecifikusságukban is különböznek.
A Nt acetiláció különböző szerepet játszik a molekuláris hatásokban. Először is, az Nt-acetiláció meghatározza bizonyos fehérjék szubcelluláris lokalizációját. Például az Arl3 és a Grh1, két Golgi-asszociált fehérje, nem tud társulni a Golgi-apparátushoz, ha hiányzik az Nt-acetilcsoport. Másodszor, arról számoltak be, hogy az Nt-acetiláció visszatartja a fehérjéket a citoszolban, és gátolja a poszttranszlációs transzlokációs transzlokációs migrációt az endoplazmatikus retikulumba (ER) és a szekréciós útvonalba. Ezenkívül az Nt-acetiláció megváltoztathatja az N-terminus tulajdonságait, hogy a fehérje-fehérje kölcsönhatások módosuljanak. Számos fehérje esetében kimutatták, hogy az Nt-acetilezést követően megnőtt a kötőpartnereikhez való affinitásuk. Például az E2 ubikvitin-konjugáló enzim, az Ubc12 a NatC által végzett Nt-acetilálásnak köszönhetően megnövekedett affinitással rendelkezik interakciós partnere, az E3 ubikvitin ligáz, a Dcn1 iránt. Ezenkívül az Nt-acetiláció szabályozza a fehérjék minőségét és élettartamát, és szabályozza a fehérje sztöchiometriáját az N-end rule útvonalon keresztül.
Az N-terminális acetilációnak számos funkciója van a fiziológiában. A NAT-ok nélkülözhetetlenek a normális fejlődéshez, a csontok és az erek fejlődéséhez. Az N-terminális acetiláció szabályozhatja a vérnyomást, a proteaszóma lokalizációt, a hormon, valamint az organellák szerkezetét és működését. Az emberi betegségekben a neurodegeneratív betegségekkel (például Alzheimer-kór, Parkinson-kór és Lewy-testes demencia) és a rákos megbetegedésekkel (például tüdőrák, mellrák, vastagbélrák) áll összefüggésben.
A lizin acetiláció
A acetilált lizinmaradványokat először a géntranszkripciót szabályozó hisztonokban fedezték fel. A lizin acetiláció azonban nem korlátozódik a hisztonokra. Az Nt acetilációval ellentétben a lizin acetiláció reverzibilis. Az acetilálást lizin-acetiltranszferázok (KAT-ok), a lizin-maradékok deacetilálását pedig lizin-deacetilázok (KDAC-ok) katalizálják.
A jelentések szerint 17-22 gén KAT-okat azonosítottak a humán genomban (A KAT-ok pontos száma ellentmondásos), amelyek három különböző családba sorolhatók, beleértve a GCN5 (general control non-derepressible 5)-rel kapcsolatos acetil-transzferáz (GNAT) családot, a MYST családot és a p300/CBP (CREB-kötő fehérje) családot. A KAT-komplexek ismert szubsztrátjai közé nemcsak hisztonfehérjék tartoznak, hanem néhány különböző transzkripciós faktor, transzkripciós társszabályozó, valamint a specifikus sejtes jelátviteli útvonalak néhány fehérjéje, mint a p53, β-katenin, NF-κB, MyoD vagy Rb. És még egyes RNS-molekulák is acetilálódhatnak. A KDAC-oknak négy különböző típusa létezik, köztük az I., II., III. és IV. osztály. Az I., II. és IV. osztály Zn2+-függő amidohidrolázok, míg a III. osztály (más néven sirtuinok) NAD+-t használ társszubsztrátként katalitikus aktivitásához Zn2+-függő amidohidrolázok.
A hisztonok az elsőként felfedezett acetilált fehérjék. A hiszton molekulákat különböző PTM-ek módosítják, beleértve a foszforilációt, metilációt és acetilációt. hiszton acetiláció, meghatározza a hisztonok összeszerelődését, valamint a DNS-hiszton kölcsönhatás összehajlását és tömörségét, és ezért a permissív és represszív kromatinszerkezet közötti váltást mutatja be. A hisztonokon kívül a KAT-ok a citoszkeletális fehérjéket is katalizálhatják. Van néhány újonnan azonosított acetilációs hely más fehérjékben, beleértve a HMG fehérjéket, a c-Myc-et, az ösztrogén- és androgénreceptorokat, az E2F/Rb-t és így tovább.
A lizin acetiláció fiziológiai szerepeiről számoltak be. A hisztonfehérjék lényegében mindenféle DNS-templált folyamat, mint a transzkripció, a replikáció, a rekombináció, a javítás, valamint a transzláció és a speciális kromatinszerkezetek kialakulásának szoros szabályozásához kapcsolódnak. Ezért a fehérjék lizin-acetilációja számos sejtes jelátviteli útvonalat, valamint az anyagcserét, a stresszválaszokat, az apoptózist és a membránforgalmat befolyásolja.
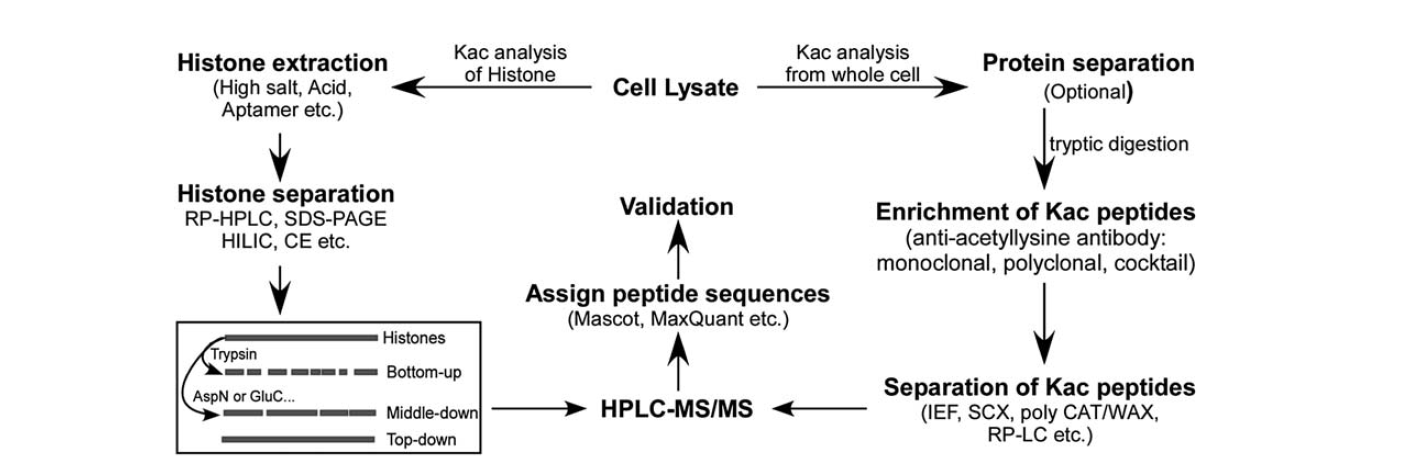
A lizin-acetiláció azonosítására viszonylag kevesebb eszköz áll rendelkezésre. A tömegspektrometria fejlődésével a lizin-acetiláció azonosításának és mennyiségi meghatározásának fontos eszköze lett. A hiszton lizin acetiláció elemzéséhez több lépés szükséges, beleértve a sejtlizátumot, a hiszton extrakciót, a hisztonok elválasztását, a tömegspektrometriát és az adatelemzést. A teljes sejtből származó fehérje lizin-acetiláció elemzésének lépései közé tartozik a sejtlizátum, a fehérjék elválasztása, a lizin-acetilációs peptidek dúsítása, a lizin-acetilációs peptidek elválasztása, a tömegspektrometria és az adatelemzés.