US Pharm. 2018;43(9):21-26.
ABSZTRAKT: A hormonpótló terápia (HRT) a menopauzával járó vasomotoros és urogenitális tünetek leghatékonyabb kezelése. A HRT-vel kapcsolatos mellékhatások számos tényezőtől függnek, beleértve az adagolást, az alkalmazási módot, az alkalmazás időtartamát, a kezdés időpontját és a szer kiválasztását. A HRT megkezdéséről szóló döntésnek magában kell foglalnia a kockázatértékelést, és a HRT-t a betegre kell szabni. A számos létező HRT lehetőség az adagok és az adagolási formák széles skáláján mozog. A gyógyszerészeknek képesnek kell lenniük arra, hogy tanácsot adjanak a betegeknek a HRT-vel és annak mellékhatásaival kapcsolatban.
Az átlagos nő élete egyharmadát a menopauzában vagy azon túl éli le.1 A menopauzális tünetek kezelése egyre nagyobb jelentőségre tesz szert a nők öregedésével járó megbetegedések miatt.2 A hormonpótló terápia (HRT), amely alatt az ösztrogénterápiát, az ösztrogén-progeszteron kombinált terápiát vagy az ösztrogénreceptor agonista vagy antagonista terápiát értik, továbbra is fontos szerepet játszik a perimenopauzális és posztmenopauzális tünetek enyhítésében.3 Bár minden nő tapasztalata más és más, a vazomotoros tünetek (VMS) és a vulvovaginális tünetek a menopauzával járó hormonális változásokkal kapcsolatos két leggyakoribb panasz.4
Menopauzai tünetek
A VMS a leggyakoribb és leginkább zavaró menopauzai tünetek közé tartozik. A hőhullámok, amelyeket a mellkas felső részén és az arcon hirtelen fellépő, 2-4 percig tartó hőérzet jellemez, a klimaxos nők körülbelül 75%-ánál fordulnak elő.1 További lehetséges VMS-ek az izzadás, a szívdobogás és a szorongás.1 A VMS-eket összefüggésbe hozták az alvásminőség romlásával, ingerlékenységgel, koncentrációs nehézségekkel és az életminőség csökkenésével.3 Továbbá ezeket a tüneteket kardiovaszkuláris, csont- és kognitív kockázatokkal hozták összefüggésbe.5-9 A HRT-t már régóta a VMS leghatékonyabb kezelésének tekintik.4,10
A zavaró VMS mellett sok nő tapasztal vulvovaginális tüneteket is. Becslések szerint a nők 10-40%-a tapasztal hüvelyi sorvadást.3 A hüvelyi sorvadás okozhat vulváris fájdalmat, égést és viszketést; hüvelyszárazságot; hüvelyi folyást; dyspareunia (nehéz vagy fájdalmas közösülés); és foltos vagy vérzés a közösülés után1. Ezek a tünetek általában a késői posztmenopauzális szakaszban jelentkeznek, és kellemetlen érzést okozhatnak szűk ruházatban, ülés vagy testmozgás közben, illetve szexuális aktivitáskor.1 A vulvovaginális tünetek kezelésére általában helyi HRT javasolt.1
A korábban említett tünetek enyhítésén túlmenően bizonyíték van arra, hogy a standard alacsony dózisú HRT megelőzheti a posztmenopauzás csípő-, gerinc- és nem gerinctöréseket is10. A HRT előnyei a VMS és az urogenitális tünetek esetében többek között a hiperaktív hólyag javulása, az alvászavarok csökkenése, a 2-es típusú cukorbetegség kockázatának csökkenése, a koszorúér-betegség (CAD) és a szívinfarktus elleni potenciális védelem, a csontritkulás vagy csonttörés kockázatának csökkenése, valamint a teljes halálozás potenciális csökkenése.1,10 A HRT csontsűrűségre gyakorolt előnyei azonban a kezelés abbahagyását követően gyorsan csökkennek. Ezenkívül, bár néhány termék az FDA engedélyével rendelkezik a csontritkulás megelőzésére, jelenleg egyik sem engedélyezett a csontritkulás kezelésére. E szerek alkalmazásával kapcsolatos főbb kockázatok közé tartozik a vénás tromboembólia (VTE), az ischaemiás stroke, az endometriumrák megnövekedett előfordulása (ha méhvel rendelkező nőknél nem opponált ösztrogént alkalmaznak), valamint a mellrák megnövekedett kockázata, ha a HRT-t 3-5 éven túl alkalmazzák.4,10
Az elérhető HRT-termékek
A HRT-termékek széles választéka áll rendelkezésre különböző adagolási formákban.4 Az orális készítmények közül a lehetőségek közé tartoznak a konjugált lóösztrogének (CEE), a mikronizált 17-béta-ösztradiol (mikronizálva a felszívódás javítása érdekében), az észterezett ösztrogének, az etinilösztradiol (egy nagy hatású ösztrogénkészítmény, amelyet HRT-re sokkal kisebb dózisban használnak, mint orális fogamzásgátlásra), az ösztrogén-progesztin kombinált tabletta és a CEE/bazedoxifen kombinált tabletta.4
A CEE/bazedoxifen tabletta, amely ösztrogén és egy szelektív ösztrogénreceptor-modulátor kombinációja, az Egyesült Államokban a menopauzás VMS kezelésére és a csontritkulás megelőzésére kapható. Ebben a kombinációban a bazedoxifen megakadályozza az ösztrogén által kiváltott endometrium hiperpláziát, ami szükségtelenné teszi a progesztin adását. A bazedoxifen azonban a VTE fokozott kockázatával jár.4 A bazedoxifen alkalmazása biztonságosnak bizonyult, ha a csontritkulás kezelésében legfeljebb 7 évig vizsgálták, de a kombinációt csak rövidebb ideig vizsgálták.11,12 A legfeljebb 2 évig tartó VMS-vizsgálatok nem mutatták ki a mellérzékenység előfordulásának vagy az emlőrák kockázatának növekedését3. A jelenlegi irányelvek a CEE/bazedoxifen alkalmazását ajánlják a méhvel rendelkező és ellenjavallat nélküli posztmenopauzában lévő nők számára a VMS kezelésére és a csontvesztés megelőzésére, de nem határozzák meg a terápia időtartamát.1 A rendelkezésre álló bizonyítékok alapján a VMS legfeljebb 2 évig tartó CEE/bazedoxifénnel történő kezelése biztonságosnak tűnik; a 2 éven túli alkalmazás biztonságossága továbbra sem egyértelmű.
AHRT különböző helyi alkalmazásokban is elérhető. A 17-béta-ösztradiol vagy ösztrogén-progesztin kombinációk transzdermális tapaszkészítményei rendelkezésre állnak. Más helyi készítmények közé tartoznak a gélcsomagok vagy adagoló pumpák, spray-k és emulziók.4 Depot injekciók is szóba jöhetnek, de ezeket a termékeket ritkán alkalmazzák a HRT-ben.4 A rendelkezésre álló szisztémás HRT-formulák összefoglalása az 1. TÁBLÁZATban található.13-15
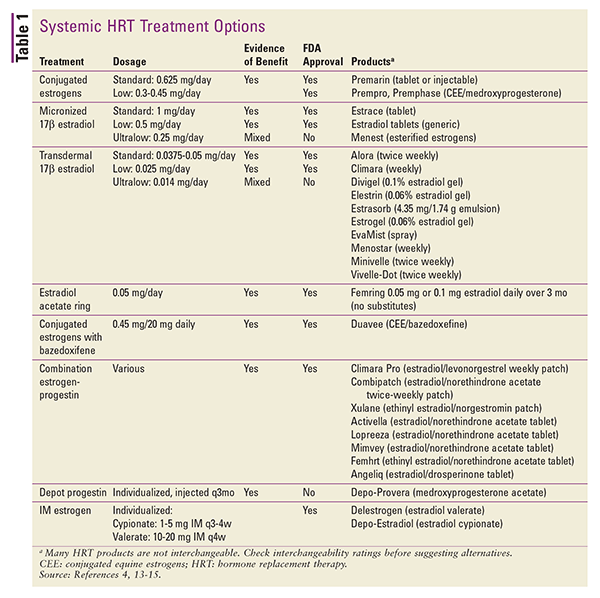
Az egyik adagolási formáról a másikra történő átváltásnál az alkalmazási mód és a termék hatékonysága közötti különbségeket becsült dózisegyenértékekkel lehet figyelembe venni.4 Az orális készítmények dózisegyenértékei a következők: 1 mg mikronizált 17-béta-ösztradiol 1,25 mg piperazin-ösztron-szulfátnak felel meg. Az orális és a transzdermális ösztrogénkészítmények közötti átváltásoknál 0,05 mg/24 óra transzdermálisan körülbelül napi 0,625 mg szájon át bevitt ösztrogénnek felel meg.4
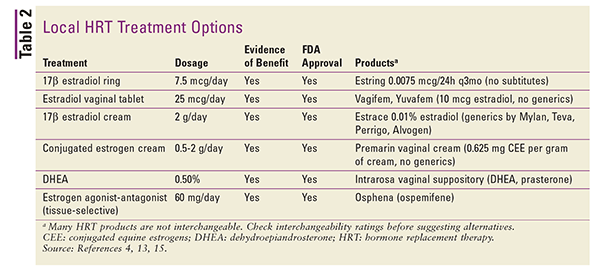
A helyi készítmények általában alacsony dózisúak, és kifejezetten a vulvovaginális atrófia tüneteinek kezelésére szolgálnak.4 A szisztémás VMS kezelésére nagyobb dózisok is alkalmazhatók, de ez általában nem ajánlott.4 A helyi készítmények közé tartoznak a hüvelygyűrűk, tabletták és krémek. A rendelkezésre álló helyi HRT-készítmények összefoglalóját lásd a 2. TÁBLÁZATban.4,13,15
A jelenlegi irányelvi ajánlások
Három szervezet – az American College of Obstetricians and Gynecologists, a North American Menopause Society (NAMS) és az Endocrine Society – készített irányelveket a HRT alkalmazására vonatkozóan a menopauzában. Amint ezekben az irányelvekben szerepel, a HRT indikációi közé tartozik a menopauzával járó VMS kezelése és a vulvovaginális hatások kezelése zavaró szisztémás tünetek hiányában.1,3,4 Az ösztrogén önmagában vagy progesztinnel kombinálva 75%-kal csökkenti a heti VMS-t és jelentősen csökkenti a tünetek súlyosságát a placebóhoz képest.4
A 60 évnél fiatalabb nőknél, akik kevesebb mint 10 évvel a menopauza után vannak, zavaró VMS-ben szenvednek, és nincs ellenjavallatuk a HRT-re, illetve nincs túlzott kardiovaszkuláris vagy emlőrákkockázatuk, csak ösztrogénterápia alkalmazása ajánlott a méh nélküli nők számára. A méhvel rendelkező betegeknél progesztin hozzáadása ajánlott az endometrium hiperplázia és a lehetséges endometriumrák megelőzése érdekében.1,3,4 Jelenleg nem világos a szükséges progesztin expozíció, de sok szolgáltató havonta 14 napos ciklusban ad progesztint.4 A 60 évnél idősebb vagy a menopauza után több mint 10 évvel idősebb nők esetében a HRT helyett más (nem hormonális) terápiák megfontolása javasolt.3
A szív- és érrendszeri betegségek (CVD; az American College of Cardiology/American Heart Association kardiovaszkuláris kockázatbecslő eszköze szerint >10%-os 10 éves CVD kockázattal rendelkező nők esetében) a nem hormonális terápiák előnyben részesítendők.3 A mérsékelt CVD-kockázatú nőknél a transzdermális ösztrogén progesztinnel vagy anélkül előnyösebb az orális terápiával szemben, mivel ezek a készítmények kevésbé hatnak a vérnyomásra, a lipidekre és a szénhidrát-anyagcserére.1 A VTE fokozott kockázatával rendelkező betegeknél a nem orális módszerek alkalmazása a legalacsonyabb hatásos dózisban előnyös. Végül, magas vagy közepes emlőrákkockázatú betegeknél a nem hormonális terápiákat részesítik előnyben.4
Ha a HRT-t választják, valamennyi irányelv a legalacsonyabb hatásos dózis alkalmazását javasolja.1,4,10 A kisebb dózisú HRT egyik előnye a jobb mellékhatásprofil a nagy dózisú kezelésekhez képest.4 A VMS kezelésére jelenleg nincs preferált terápiás útvonal, ezért az alkalmazási módot a beteg preferenciái alapján kell meghatározni. Meg kell jegyezni, hogy a transzdermális készítmények a mellékhatások, például a VTE alacsonyabb előfordulási gyakoriságával járhatnak, de a vizsgálatok még folynak.10
A hormonfüggő rákos megbetegedésekkel nem rendelkező nők esetében a nemi szervi tünetek kezelésére alacsony dózisú hüvelyi ösztrogén alkalmazható.1 Csak hüvelyi tünetek esetén az irányelvek nem javasolják a progesztin hozzáadását, függetlenül a méh jelenlététől. Ez a terápia olyan betegeknél is megfelelő lehet, akiknek a kórtörténetében hormonfüggő daganatos megbetegedés szerepel, de ezekben az esetekben a terápia kiválasztásának a kockázatok és előnyök megvitatását is magában foglaló közös döntéshozatali folyamaton kell alapulnia. A hüvelyi ösztrogén lehetséges előnyei közé tartozik a hüvelyi és húgyúti tünetek gyors javulása és a visszatérő húgyúti fertőzések lehetséges megelőzése. A dyspareunia enyhítésére alkalmazott, az FDA által jóváhagyott és az irányelvekkel összhangban lévő nem ösztrogén terápiák közé tartozik az oszpemifen és az intravaginális dehidropiandroszteron16,17.
A csak progesztin terápia, a tesztoszteron, a növényi alapú alternatív nem hormonális terápiák és az összetett bioidentikus hormonok nem rendelkeznek adatokkal, és általában nem ajánlottak.1,4 A NAMS szerint a felírók megfontolhatják az összetett HRT-t olyan helyzetekben, amikor a beteg nem képes tolerálni az FDA által jóváhagyott terápiákat.3 A vazomotoros tünetek nem hormonális kezelési lehetőségei közé tartoznak a szelektív szerotonin visszavétel gátlók és a szelektív szerotonin-noradrenalin visszavétel gátlók, a klonidin és a gabapentin, a hüvelyi tünetek nem hormonális kezelése pedig a síkosítók, az ösztrogén agonista-antagonisták és a gyógynövényes szerek4. A nem hormonális terápiák alkalmazását alátámasztó bizonyítékok változóak, és nem minden lehetőség rendelkezik bizonyított bizonyítékokkal vagy az FDA által jóváhagyott indikációval.4
A HRT monitorozásának magában kell foglalnia a rendszeres emlőrákszűréseket a terápia alatt és befejezése után. A visszatérő, nem tervezett vérzéseket gyorsan kell értékelni.1 A terápia időtartamát legalább évente felül kell vizsgálni, és a legrövidebb kezelési időtartamot kell előnyben részesíteni.1 Amikor a betegek és a szolgáltatók úgy döntenek, hogy abbahagyják a HRT-t, akár kúpos, akár hirtelen abbahagyási stratégiát lehet alkalmazni. A megszakítás módszereivel kapcsolatban nincs bizonyíték, ezért a megszakítás folyamatában a közös döntéshozatal javasolt.1,4
gyógyszer-gyógyszer kölcsönhatások
A kereskedelmi forgalomban kapható HRT-termékek többsége (1. TÁBLÁZAT) a CYP450 rendszer által közvetített májmetabolizmuson megy keresztül.15 Konkrétan az ösztrogéntermékek részben a CYP3A4 által metabolizálódnak; ezért a CYP3A4 erős induktorai csökkenthetik az ösztrogén HRT hatékonyságát, az erős inhibitorok pedig növelhetik az ösztrogén szérumkoncentrációját. Ezenkívül ezen enzimek más gyógyszer-szubsztrátjai is befolyásolhatják a HRT metabolizmusát.15
Súlyos és gyakori mellékhatások
A HRT-vel kapcsolatos főbb mellékhatások közé tartozik a CVD, az emlőrák, az endometrium- vagy petefészekrák, a stroke és a VTE.1 Az ösztrogén opponálatlan alkalmazása növeli az endometrium hiperplázia és a rák kockázatát, ezért a méhvel rendelkező nőknél progesztin adása javasolt. Ami az emlőrák kockázatát illeti, úgy tűnik, hogy az emlőrák kialakulásának kockázata csekély, ha egy nő 5 évig ösztrogént szed.3 A jelenlegi szakirodalom nem egységes a HRT okozta petefészekrák kialakulásának kockázatát illetően.3 Több randomizált, kontrollált vizsgálatra van szükség annak megállapításához, hogy a HRT alkalmazása esetén ténylegesen mekkora a petefészekrák kialakulásának kockázata.1 A HRT hatása a koszorúér-betegségre (CAD), a stroke-ra és a VTE-re a nők életkorától függően változik, amikor a kezelés megkezdődik, illetve a menopauza kezdete óta eltelt időtől függően. Úgy tűnik, hogy a menopauza kezdetétől számított több mint 10 éve HRT-t szedő nőknél megnő a CAD kialakulásának kockázata.3 Összességében a vizsgálatok azt mutatják, hogy az alacsonyabb dózisú orális és transzdermális készítmények a standard dózisú HRT-vel összehasonlítva csökkentik a stroke és a VTE kockázatát.3 Azok a betegek, akik 60 évnél idősebbek a HRT elkezdésekor, vagy akiknél több mint 10 év telt el a menopauza kezdetétől, fokozottan ki vannak téve e káros hatások kockázatának. Továbbá az ösztrogént tartalmazó HRT-t önmagában vagy kombinációban szedő nőknél megnő az epekövek, az epehólyaggyulladás és az epehólyageltávolítás kockázata.3 Az epehólyagbetegség kockázata az orális HRT alkalmazásával hozható összefüggésbe, és nem biztos, hogy a helyi vagy transzdermális készítmények esetében fennáll.1,3
Kontraindikációk
A szakmai társaságok iránymutatásai nem határozták meg a HRT abszolút vagy relatív ellenjavallatainak listáját.2 Ezért, mint a legtöbb klinikai döntés meghozatalakor, fontos az egyéni előny-kockázat értékelés. Általánosságban elmondható, hogy a HRT-t kerülni kell azoknál a betegeknél, akiknek megmagyarázhatatlan hüvelyi vérzése van; a kórtörténetben stroke vagy átmeneti ischaemiás attak; szívinfarktus; tüdőembólia vagy VTE; emlő- vagy endometriumrák; aktív májbetegség; ismert C-protein-, S-protein- vagy antitrombinhiány vagy más trombofil rendellenesség; és ismert vagy feltételezett terhesség.1 Ezenkívül óvatosságra int a cukorbetegségben, epehólyagbetegségben, hipertrigliceridémiában (>400 mg/nap), hypoparathyreosisban, jóindulatú meningeomában, közepes vagy magas emlőrákkockázatban, magas szívbetegségkockázatban vagy aurás migrénben szenvedő betegeknél.2
Tanácsadási pontok
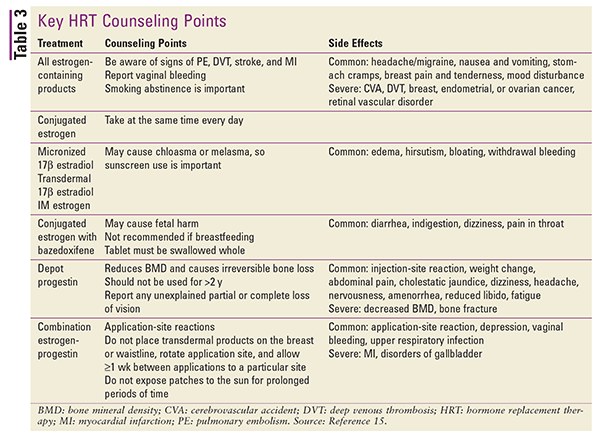
A 3. TÁBLÁZATban található összefoglaló a különböző típusú HRT-k legfontosabb beteg-tanácsadási pontjairól és mellékhatásairól.15
Következtetés
A sokféle készítményben kapható HRT a leghatékonyabb kezelés mind a VMS, mind az ivarszervi tünetek kezelésére. Mivel a HRT-vel kapcsolatos kockázatok minden nő esetében eltérőek, a kezelésnek egyénre szabottnak kell lennie, és a hatékonyság maximalizálására, a terápia időtartamának minimalizálására és a mellékhatások kockázatának csökkentésére kell irányulnia. Azokban az esetekben, amikor a HRT nem jöhet szóba, nem hormonális kezelési lehetőségek állnak rendelkezésre mind a VMS, mind az ivarszervi tünetek kezelésére, de ezeknek a termékeknek a hatékonysága és FDA jóváhagyása eltérő, ezért az ezekre a termékekre vonatkozó hatékonysági adatokat felül kell vizsgálni.
1. Stuenkel CA, Davis SR, Gompel A, et al. A menopauza tüneteinek kezelése: az Endokrin Társaság klinikai gyakorlati útmutatója. J Clin Endocrinol Metab. 2015;100(11):3975-4011.
2. Shifren JL, Schiff I. A hormonterápia szerepe a menopauza kezelésében. Obstet Gynecol. 2010;115(4):839-855.
3. The NAMS 2017 Hormone Therapy Position Statement Advisory Panel. Az Észak-Amerikai Menopauza Társaság 2017-es hormonterápiás állásfoglalása. Menopauza. 2017;24(7):728-753.
4. ACOG Practice Bulletin No. 141: A menopauzális tünetek kezelése. Obstet Gynecol. 2014;123(1):202-216.
5. Thurston RC, Sutton-Tyrrell K, Everson-Rose SA, et al. Hot flashes and subclinical cardiovascular disease: findings from the Study of Women’s Health Across the Nation Heart Study. Circulation. 2008;118(12):1234-1240.
6. Thurston RC, Kuller LH, Edmundowicz D, Matthews KA. A hőhullámok előzményei és az aorta meszesedése posztmenopauzában lévő nők körében. Menopauza. 2010;17(2):256-261.
7. Thurston RC, Sutton-Tyrrell K, Everson-Rose SA, et al. Hot flashes and carotid intima media thickness among midlife women. Menopauza. 2011;18(4):352-358.
8. Crandall CJ, Aragaki A, Cauley JA, et al. Associations of menopausal vasomotor symptoms with fracture incidence. J Clin Endocrinol Metab. 2015;100(2):524-534.
9. Maki PM. A verbális memória és a menopauza. Maturitas. 2015;82(3):288-290.
10. Észak-amerikai Menopauza Társaság. A 2012-es hormonterápiás állásfoglalás: Az Észak-amerikai Menopauza Társaság. Menopauza. 2012;19(3):257-271.
11. Palacios S, Silverman SL, de Villiers TJ, et al. 7 éves randomizált, placebo-kontrollált vizsgálat a bazedoxifen hosszú távú hatékonyságának és biztonságosságának értékelésére posztmenopauzában lévő, csontritkulásban szenvedő nőknél: hatások a csontsűrűségre és a törésre. Menopauza. 2015;22(8):806-813.
12. Archer DF, Freeman EW, Komm BS, et al. Pooled analysis of the effects of conjugated estrogens/bazedoxifene on vasomotor symptoms in the selective estrogens, menopause, and response to therapy trials. J Womens Health (Larchmt). 2016;25(11):1102-1111.
13. FDA. Narancssárga könyv: engedélyezett gyógyszerkészítmények terápiás egyenértékűség-értékelésekkel. Az ANDA 204726 termékadatai. www.accessdata.fda.gov/scripts/cder/ob/results_product.cfm?Appl_Type=A&Appl_No=204726. Hozzáférés 2018. március 18.
14. FDA. Drugs@FDA: Az FDA által jóváhagyott gyógyszerek. www.accessdata.fda.gov/scripts/cder/daf/index.cfm. Hozzáférés: 2018. június 17.
15. DrugDex . Greenwood Village, CO: Truven Health Analytics, Inc. www.micromedexsolutions.com. Hozzáférés 2018. június 15.
16. Constantine G, Graham S, Portman DJ, et al. Női szexuális funkció javulása ospemifénnel a vulvar és vagina atrófiában szenvedő posztmenopauzális nőknél: egy randomizált, placebokontrollált vizsgálat eredményei. Climacteric. 2015;18(2):226-232.
17. Labrie F, Archer DF, Koltun W, et al. Az intravaginális dehidroepiandroszteron (DHEA) hatékonysága a mérsékelt vagy súlyos dyspareunia és hüvelyszárazság, a vulvovaginális atrófia és a menopauza genitourinary szindróma tüneteire. Menopauza. 2016;23(3):243-256.