A cellák és akkumulátorok használata és fontossága megkérdőjelezhetetlen. Mindennapi, mindennapi életünkben nagyon sokféle módon használjuk a cellákat. Nos, az elmúlt néhány fogalomban már bemutattuk önöknek az akkumulátorokat általánosságban. Itt azonban a galvánelemek mélyreható elemzését adjuk át. Tehát, kezdjük is el.
Suggested Videos
Galvánelemek
A galvánelem egyfajta elektrokémiai cella. Elektromos áramot szolgáltat úgy, hogy az elektronok átvitelét redoxireakcióval valósítja meg. A galváncella példaértékű elképzelése annak, hogyan lehet energiát hasznosítani néhány adott elem közötti egyszerű reakció segítségével. Elképesztő tanulmányozni, hogyan lehet egy galváncellát felállítani és felhasználni az energia kinyerésére.
A legegyszerűbben kifejtve, a galváncella olyan eszközként működik, amelyben egyidejűleg oxidációs és redukciós reakciók zajlanak. Ezek a reakciók a kémiai energiát elektromos energiává alakítják át, amely bármilyen kereskedelmi célra felhasználható.
Bővebb témakörök az Elektrokémia alatt
- Akkumulátorok
- Elektrolitikus oldatok vezetőképessége
- Korrózió
- Elektrokémiai cellák
- Elektrolitikus cellák és elektrolízis
- Elektrolitikus cellák
- Nernst-egyenlet
- A vezetőképesség és a moláris vezetőképesség változása a koncentrációval
.
A galvánelemek működése

A galvánelem működése igen egyszerű. Egy kémiai reakciót foglal magában, amelynek végeredményeként elektromos energia áll rendelkezésre. A redoxireakció során a galváncella az elektronok közötti energiaátadást használja fel a kémiai energia elektromos energiává alakítására.
A galváncella kihasználja azt a képességet, hogy az oxidációs és redukciós folyamat során az elektronok áramlását szétválasztja, félreakciót okoz, és mindkettőt összekapcsolja egy-egy vezetékkel, hogy az elektronok ilyen vezetéken keresztül történő áramlásához útvonal alakuljon ki. Ezt az elektronáramlást lényegében áramnak nevezzük. Az ilyen áramot egy vezetéken keresztül lehet áramoltatni, hogy egy áramkört kitöltsön, és bármilyen eszközben, például egy televízióban vagy egy órában megkapja a kimenetét.
A galvánelem bármilyen két fémből elkészíthető. Ez a két fém képezheti az anódot és a katódot, ha egymással érintkezve marad. Ez a kombináció lehetővé teszi annak a fémnek a galvanikus korrózióját, amelyik anódosabb. Egy összekötő áramkörre van szükség ahhoz, hogy ez a korrózió megtörténhessen.
A galváncella felépítése
A galváncella létrehozásához a következő felépítésen kell keresztülmenni. A cella ideális esetben két elektródát tartalmazna. Az egyik elektróda, a katód, pozitív töltésű elektróda, míg a másik, az anód, a negatív töltésű elektróda.
Ez a két elektróda alkotja a galváncella két alapvető alkotóelemét. A redukcióval kapcsolatos kémiai reakció a katódon, míg az oxidációs félreakció az anódon megy végbe. Mint már említettük, a kémiai reakció létrehozásához bármilyen két fém felhasználható.
A galvánelem megértése egy példán keresztül
Vegyünk egy példát, ahol a kémiai reakcióban részt vevő két fém a cink és a réz. A kémiai reakció során a cink végül két elektront veszítene. Ezt felveszi a réz, és elemi rézzé válik. Mivel ezt a két fémet két különálló tartályba helyezzük, és egy vezető vezetékkel összekötjük, elektromos áram keletkezik, amely az összes elektront átadja az egyik fémből a másikba.
A két fémet ugyanakkor sóoldatba kell meríteni, ebben az esetben mondjuk cink-szulfátba és réz-szulfátba. Ebben az esetben a két oldatot nem közvetlenül keverjük össze, hanem egy híd vagy egy közeg segítségével lehet összekötni. Ez a közeg felel az ionok átadásáért, de gondoskodik arról is, hogy a két oldat ne keveredjen egymással.
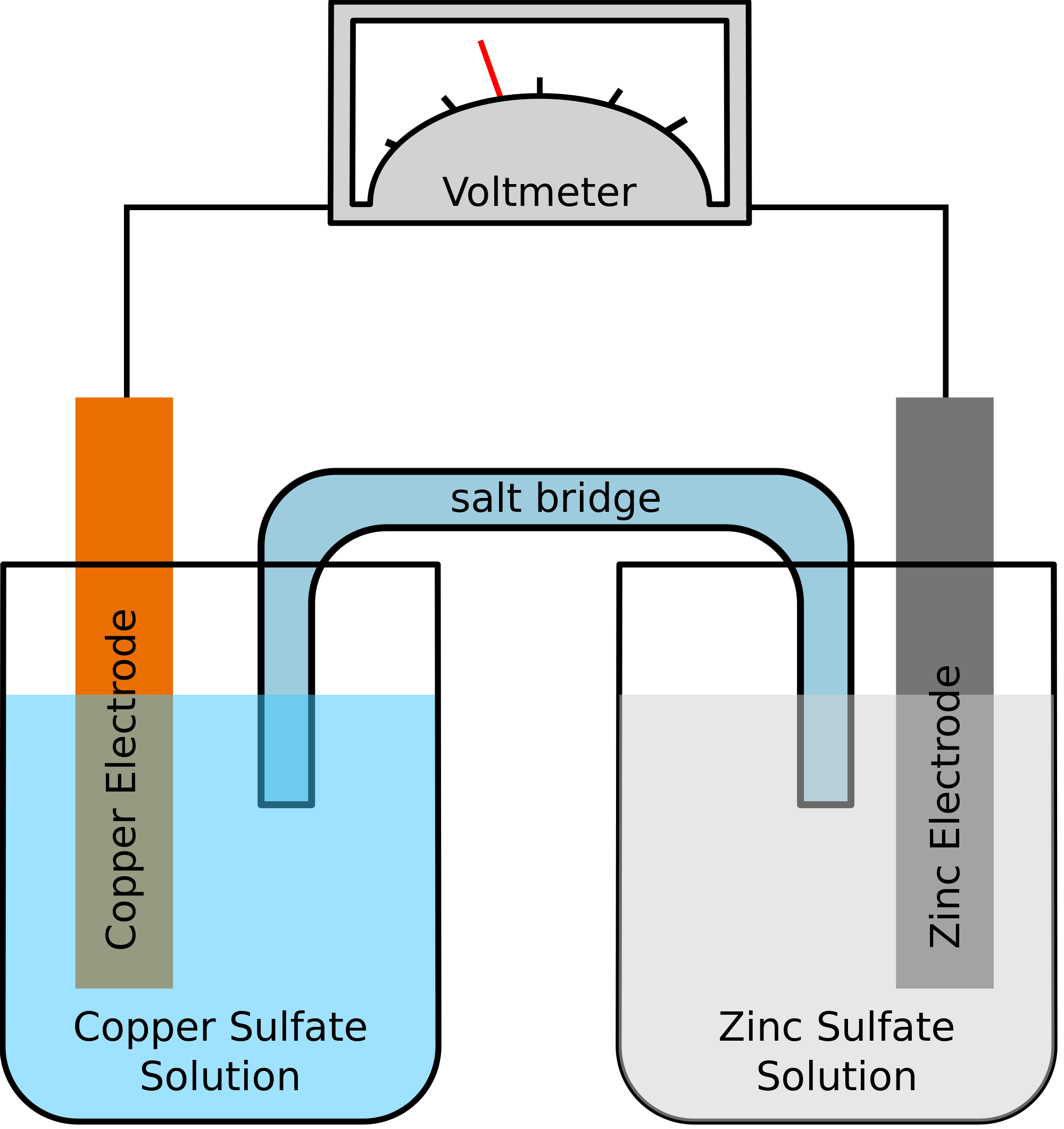
Az ilyen híd segít az elektromos töltés továbbítására szolgáló áramkör kitöltésében, és gondoskodik arról is, hogy a fémeket tartalmazó tartályokban lévő oldatok semlegesek maradjanak, és ne keveredjenek egymással. Amíg a sóhíd nem zavarja a redoxireakciót, amelynek keretében oxidáció és redukció zajlik, addig nem számít, hogy a kémiai reakcióban milyen sóhidat használunk.
Egy pár fontos fogalom
A galvánelemben használatba vett néhány fontos fogalom az alábbiakban szerepel:
- Fázishatárok: A katódként és anódként működő két fémre utal.
- Sóhíd: Az összekötő híd vagy közeg, amely lehetővé teszi a redoxireakciót.
- Oxidáció és redukció: Azok a kémiai folyamatok, amelyek lehetővé teszik az elektromos áram kialakulását és áramlását egy galvánelemben.
Megoldott példák az Ön számára
Kérdés: Mi történik egy galvánelemben, ha nem használunk sóhidat, miközben a redoxireakció lezajlik?
megoldás: Sóhíd hiányában az egyes fémeket tartalmazó tartályokban a redoxireakció nagyjából ugyanúgy kezdődne. De sóhíd hiányában ugyanez meglehetősen hirtelen érne véget. A megfelelő oldatok nem lennének képesek megtartani elektromos semlegességüket. Ettől eltekintve a sóhíd vagy a közeg hiánya miatt a kémiai reakcióban nem lesz változás vagy bármilyen típusú változás.