General Overview
A mikroorganizmusok nagy része nemcsak bennünk, hanem rajtunk is él. Valóban, az emberi bőr többnyire nem patogén baktériumok, gombák és vírusok heterogén keverékének ad otthont, amelyek valószínűleg hozzájárulnak a bőrfelület egészségéhez (1. ábra). A Propionibacterium acnes (P. acnes) egy mindenütt jelenlévő, lassan növekvő, pálcika alakú, nem spóraképző, Gram-pozitív anaerob (2. ábra), amely testszerte megtalálható, beleértve az arc és a nyak faggyúmirigyeit is (Funke és mtsai., 1997; Grice és Segre, 2011; Findley és Grice, 2014). A barrierhelyeken gyakran a kommenzális mikrobiótánk részének tekintik (Cogen és mtsai., 2008), amely a korai újszülöttkori adaptív immuntolerancia mechanizmusain keresztül jön létre (Scharschmidt és mtsai., 2015). Bár az anaerobok topográfiai eloszlása a faggyúhelyeken jelentős, a P. acnes térbeli és személyi eloszlása inkább egyén-, mint helyspecifikus (Oh és mtsai., 2014). Ráadásul a P. acnes biogeográfiája és egyedisége rendkívül dinamikus, mivel az egészségi állapot változása vagy a pH, a hőmérséklet, a nedvesség és/vagy a faggyútartalom változása is befolyásolhatja a mikroorganizmus által elfoglalt fülkék körét (Grice és mtsai., 2009). A bőrmikrobák eloszlásához hasonlóan a bőrállapotok is alakíthatják a P. acnes működését a kórokozó betegségekben való terjeszkedése szempontjából. A P. acnes-t például olyan bőrsérülésekkel hozták összefüggésbe, mint az arcon és a nyakon jelentkező acne vulgaris, valamint a háton jelentkező progresszív makuláris hipermelanózis (Bojar és Holland, 2004; Kurokawa és mtsai., 2009; Barnard és mtsai., 2016). Ezenkívül a P. acnes bizonyos betegségekkel kapcsolatos filotípusai képesek a testbeültetett implantátumokon és sebészeti eszközökön megmaradni, ami a posztoperatív fertőző állapotok széles skáláját okozza, például endokarditisz, endophthalmitisz és intravaszkuláris idegrendszeri fertőzések (Perry és Lambert, 2011; Portillo és mtsai., 2013). A P. acnes nemkívánatos tulajdonságai a prosztata mirigyre is kiterjednek, ahol a baktérium szöveti invázióját és intracelluláris lerakódását gyakran észlelték a mirigyhámsejtekben és a keringő makrofágokban; ez a jelenség feltételezhetően közvetve hozzájárul a jóindulatú prosztata hiperpláziához (BPH) és a prosztatarákhoz (Tanabe et al., 2006; Alexeyev et al., 2007; Fassi-Fehri et al., 2011; Mak et al., 2012; Bae et al., 2014; Davidsson et al., 2016). Nem világos azonban, hogy a P. acnes milyen mögöttes mechanizmusokat használ a bőrön kívüli fertőzés, gyulladás és/vagy áttétképződés kiváltására. Ami bizonyos bizonyossággal ismert, az az, hogy a baktériumokkal fertőzött keratinociták, sebociták és/vagy adipociták számos pro-inflammatorikus kemokint és citokint, valamint antimikrobiális faktorokat szekretálnak (pl, katelicidin), amelyek specifikus betegségmechanizmusokra utalnak (Graham et al., 2004; Nagy et al., 2006; Lee et al., 2010; Zhou et al., 2015; Sanford et al., 2016; Yu et al., 2016).
1. ábra. Az emberben a barrierhelyeken található gyakori mikrobák, köztük a P. acnes sematikus ábrázolása. Bár a P. acnes minden külső és belső felületen jelen van (pl. száj- és gyomor-bélrendszeri hámrétegek, kötőhártya), az emberi bőrön a legelterjedtebb. Ott az arc és a hát szőrtüszőiben él, ahol a gyakori bőrbetegséggel, az acne vulgarisszal hozható összefüggésbe. A P acnes-t a legtöbben még mindig többnyire jóindulatú és komensális mikroorganizmusnak tartják, azonban egyre több a rosszindulatú opportunista oldaláról szóló jelentés. Adaptálva és a Bryan Christie Design (http://bryanchristiedesign.com/) szíves engedélyével.
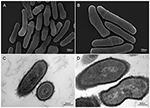
2. ábra. Pásztázó és transzmissziós elektronmikroszkópos (SEM és TEM) képek a P. acnes KPA törzsről (A, B = SEM; C, D = TEM). Az izolálási és tenyésztési technikák legújabb fejlődése azt mutatja, hogy a P. acnes-fertőzéseket durván alábecsülték, új megvilágításba helyezve ezt az opportunista baktériumfajt. Mikroszkópos felvételek: Volker Brinkmann, Max Planck Infekcióbiológiai Intézet, Berlin, Németország. Skálasáv = 200/300nm.
Sarkoidózis
A szarkoidózis ismeretlen etiológiájú betegség, amely gyulladáshoz vezet olyan különböző szervekben, mint a tüdő, a máj, a bőr és a nyirokerek. A szarkoidózis és a P. acnes feltételezett kapcsolatát először akkor javasolták, amikor a baktériumot a bőr és a nyirokcsomók szarkoidos elváltozásaiból izolálták (Eishi és mtsi., 2002; Yamada és mtsi., 2002). Ezeket az eredményeket jelentősen megerősítették (de Brouwer és mtsai., 2015), és tovább bővítették különböző in vitro kísérletekkel, amelyek a P. acnes inváziós képességét mutatták ki HEK293T (humán embrionális vese) és A549 (humán alveoláris epithelialis karcinóma) sejtvonalakban (Tanabe és mtsai., 2006). Legutóbbi munkák szarkoid broncho-alveoláris lavage (BAL) folyadékban és sejtekben a P. acnes-specifikus immunválasz jelentős felszabályozását mutatták (Schupp és mtsai., 2015). Emellett egereken végzett kísérletek kimutatták, hogy az életképes P. acnes a szarkoidózisos betegeknél megfigyeltekhez hasonló tüdőgranulómákat képes előidézni (Werner és mtsai., 2017). A szarkoidózis és a P. acnes közötti kapcsolatot részletező általános áttekintést ad továbbá Eishi (2013).
A P. acnes által a fertőzés során aktivált jelátviteli útvonalak jellemzésére irányuló vizsgálatok kimutatták, hogy a nukleáris faktor-kappaB , az immun- és gyulladásos kaszkádokban részt vevő gének expresszióját szabályozó transzkripciós faktor aktiválódik a P. acnes által (Kim és mtsi., 2002). Tágabb értelemben a toll-like receptor 2 (TLR2) a P. acnes-re adott NF-κB-függő válasz kritikus receptorának bizonyult, ami megmutatta, hogy ez a baktérium képes a veleszületett immunitás génjeinek szelektív aktiválását kiváltani (Inohara és Nuñez, 2001; Chamaillard és mtsai., 2003; Moreira és Zamboni, 2012). Továbbá a gazdagenetika szerepét vizsgálták a P. acnes-fertőzéssel összefüggésbe hozott szarkoidózisos esetekben. A NOD1 és NOD2 fehérjék nukleotidkötő oligomerizációs doménjében (NOD) található egynukleotid-polimorfizmusok (SNP-k) 73 szarkoidózisos beteg 52 intersticiális tüdőgyulladással és 215 egészséges kontrollszemély között korreláltak a P. acnes-fertőzéssel (Tanabe és mtsi., 2006). A NOD1 és NOD2 intracelluláris mintafelismerő receptorok, amelyek képesek érzékelni a bakteriális molekulákat, például a peptidoglikán-részeket. Ugyanezen a vonalon in vitro kísérletek kimutatták, hogy a P. acnes internalizációja HEK293T sejtekbe a NOD1 és NOD2 aktivációját eredményezheti, ami krónikus gyulladáson vagy helyi immunszuppresszión alapuló betegségmechanizmusra utal (Tanabe és mtsai., 2006). Ezek az eredmények arra is utalnak, hogy az invazív P. acnes bakteriális ligandumként hatva aberrált NOD-receptor-aktivációt okozhat bizonyos, a szarkoidózisra tartósan hajlamos egyéneknél. A jövőbeli kísérleteknek azonban tisztázniuk kell a pontos mechanisztikus kronológiát, hogy a P. acnes által közvetített aberráns NF-κB-aktiváció NOD1/NOD2-függő módon indukálhatja-e vagy sem a granuloma kialakulását.
Noha az invazív P. acnes a szarkoidózis és talán más betegségek lehetséges etiológiája lehet, az ok-okozati összefüggések tisztázása és a P. acnes fertőzés és a patológia között homályos, mivel a baktériumtörzsek heterogenitását, a gazdaszervezet genetikáját és a gazdaszervezet környezetét is figyelembe kell venni, amikor egy tanulmány a mikrobiomot egy betegséggel hozza összefüggésbe.
Benignus prosztata hiperplázia (BPH) és prosztatarák
A BPH és a prosztatarák progressziójában régóta szerepet játszanak a krónikus vagy visszatérő gyulladásos folyamatok (De Marzo et al., 1999; Nelson és mtsai., 2004; Sfanos és mtsai., 2014). A gyulladást olyan specifikus biomarkerek jelenlétének tulajdonítják, mint az emelkedett interleukin (IL)-6, tumor nekrózis faktor alfa (TNFα) és az akut fázisú fehérje, a C-reaktív fehérje (Mechergui és mtsi., 2009; Menschikowski és mtsi., 2013; Yu és mtsi., 2015). Az urológiai folyadékokkal (azaz vizelettel, ondófolyadékkal, prosztata váladékkal), valamint prosztata biopsziákkal kapcsolatos legújabb munkák arra utalnak, hogy bizonyos mikrobafajok jelentős kondicionális eltolódást mutatnak, amelyek diagnosztikai indexként használhatók (Yu et al., 2015; Ni et al., 2016).
Szép számú munka utal arra, hogy a P. acnes specifikus társulása a prosztatával és különösen a prosztata epitélsejtek inváziója (3. ábra) hozzájárulhat a BPH vagy a prosztatarák gyulladásos komponensű patológiájához (Sfanos et al., 2013; Davidsson et al., 2016). Jelenleg azonban nem világos, hogy a P. acnes a prosztata valódi fertőző ágensét, komensális vagy véletlenszerű prosztatamikrobiót képvisel-e. Valószínűsíthető, hogy a prosztatában lokalizált P. acnes a bőrből származik, amely véletlenül kerül be, például prosztata-biopszia során – ez a nézőpont aggodalomra ad okot bizonyos diagnosztikai munkaforgatókönyvekkel kapcsolatban.
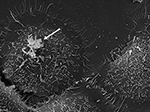
3. ábra. P. acnes P6 törzs (nyíl) SEM in vitro tenyésztett prosztata epitélsejteken RWPE1. A P. acnes prosztata epitélsejt-invazív viselkedése jól dokumentált mind in vivo, mind sejtalapú vizsgálatokban, ahol a vimentin által közvetített inváziós folyamat valószínűsíthető (Mak és mtsai., 2012). Mikroszkópos felvételek: Volker Brinkmann, Max Planck Infekcióbiológiai Intézet, Berlin, Németország. Méretsáv = 2 μm.
A bejutási útvonaltól vagy a patogén potenciáltól függetlenül, a BPH miatt végzett transzurethrális reszekció vagy a rák miatt végzett radikális prosztatektómia során nyert prosztataszövetek jelentős részét korábban pozitívan vizsgálták a P. acnes aggregátumokra, amelyek nyilvánvalóan a vándorló makrofágokban tartózkodnak (Alexeyev et al., 2007; Bae et al., 2014). Humán mintákon alapuló további jelentések további bizonyítékot szolgáltattak a BPH vagy a prosztatarák és a P. acnes közötti kapcsolatra, különböző technikai megközelítésekkel, többek között tenyésztéssel, konfokális mikroszkópiával a baktérium láthatóvá tételére és in situ hibridizációval, immunhisztokémiával (4. ábra) és a baktérium 16S rRNS PCR-alapú profilalkotásával (Hochreiter és mtsi., 2000; Cohen és mtsi., 2005; Sfanos és mtsi., 2008; Fassi-Fehri és mtsi., 2011; Bae és mtsi., 2014; Davidsson és mtsi., 2016). További bizonyítékok származnak állatkísérletekből, amelyek szerint a P. acnes beoltása egér vagy patkány prosztatába és húgyhólyagba nyílt, hosszú távú gyulladásos reakcióhoz és a prosztata mirigyben a sejtek széles skáláját érintő zavarokhoz vezet (Olsson et al., 2012; Shinohara et al., 2013).
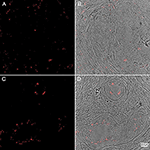
4. ábra. P. acnes antitesttel (piros) festett humán prosztata szövetminták immunhisztokémiai vizsgálata. A Fassi-Fehri és mtsai., 2011 (2B. kiegészítő ábra) engedélyével adaptálva. A P. acnes jelenléte humán prosztata szövetmintákban jóindulatú prosztata hiperpláziában (A,B); vagy adenokarcinómában (C,D). Mindkét esetben kiterjedt bakteriális terhelést mutattak ki.
A rákos prosztata mirigyekből származó, betegséggel összefüggő P. acnes törzsek filogenetikai elemzésére tett kísérletek azt mutatták, hogy a legtöbb prosztata izolátum olyan filogenetikai kládokba tartozik, amelyek az emberi bőrön ritkák, ami arra utal, hogy a mintavétel során bőrből származó szennyeződés nem valószínű (Mak et al., 2013; Davidsson et al., 2016). Ugyanezen a vonalon a szarkoidózis esetében leírtakhoz hasonló gyulladásos útvonalak, köztük az NF-κB, IL-6, STAT3 és COX2, úgy tűnik, hogy mind in situ, mind in vitro körülmények között aktiválódnak a P. acnes által (Drott et al., 2010; Fassi-Fehri et al., 2011; Mak et al., 2013; Tsai et al., 2013; Bae et al., 2014). Bár e gyulladásos változások pontos etiológiája még nem tisztázott, számos membránhoz kötött mintafelismerő receptor útvonal széles körben elterjedt az emlősök húgyúti és genitális rendszerében, amelyek mohón felismerik a bakteriális és vírusos komponenseket (Jorgensen és Seed, 2012; Gambara és mtsai., 2013). Ezek a gazdasejt-receptorok, például a TLR-ek, elősegítik a citokintermelést, amely a veleszületett immunitás alapvető jellemzője a mikrobiális kórokozókkal szemben. Ezek az eredmények együttesen arra utalnak, hogy az immunitás különböző aspektusait kiváltó képességük révén a betolakodó P. acnes a betegség súlyosságának elsődleges mozgatórugójaként és/vagy erősítőjeként működhet.
Spondylodiscitis és hátfájás
A P. acnes-t érintő számos posztoperatív szövődmény közül az egyik a porckorong és a környező csigolyaközi tér gyulladása (diskitis) a discectomiát követően (Harris és mtsi., 2005). A szomszédos csigolyák egyidejű degeneratív fertőzése (spondylodiscitis) gyakori tünet lehet, és késedelmes kezelés esetén súlyos neurológiai károsodás és fájdalom kiváltó oka lehet (Uçkay és mtsi., 2010). A nem szándékos műtéti behurcolás mellett közvetlenül a gerincoszlopba is érkezhetnek kórokozók az artériás és vénás gerincvelői vérellátáson keresztül (hematogén terjedés). Míg a Staphylococcus aureus, az Escherichia coli és a Proteus fajok izolálása a leggyakoribb, a P. acnes a leggyakoribb anaerob kórokozó ebben a kontextusban, és valószínűleg a tenyésztési kihívások miatt aluljelentett. Van némi klinikai bizonyíték arra, hogy az anaerob kórokozókkal általában, és különösen a P. acnes-szel fertőzött, porckorongsérvvel (nucleus pulposus) rendelkező betegeknél nagyobb valószínűséggel alakul ki a szomszédos csigolyák gyulladása és ödémája (Modic I. típusú elváltozások) és hátfájás (Albert et al., 2013; Urquhart et al., 2015). Klinikai és állatkísérletes követéses vizsgálatok mostanra megerősítik a kezdeti eredményeket, amelyek szerint a helyi P. acnes proliferáció a gyulladásos markerek upregulációját és a Modic-változásokkal összhangban lévő porckorongdegenerációt okoz (Aghazadeh és mtsai., 2016; Dudli és mtsai., 2016). Ma már az első klinikai bizonyítékok is arra utalnak, hogy a porckorong P. acnes és/vagy Staphylococcus epidermidis okozta bakteriális fertőzése valójában megelőzhet minden más problémát, mint a porckorongsérv és a kapcsolódó kóros elváltozások kiváltó oka (Rajasekaran et al., 2017).
Parkinson-kór (PD)
A degenerálódó agyat az idegi rendszer károsodása jellemzi, amely a mutáns vagy rosszul hajtogatott fehérjék (pl. Lewy-testek és Lewy-neuritok) atipikus aggregációjának és lerakódásának tulajdonítható, amint az idiopátiás PD-ben egyértelműen dokumentált (Taylor et al., 2002). Amit általában nem értékelnek, az az, hogy az agy is fogékony a behatoló kórokozókra a vírusoktól és baktériumoktól kezdve a gombákig. Ezek a kórokozók, pontosabban azok endogén összetevői és/vagy metabolitjai központi neurológiai hiányosságokat okozhatnak a demencia és a dystonia finom jeleitől kezdve, amelyek a krónikus, visszatérő fertőzésből erednek (De Chiara és mtsai., 2012; Bibi és mtsai., 2014), egészen a súlyosabb motorneuronbetegségekig, mint például a humán endogén K retrovírus esetében megfigyelhető (Li és mtsai., 2015). Egyértelmű tehát, hogy az embernek rendkívül nagy szisztémás mikrobaterhelése van (Potgieter és mtsai., 2015; Spadoni és mtsai., 2015), ami véletlenül hozzájárulhat az atipikus fehérjekomponensű progresszív neurodegeneratív betegségek patológiájához. Minden bizonnyal ez a munkahipotézis jelentős támogatást nyer, mivel úgy tűnik, hogy a kognitív, érzelmi vagy kóros viselkedést közvetve befolyásolja a bél-agy tengelyen keresztül ható mikrobák térbeli és személyi eloszlása (5. ábra) (Collins et al., 2012; Dinan et al., 2013; Mayer et al., 2014; Burokas et al., 2015). Valóban, egy nemrégiben végzett eset-kontroll vizsgálat kimutatta, hogy a gasztrointesztinális traktus mikrobiális variációja, mind az egyének között, mind az egyéneken belül; a legjelentősebb mértékben megfelel a PD fenotípusos eltéréseinek (Scheperjans és mtsai., 2015; Vizcarra és mtsai., 2015). Bár a mikrobióta összetételét a Parkinson-kórban jelentkező különbségekkel összekapcsoló mögöttes mechanizmusok nem tisztázottak, a fenti megállapítás legalábbis magyarázatot adhat a Parkinson-kórban szenvedő betegeknél megfigyelhető gasztrointesztinális eltérések magas prevalenciájára (Dobbs és mtsai., 2016). A mikrobióta és a PD súlyosságának további összekapcsolása érdekében a PD-betegektől gyűjtött szigmabélnyálkahártya-biopsziák és székletanyagok opportunista és pro-inflammatorikus baktériumfajok jelenlétét mutatták ki, amelyek gyakran okoznak krónikus székrekedést, irritábilis bél szindrómát és fekélyes vastagbélgyulladást (Keshavarzian és mtsi., 2015). Összességében ezek a kezdeti eredmények arra utalnak, hogy a bél különböző mikrobiális közösségei közötti kapcsolatok a Parkinson-kórban gyakori társbetegségnek számítanak, és hogy a bél ökoszisztémájának egyedi egyéni szignatúrái megerősíthetik a Parkinson-kór klasszikus motoros károsodásait.
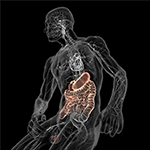
5. ábra. A bél-agy tengely sematikus ábrázolása (színezett), egyik végén a mikrobákkal teli emésztőrendszerrel, másik végén az agy a homeosztázisközpontokkal (hipotalamusz és hipofízis). Mindkettő a szív- és érrendszeri és a vegetatív idegrendszeren keresztül kapcsolódik egymáshoz, beleértve a vagusideget (X. koponyaideg), amely megkönnyítheti a mikrobák központi idegrendszerbe (CNS) való átjutását. A Bryan Christie Design (http://bryanchristiedesign.com/) engedélyével.
Ezzel a háttérrel kapcsolatban felmerül a kérdés, hogy van-e bizonyíték arra, hogy a P. acnes bármilyen szerepet játszik a Parkinson-kór patofiziológiájában. Ahhoz, hogy ez a lehetőség fennálljon, két feltételnek kell teljesülnie: (1) a P. acnes-fertőzésnek meg kell előznie a betegség klasszikus tüneteinek – mint a remegés, a motoros beindulás és a mozgás lassúsága – megjelenését; és (2) a P. acnes-beoltásnak kellőképpen elő kell idéznie a Parkinson-kór tüneteit és/vagy a substantia nigra pars compacta néven ismert középagyi magban a dopamin-projekciós neuronok elvesztéséhez kell vezetnie. Laboratóriumunk eddig a P. acnes klasztereit mutatta ki, amelyek a középagy és a közeli agykérgi struktúrák neuronjaira lokalizálódtak a boncolt PD-agyakban (6. ábra). Ez a váratlan felfedezés tovább erősíti a P. acnes közvetett hozzájárulását a helyi gyulladásos rohamokhoz, hasonlóan a szarkoidózisban és a BPH-ban megfigyeltekhez. Nyitott kérdés, hogy a P. acnes milyen mértékben fokozhatja közvetve a Parkinson-kór bizonyos patológiai jellemzőit. Mivel a PD rendkívül heterogén betegség, nem valószínű, hogy egyetlen betegségmechanizmus alkalmazható az összes PD-fenotípusra. Mindazonáltal érdekes a feltételezés, hogy a rezidens bőrmikrobák gyulladásos és/vagy genetikai hajlamosító tényezőkön keresztül kezdeményezhetik vagy felerősíthetik a PD progresszióját.

6. ábra. Immunhisztokémia humán PD középagyi szövetminták P. acnes (zöld; A+B), neuronális mikrotubulusok (MAP2; piros; A) és sejtmagok (DAPI; kék; A+B) festése. Az életkorhoz kötődő lipofuszcin autofluoreszcenciát Sudan Black B-vel oltottuk ki. P. acnes jelenléte (nyíl) egy emberi neuron (A) periplazmatikus terében a sejtmag (n) és a citoszkeleton között; vagy neutrofil (B) a jellegzetes, több lebenyes sejtmaggal egy középagyi kapillárisban (Cap). Ezek a leletek a Parkinson-kórra jellemzőek, és a legtöbb kontrollmetszetben hiányoznak. A koponyaidegek mentén történő retrográd mozgás, a trauma által kiváltott mikrovérzések, valamint az újonnan felfedezett glymphaticus rendszer potenciális mikrobiális útvonalakat jelentenek a CNS-be.
Ha a P. acnes hozzáférhet a középagyban lévő dopaminsejtekhez, mi a legvalószínűbb beoltási és fertőzési útvonal? Bár a bőr fizikailag elkülönül az agytól, a keresztfertőzés továbbra is kockázati tényező marad. Például a nazális szervek potenciálisan hordozhatnak patogén P. acnes törzseket, amelyek aztán transzlokálódnak az agyi parenchimába, hogy hiperaktiválják a helyi makrofágokat, az úgynevezett mikrogliákat; ez a jelenség a PD patológiájának következetes jellemzője (áttekintés: Chao és mtsai., 2014). A nosokomiális fertőzésekkel kapcsolatos kutatások azt mutatják, hogy olyan különböző baktériumfajok, mint a Pneumococcus sp. (Zwijnenburg et al., 2001) és a Salmonella sp. (Bollen et al., 2008) könnyen vándorolnak a szaglóideg (1. agyideg; CN 1) mentén és végül a szaglógumóba. A káros mikrobák vagy a veszélyes félrecsúszott fehérjék másik lehetséges bejutási útvonala a nervus vagus (nervus cranialis 10; CN 10). Bizonyos körülmények között ugyanis úgy tűnik, hogy a Lewy-testek és Lewy-neuritok formájában a rosszul összecsomósodott aggregátumok a vagusidegből az agyba vándorolnak, ami további bizonyítékot szolgáltat arra, hogy a kórokozó baktériumok toxikus fehérjékkel társulva potenciálisan hozzájárulhatnak a neuronok szelektív sebezhetőségéhez (Holmqvist és mtsai., 2014). Érdekesség, hogy a CN 1 és a CN 10 agyi magjai az elsők között vannak, ahol a Parkinson-kór progressziója során preferenciálisan Lewy-testek és Lewy-neuriták lerakódása figyelhető meg (Braak és mtsai., 2004). Ez a különleges megfigyelés nemcsak a baktériumok agyba való valószínű bejutási útvonalára világít rá, hanem egy lehetséges mechanizmust is biztosít ahhoz a megfigyeléshez, hogy a truncus vagotomia jelentősen csökkenti a PD kockázatát (Svensson és mtsai., 2015). A fejsérülés és a PD közötti kapcsolat (Harris et al., 2013; Jafari et al., 2013; Pearce et al., 2015), valamint a változatos vérmikrobiom fogalma (Potgieter et al., 2015) a patogén opportunizmus hatalmas potenciálját feltételezi a vér-agy gát traumás sérülésekor. Az agyi nyirokrendszer (glimphatikus) rendszer közelmúltbeli felfedezésével (Iliff és mtsai., 2012; Hitscherich és mtsai., 2016) az agyi fertőzés egy másik lehetséges útvonalát is figyelembe kell venni.
Ezzel együtt preklinikai és néhány klinikai bizonyíték van arra, hogy a P. acnes közvetve a PD előfordulását vagy súlyosságát befolyásoló független változóként szerepel. Ezt a bizonyítékot kiegészítik azok a jelentések, amelyek egy súlyos bőrbetegséget, az acne inversa-t az Alzheimer-kórral hozzák összefüggésbe (Wang és mtsai., 2010). Terápiás szempontból az a lehetőség, hogy a P. acnes kiváltja vagy felerősíti a Parkinson-kór fő jellemzőit, fontos forrást jelent a neurodegeneratív betegségek antibiotikus megközelítései számára. Kutatási szempontból pedig érdemes lenne alaposabban megvizsgálni a bőrbetegségben szenvedő betegeket a korábban kezdődő és súlyosabb betegségfenotípussal járó neuropatológia bizonyítékai szempontjából.
Jövőbeli kilátások
A cikkben bemutatott áttekintés a P. acnes egy váratlan sötét oldalát vázolja fel a patológia tekintetében. A P. acnes intracelluláris perzisztenciája szerepet játszik a tüdő és a prosztata, esetleg az agy megbetegedéseiben. Ez egyértelmű bizonysága a bőrből származó baktériumok patogenitásának bizonyos betegségfenotípusokban. A további vizsgálatoknak a P. acnes biológiájának számos felmerülő kérdésére kell összpontosítaniuk: (1) Melyek a betegségre való fogékonyság szempontjából döntő fontosságú P. acnes kölcsönhatások? (2) Milyen mechanizmusokkal befolyásolja a P. acnes a betegség progresszióját? (3) Ha a P. acnes bizonyos populációi fokozhatják a betegség súlyosságára való fogékonyságot, vannak-e más P. acnes-konfigurációk, amelyek védelmet nyújtanak? (4) Annak bizonyítása, hogy a P. acnes-fertőzés közvetlenül összefügg a betegség patológiájával, vagy pontosabban: a koncepció vizsgálata okozati összefüggést vagy csak korrelációt mutat? És végül (5) Kezelhető-e a P. acnes okozta betegségpatológia hagyományos antibiotikus terápiával és diagnosztikai alkalmazásokkal?
A szerzők hozzájárulása
JL, KER, JC, KR, CH, AM, HB és GT készítette a kéziratot. JL és MS készítette az ábrákat.
Finanszírozás
JL számára a NYIT College of Osteopathic Medicine nyújtott intramurális finanszírozást.
Erdekütközési nyilatkozat
A szerzők kijelentik, hogy a kutatást olyan kereskedelmi vagy pénzügyi kapcsolatok hiányában végezték, amelyek potenciális érdekellentétként értelmezhetők lennének.