Trend 2: Adott központi atomú oxosavak esetében a savasság a központi elem oxidációs állapotával, vagyis a központi atomhoz kötött oxigének számával növekszik.
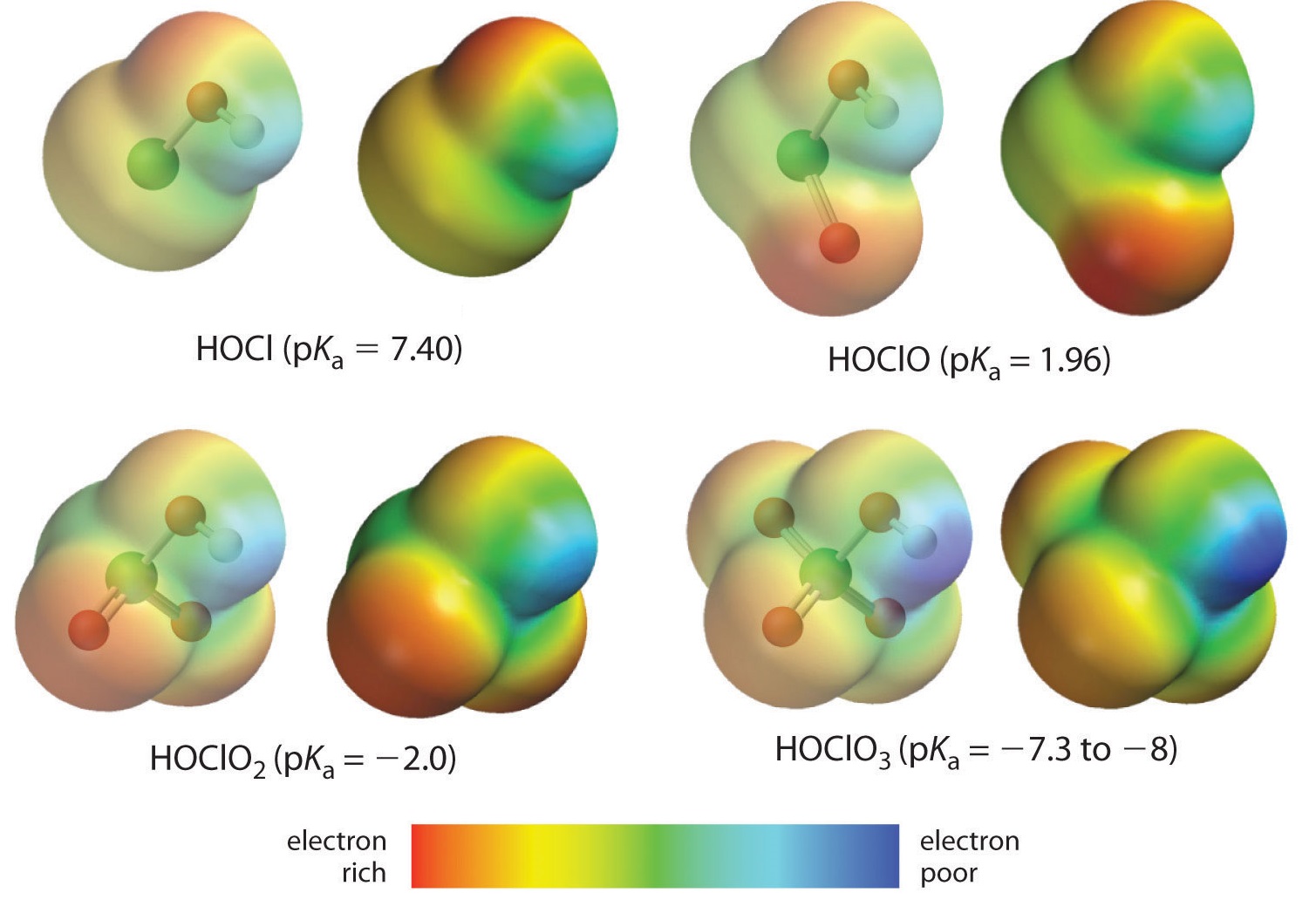
Itt olyan savakra vonatkozó tendenciát vizsgálunk, amelyekben az adott központi atomhoz változó számú oxigén kapcsolódik. Erre példa a perklórsav (\(\ce{ClO_4^{-}}}\)), klórsav (\(\ce{ClO_3^{-}}}\)), klóros (\(\ce{ClO_2^{-}}}\)) és hipoklóros (\(\ce{ClO^{-}}}\)) savsorozat. Az ilyen sorozatokban minél nagyobb az oxigének száma, annál erősebb a sav. Ez többféleképpen magyarázható. Magának a savnak a szempontjából a kulcstényező ismét az induktív hatás, ebben az esetben a központi atomhoz kapcsolódó oxigének azon képessége, hogy az OH-kötésen keresztül elektron-sűrűséget vonzanak. Ez látható a \(\PageIndex{1}\) ábrán látható klór-oxosavak töltéssűrűségdiagramjából, ahol a savas hidrogén részleges pozitív töltése a jelenlévő oxigének számával növekszik.
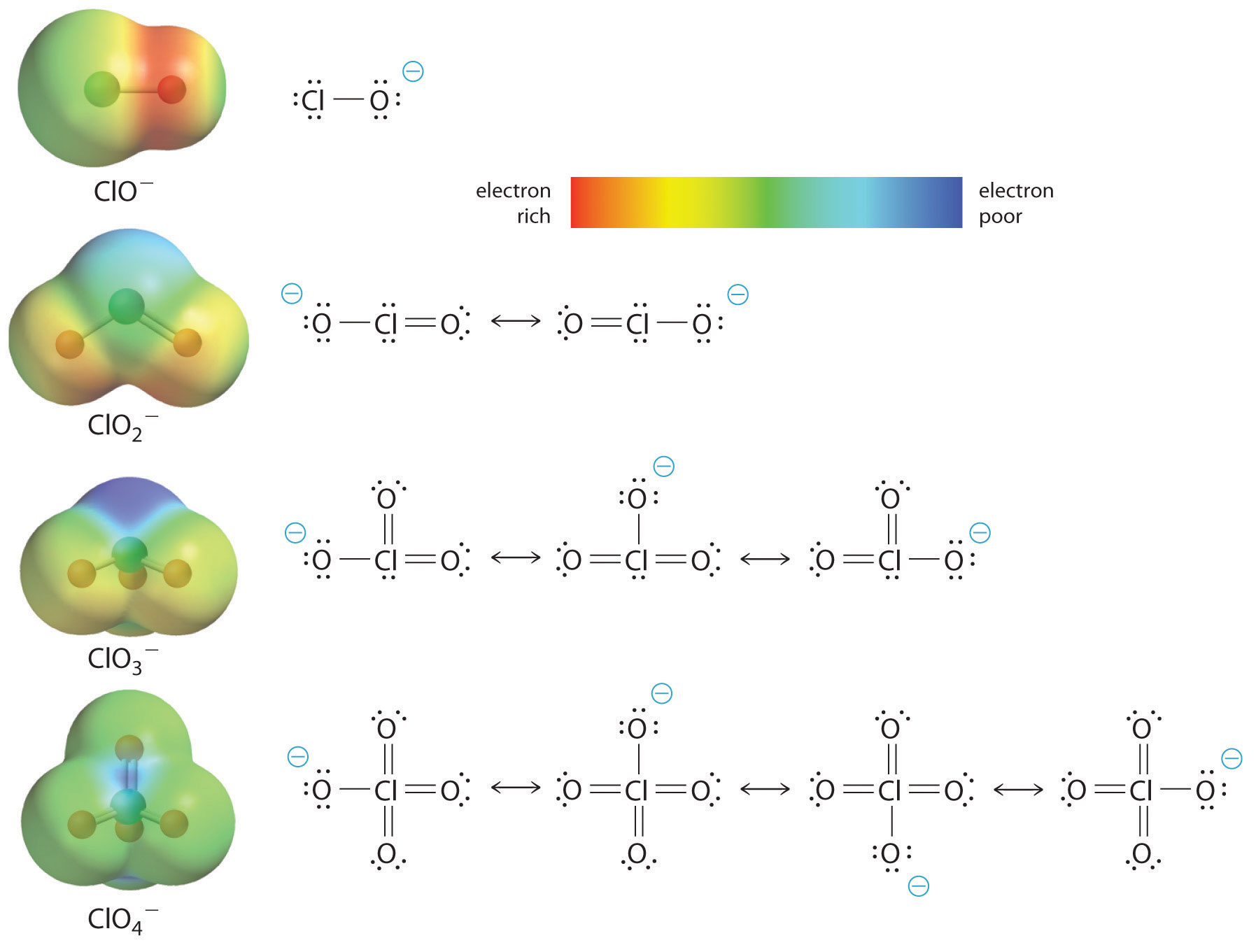
Az oxosav savasságának növekedése a központi atomhoz kötött oxigének számával a konjugált oxianion stabilitását vizsgálva is látható. Hogy a konjugált bázis stabilitása az oxigének számával nő, az \(\PageIndex{2}\) ábrán látható klór-oxianionok töltéseloszlási diagramjaiból és Lewis-féle kötésmodelljeiből is látható. Ahogy a negatív töltés egyre több oxigénatomra oszlik el, úgy válik egyre diffúzabbá.
gyakorlat \(\PageIndex{1}\)
A kén és a szelén egyaránt \(\ce{H_2EO_4}\) képletű oxosavakat alkot, ahol E vagy S vagy Se. Ezeket kénsavnak, illetve szelénsavnak nevezzük. Melyik oxosavnak kellene savasabbnak lennie: a szelénsavnak vagy a kénsavnak?
Válasz
A kénsavnak savasabbnak kell lennie. Mivel a kén elektronegatívabb, mint a szelén, a kén nagyobb mértékben polarizálja az OH-kötéseket, így azok savasabbak lesznek. Ezt az előrejelzést igazolja a savak \(pK_a\) értékeinek összehasonlítása:
| Sav | \(pK_{a1}\) | \(pK_{a2}\) |
|---|---|---|
| kénsav, \(H_2SO_3\) | 1.85 | 7.2 |
| szelénsav, \(H_2SeO_3\) | 2.62 | 8.32 |