ForbrændingEdit
Som de fleste andre kulbrinter kan umættede kulbrinter gennemgå forbrændingsreaktioner, der producerer kuldioxid og vand ved fuldstændig forbrænding. Reaktionsligningen er:
- CxHy + y+4x/4O2 → y/2H2O + xCO2
I mangel af ilt vil forbrændingen blive til ufuldstændig forbrænding og producere kulilte og kulstof.
De umættede kulbrinter vil lettere producere et ufuldstændigt forbrændingsprodukt end de mættede. Som følge heraf har forbrændingen af umættede kulbrinter normalt en gul flamme, som adskiller sig fra den blå flamme for de mættede kulbrinter. Dette tyder på, at forbrænding af umættede kulbrinter involverer flertrinsmekanismer, og at forbrændingen af kulstof giver den gule flammefarve.
Da umættede kulbrinter har et mindre hydrogenindhold, vil de producere mindre vand og mindske flammens fugtighed samt mindske iltforbruget. Acetylen(ethylen) kan f.eks. anvendes som brændstof.

I forhold til de enkelte σ C-C-bindinger i de mættede kulbrinter har de umættede elektronetæthed i π-bindingerne, som ikke har meget elektronetæthed overlappende som σ-bindingerne. Som følge heraf er den kemiske energi, der er lagret i en dobbeltbinding, mindre end i to enkeltbindinger. Ved forbrænding af umættede kulbrinter, som bryder kulstof-kulstof-bindingerne for at frigøre energi, frigøres der således mindre energi end ved forbrænding af samme molaritet af mættede kulbrinter med samme antal kulstofatomer. Denne tendens kan tydeligt ses i listen over standardforbrændingsenthalpi for kulbrinter.
| Antal kulstof | Substans | Type | Formel | Hcø(kJ/mol) |
|---|---|---|---|---|
| 2 | ethan | mættet | C2H6 | -1559.7 |
| ethene | umættet | C2H4 | -1410.8 | |
| ethyn | umættet | C2H2 | -1300.8 | |
| 3 | propan | mættet | CH3CH2CH3 | -2219.2 |
| propen | umættet | CH3CH=CH2 | -2058.1 | |
| propyn | umættet | CH3C≡CH | -1938.7 | |
| 4 | butan | umættet | CH3CH3CH2CH2CH2CH3 | -2876.5 |
| but-1-ene | umættet | CH2=CH-CH2CH3 | -2716.8 | |
| but-1-yne | umættet | CH≡C-CH2CH3 | -2596.6 |
Elektrofil additionRediger
Dobbelt- eller trippelbindingerne, der skal være til stede i umættede kulbrinter, giver en høj elektrontæthed, der gør molekylerne til perfekte steder for elektrofil additionsreaktioner. I denne type reaktion vil en π-binding mellem kulstofferne blive brudt op i 2 separate σ-bindinger mellem hvert kulstof og den tilføjede gruppe. Et karbokationsintermediat er normalt involveret i mekanismen.
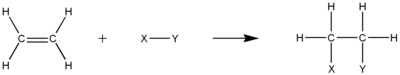
HydrogeneringRediger
Hydrogenering er elektrofil addition af hydrogengas til umættet kulbrinte. Resultatet vil være et mere mættet kulbrinte, men bliver ikke nødvendigvis et mættet kulbrinte. F.eks. kan halvhydrogenering af et alkyn danne danne et alken. Ikke desto mindre skal det samlede antal π-bindinger falde i processen. π-kulstof-kulstofbindingen er også nødvendig for denne proces.
Reaktionsligningen for hydrogenering af ethen til ethan er:
- H2C=CH2 + H2→H3C-CH3
Hydreringsreaktionen kræver normalt katalysatorer for at øge dens hastighed.
Det samlede antal hydrogen, der kan tilsættes til et umættet kulbrinte, afhænger af dets umættelsesgrad. Et umættet carbonhydrid med formlen CXHY kan højst få tilsat 2X+2-Y hydrogenatomer. Dette vil få molekylet til at blive mættet.
HalogeneringRediger
Som ved hydrogen vil heterolysen af halogen(X2) producere en elektrofil X+-ion, hvorefter den vil blive angrebet af elektronen på π-bindingen. Til forskel fra hydrogen vil halogenering producere haloniumioner som mellemprodukt i stedet for carbocationer i de fleste andre tilfælde. Haloniumkationen efterlader begrænset plads for X-ionen til at angribe og vil kun blive til et transprodukt. Nettoresultatet af halogenering er en reduktion af en π-binding og en forøgelse af to kulstof-halogen σ-bindinger på de 2 kulstofatomer.

Reaktionsligningen for bromaddition af f.eks. ethen er:
- H2C=CH2 + Br2→H2CBr-CH2Br (trans)
Bromtest anvendes til at teste mætningen af kulbrinter. Testen indebærer, at der tilsættes bromholdigt vand til det ukendte kulbrinte; hvis bromholdigt vand dekolouriseres af kulbrinten, hvilket skyldes en halogeneringsreaktion, kan det konkluderes, at kulbrinten er umættet. Hvis det ikke dekolouriseres, er det mættet.
Bromtesten kan også anvendes som en indikation af umættethedsgraden for umættede kulbrinter. Bromtal er defineret som gram brom, der er i stand til at reagere med 100 g produkt. I lighed med hydrogenering afhænger halogeneringen af brom også af antallet af π-bindinger. Et højere bromtal indikerer en højere grad af umætning.
HydreringRediger
Den π-binding af umættede carbonhydrider er også klar til at modtage H+ og OH- fra vand. Reaktionen involverer normalt stærk syre som katalysator. Det skyldes, at det første trin i hydreringsmekanismen indebærer, at π-bindingen deprotonerer et H+ fra den stærke syre for at danne en carbocation. Nettoresultatet af reaktionen vil være en alkohol.
Reaktionsligningen for hydrering af ethen er:
- H2C=CH2 + H2O→H3C-CH2OH
Den π-bindinger i tripelbindinger er også i stand til at gå under hydrering i sur tilstand og danne enoler. Enolen vil dog ikke være et produkt, men et mellemprodukt, og det endelige produkt vil være en keton. Enol-mellemproduktet går under tautomerisering og danner den mere stabile keton.
Reaktionsligningen for hydrering af ethin til dannelse af acetaldehyd er:
- HC≡CH + H2O → H2C=CH-OH
- H2C=CH-OH ⇌ H3C-CHO
HydrohalogeneringRediger
Hovedartikel: Hydrohalogenering
 Eksempel på hydrohalogenering: Addition af HBr til en alken
Eksempel på hydrohalogenering: Addition af HBr til en alken

Hydrohalogeneringen indebærer addition af H-X til umættede carbonhydrider. Dette vil reducere en π C=C-binding og resultere i 2 C-H- og C-X σ-bindinger med 2 separate kulbrinter. Dannelsen af den intermediære carbocation er selektiv og følger Markovnikovs regel. Hydrohalogenering af alken vil resultere i haloalkan, og hydrohalogenering af alkyn vil resultere i vinylhalogenid. Hydrohalogenering af alkyne er meget langsommere end alken.
Reaktionsligningen for HBr-tilsætning til ethen er:
- H2C=CH2 + HBr→H3C-CH2Br
OxidationRediger

Oxidation af umættede carbonhydrider afhænger af oxidationsmidlets styrke. Et svagt oxidationsmiddel vil føre til dihydroxylering, fjernelse af en π-binding til dannelse af to σ-bindinger med oxygen. Dihydroxylering af alken giver diol, og dihydroxylering af alkyn giver vicinal dicarbonyl.
Et stærkere oxidationsmiddel, f.eks. KMnO4 eller ozon, vil føre til oxidativ spaltning. I dette tilfælde knækker π-bindingen sammen med σ-bindingen og deler kulbrintemolekylet i to. Ilt binder sig med de resterende to π-bindinger hver for sig. Oxidativ spaltning af alken producerer ketoner eller aldehyder, afhængigt af dobbeltbindingens placering, og spaltning af alkyner producerer carboxylsyre.
Allylisk substitutionRediger
π-bindingen i umættede kulbrinter vil sænke dissociationsenergien for de allyliske C-H-bindinger, som er C-H-bindinger af det kulstof, der støder op til sp2-kulstofferne. Som følge heraf vil den frie radikale substitutionsreaktion blive favoriseret frem for additionsreaktionerne.
Et eksempel på dette er NBS bromeringsreaktionen med alken. N-Br-bindingen i NBS er svag, så der vil blive dannet mange frie Br-radikaler. Det frie radikal vil angribe de svækkede allyliske hydrogener og erstatte dem med bromatomer. Reaktionsligningen er:
- RCH2CH=CH2 + (CH2CO)2NBr → RCHBrCH=CH2 + RCH=CHCHCHCH2Br + (CH2CO)2N
Reaktionen vil frembringe to isomerer med brom knyttet til forskellige kulbrinter. Reaktionen kræver en stor mængde frie Br-radikaler i stedet for elektrofile Br+-ioner, som vil gå under additionsreaktion. NBS er afgørende for at skabe en sådan tilstand.
Hvis kulbrintegrupper er knyttet til allylisk kulstof, vil det gøre dette kulstof mere mættet. I henhold til Zaitsevs regel vil dette kulstof danne et mere stabilt karbokationsintermediat. Som følge heraf vil der ske en allylisk omlægning, og π-bindingen vil flytte til dette kulstof. Dette vil give et hovedprodukt af brom substitueret til kulstoffet fire bindinger væk fra kulbrintegruppen.
CycloadditionRediger

For umættede kulbrinter kan ringstruktur og π-bindinger begge øge graden af umættethed, udveksling mellem ringstruktur og π-bindinger kan forekomme under særlige forhold. For eksempel vil der for en konjugeret dien og en substitueret alken forekomme en Diels-Alder-reaktion, der danner en cyclohexen. En sådan reaktion er meget selektiv i stereokemi.
Alkyner kan under metalkatalysatorer, f.eks. kobolt, også gennemgå en cycloadditionsreaktion kaldet alkyne trimerisering. Tre alkyner gennemgår en “2+2+2+2”-cykliseringsreaktion og slutter sig hurtigt sammen til en benzen. trimerisering af forskellige alkener er normalt ikke selektiv, men specielt konstruerede katalysatorer kan øge selektiviteten.
Reagerer som ligandRediger

Den delokaliserede π-binding i umættede kulbrinter giver høj elektrontæthed, hvilket gør det muligt for molekylet at blive en metalligand. I alkenligand kan bindingsstrukturen beskrives ved Dewar-Chatt-Duncanson-modellen. I dette tilfælde doneres π-elektrontætheden til metallets d-orbitaler. Jo stærkere donationen er, jo stærkere er den tilbagevendende binding fra metallets d-orbital til π*-antibindingsorbitalet i alkenenet. Denne effekt reducerer alkenens bindingsorden og øger C-C-bindingens længde. Som følge heraf danner metallet en lille ringstruktur med de to kulbrinter.
DDCD-modellen kan også beskrive alkneligandstrukturen. Metalkomplekset kan også være mellemprodukt for trimerisering af alkyner, så metaller kan være katalysatorer for reaktionen.
Syntesen af alken-ligandkomplekser kan beskrives som en elektrofil additionsreaktion.
Som lineære umættede kulbrinter har arene også delokaliserede π-bindinger, der er i stand til at donere til metaller for at danne kompleks. I tilfælde som benzen donerer carbonerne lige meget elektron-tæthed til metallet, mens carbonerne i nogle andre tilfælde donerer forskelligt til metallet, hvilket får arenen til at bøje eller dearomatiseres.