Generisk navn: fluocinonide
Doseringsform: Gel
Medicinsk gennemgået af Drugs.com. Sidst opdateret den 22. juni 2020.
- Overblik
- Bivirkninger
- Dosering
- Professionel
- Interaktioner
- Mere
Rx Only
Mærket Lidex er blevet udgået i USA.USA. Hvis generiske versioner af dette produkt er blevet godkendt af FDA, kan der være generiske ækvivalenter til rådighed.
- Lidex Beskrivelse
- Lidex – Klinisk farmakologi
- Farmakokinetik
- Indikationer og anvendelse for Lidex
- Kontraindikationer
- Forsigtighedsregler
- Allmentalt
- Information til patienten
- Laboratoriske tests
- Carcinogenese, mutagenese og forringelse af fertiliteten
- Graviditetskategori C
- Sygeplejersker
- Pædiatrisk brug
- Bivirkninger
- Overdosering
- Lidex Dosering og administration
- Hvordan leveres Lidex
- Hyppigt stillede spørgsmål
- Mere om Lidex (fluocinonid aktuelt)
- Forbrugerressourcer
- Faglige ressourcer
- Relaterede behandlingsvejledninger
Lidex Beskrivelse
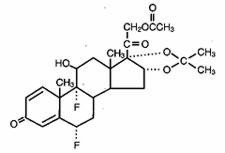
Lidex® (fluocinonid) Gel 0,05% er beregnet til topisk administration. Den aktive komponent er kortikosteroidet fluocinonid, som er 21-acetatesteren af fluocinolonacetonid og har det kemiske navn pregna-1,4-dien-3,20-dion,21-(acetyloxy)-6,9-difluoro-11-hydroxy-16,17–,(6α,11β,16α)-. Det har følgende kemiske struktur:
Lidex Gel indeholder fluocinonid 0,5 mg/g i en specielt formuleret gelbase bestående af carbomer 940, edetatdinatrium, popylgallat, propylenglycol, natriumhydroxid og/eller saltsyre (til justering af pH) og vand (renset). Dette klare, farveløse, thixotropiske medium er fedtfrit, ikke pletterende og fuldstændig vandblandbart.
I denne formulering er det aktive stof helt i opløsning.
Lidex – Klinisk farmakologi
Topiske kortikosteroider har en fælles antiinflammatorisk, antipruritisk og vasokonstriktiv virkning.
Mekanismen for den antiinflammatoriske aktivitet af de topiske kortikosteroider er uklar. Forskellige laboratoriemetoder, herunder vasokonstriktoranalyser, anvendes til at sammenligne og forudsige potenser og/eller kliniske virkninger af de topiske kortikosteroider. Der er noget, der tyder på, at der er en genkendelig sammenhæng mellem vasokonstriktorernes styrke og den terapeutiske effekt hos mennesker.
Farmakokinetik
Det perkutane absorptionsomfang af topiske kortikosteroider bestemmes af mange faktorer, bl.a. af mediumet, integriteten af den epidermale barriere og brugen af okklusive forbindinger.
Topiske kortikosteroider kan absorberes fra normal intakt hud. Inflammation og/eller andre sygdomsprocesser i huden øger den perkutane absorption. Okklusive forbindinger øger den perkutane absorption af topiske kortikosteroider betydeligt. Således kan okklusive forbindinger være et værdifuldt terapeutisk supplement til behandling af resistente dermatoser (se DOSERING OG ADMINISTRATION).
Når de topiske kortikosteroider er absorberet gennem huden, håndteres de via farmakokinetiske veje svarende til systemisk administrerede kortikosteroider. Kortikosteroider er bundet til plasmaproteiner i varierende grad. Kortikosteroider metaboliseres primært i leveren og udskilles derefter af nyrerne. Nogle af de aktuelle kortikosteroider og deres metabolitter udskilles også i galde.
Indikationer og anvendelse for Lidex
Lidex Gel er indiceret til lindring af de inflammatoriske og pruritiske manifestationer af kortikosteroidresponsive dermatoser.
Kontraindikationer
Topiske kortikosteroider er kontraindiceret hos de patienter, der tidligere har haft overfølsomhed over for nogen af præparatets bestanddele.
Forsigtighedsregler
Allmentalt
Systemisk absorption af topiske kortikosteroider har hos nogle patienter givet reversibel undertrykkelse af hypothalamus-hypofyse-binyreaksen (HPA-aksen), manifestationer af Cushings syndrom, hyperglykæmi og glukosuri.
Betingelser, der øger den systemiske absorption, omfatter anvendelse af de mere potente steroider, anvendelse over store overflader, langvarig anvendelse og tilføjelse af okklusive forbindinger.
Derfor bør patienter, der modtager en stor dosis af et potent aktuelt steroid, der anvendes på et stort overfladeareal eller under en okklusiv forbinding, evalueres med jævne mellemrum for tegn på HPA-akse-suppression ved hjælp af test for fri cortisol i urinen og ACTH-stimuleringstest. Hvis der konstateres HPA-akse-suppression, skal man forsøge at trække lægemidlet tilbage, reducere hyppigheden af påføringen eller erstatte det med et mindre potent steroid.
Genoprettelse af HPA-aksefunktionen er generelt hurtig og fuldstændig ved ophør af lægemidlet. Der kan sjældent forekomme tegn og symptomer på steroidafvænning, som kræver supplerende systemiske kortikosteroider.
Børn kan optage forholdsmæssigt større mængder af topiske kortikosteroider og dermed være mere modtagelige for systemisk toksicitet (se PRÆCAUTIONER – Pædiatrisk brug). Hvis der udvikles irritation, skal topiske kortikosteroider afbrydes og passende behandling iværksættes.
Som med alle topiske kortikosteroidprodukter kan langvarig brug medføre atrofi af hud og subkutant væv. Ved anvendelse på intertriginøse eller bøjede områder eller i ansigtet kan dette forekomme selv ved kortvarig brug.
Ved tilstedeværelse af dermatologiske infektioner skal der iværksættes brug af et passende svampedræbende eller antibakterielt middel. Hvis der ikke omgående indtræder et gunstigt respons, skal kortikosteroidet seponeres, indtil infektionen er tilstrækkeligt kontrolleret.
Information til patienten
Patienter, der anvender topiske kortikosteroider, skal modtage følgende oplysninger og instruktioner:
- Denne medicin skal anvendes som anvist af lægen. Den er kun til udvortes brug. Undgå kontakt med øjnene.
- Patienter skal rådes til ikke at bruge denne medicin til andre lidelser end den, som den er ordineret til.
- Det behandlede hudområde må ikke forbindes eller på anden måde dækkes eller pakkes ind, så det bliver okklusivt, medmindre lægen har anvist det.
- Patienter skal rapportere ethvert tegn på lokale bivirkninger, især under okklusiv forbinding.
- Forældre til pædiatriske patienter skal rådes til ikke at bruge tætsiddende bleer eller plastikbukser på et barn, der behandles i bleområdet, da disse beklædningsgenstande kan udgøre okklusive forbindinger.
Laboratoriske tests
Følgende tests kan være nyttige ved vurdering af HPA-akse-suppressionen:
Test for frit kortisol i urinen
ACTH-stimuleringstest
Carcinogenese, mutagenese og forringelse af fertiliteten
Langtidsforsøg på dyr er ikke blevet udført for at vurdere det carcinogene potentiale eller virkningen på fertiliteten af topiske kortikosteroider.
Studier til bestemmelse af mutagenicitet med prednisolon og hydrokortison har vist negative resultater.
Graviditetskategori C
Kortikosteroider er generelt teratogene hos forsøgsdyr, når de indgives systemisk i relativt lave doser. De mere potente kortikosteroider har vist sig at være teratogene efter dermal anvendelse hos forsøgsdyr. Der findes ingen tilstrækkelige og velkontrollerede undersøgelser hos gravide kvinder af teratogene virkninger af topisk påførte kortikosteroider. Derfor bør topiske kortikosteroider kun anvendes under graviditet, hvis den potentielle fordel berettiger den potentielle risiko for fosteret. Lægemidler af denne klasse bør ikke anvendes i stor udstrækning på gravide patienter, i store mængder eller i længerevarende perioder.
Sygeplejersker
Det vides ikke, om topisk indgift af kortikosteroider kan resultere i tilstrækkelig systemisk absorption til at producere påviselige mængder i modermælken. Systemisk indgivne kortikosteroider udskilles i modermælken i mængder, der sandsynligvis ikke har en skadelig virkning på spædbarnet. Ikke desto mindre bør der udvises forsigtighed, når topiske kortikosteroider administreres til en ammende kvinde.
Pædiatrisk brug
Pædiatriske patienter kan udvise større modtagelighed for topisk kortikosteroid-induceret HPA-akse-suppression og Cushings syndrom end modne patienter på grund af et større hudoverfladeareal i forhold til kropsvægt.
Hypothalamus-hypofyse-binyreakse (HPA) undertrykkelse, Cushings syndrom og intrakraniel hypertension er blevet rapporteret hos børn, der modtager topiske kortikosteroider. Manifestationer af binyresuppression hos børn omfatter lineær væksthæmning, forsinket vægtøgning, lave plasmakortisolniveauer og manglende respons på ACTH-stimulering. Manifestationer af intrakraniel hypertension omfatter udbulede fontaneller, hovedpine og bilateralt papilledema.
Administration af topiske kortikosteroider til børn bør begrænses til den mindste mængde, der er forenelig med et effektivt behandlingsregime. Kronisk kortikosteroidbehandling kan forstyrre børns vækst og udvikling.
Bivirkninger
De følgende lokale bivirkninger er rapporteret sjældent med topiske kortikosteroider, men kan forekomme hyppigere ved brug af okklusive forbindinger. Disse reaktioner er anført i en omtrentlig faldende rækkefølge af forekomsten:
| Brænding | Perioral dermatitis | |
| Det klør | Allergisk kontaktdermatitis | |
| Irritation | Hudforkalkning | |
| Tørhed | Sekundær infektion | |
| Folliculitis | Hudatrofi | Hudatrofi |
| Hypertrichosis | Striae | |
| Acneiforme udbrud | Miliaria | |
| Hypopigmentering |
Overdosering
Topisk påførte kortikosteroider kan absorberes i tilstrækkelige mængder til at give systemiske virkninger (se FORSKNINGSANVISNINGER).
Lidex Dosering og administration
Lidex Gel påføres generelt på det angrebne område som en tynd film fra to til fire gange dagligt afhængigt af tilstandens sværhedsgrad.
Oksklusiv forbinding kan anvendes til behandling af psoriasis eller genstridige tilstande.
Hvis der udvikles en infektion, skal brugen af okklusiv forbinding afbrydes og passende antimikrobiel behandling iværksættes.
Hvordan leveres Lidex
Lidex® (fluocinonid) Gel 0.05% leveres i
15 g tube – NDC 99207-507-13
30 g tube – NDC 99207-507-14
60 g tube – NDC 99207-507-17
Lagres ved stuetemperatur 15°-30°C (59°-86°F).
Fremstillet til:
MEDICIS, The Dermatology Company®
Scottsdale, AZ 85258
April 2001
I-5071/S
| Lidex fluocinonid gel |
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
Mærkningsmiddel: – 99207-507-17
Hyppigt stillede spørgsmål
- Har det været anvendt mod hårtab?
- Hvad er en erstatning for fluocinonide creme?
- Er fluocinonide en svampedræbende creme?
- Hvor længe skal du bruge fluocinonide?
- Hvad er fluocinonide creme god til?
- Kan fluocinonide bruges til at behandle udslæt af giftig efeu?
- Er det et steroid?
- Er det et antibiotikum?
Mere om Lidex (fluocinonid aktuelt)
- Bivirkninger
- Under graviditet eller amning
- Doseringsinformation
- Medikamentinteraktioner
- 8 Anmeldelser
- Generisk tilgængelighed
- Lægemiddelklasse: topiske steroider
Forbrugerressourcer
- Forbedret læsning
- Lidex Mild (Forbedret læsning)
- Lidex Regular (Forbedret læsning)
Faglige ressourcer
- Oplysningsinformation
- Lidex Lokal opløsning (FDA)
- Lidex Salve (FDA)
Andre mærker Vanos, Lidex-E
Relaterede behandlingsvejledninger
- Atopisk dermatitis
- Eksem
- Dermatitis
- Psoriasis
Medicinsk ansvarsfraskrivelse