Lad os først få det grundlæggende om flowcytometri-grundprincipperne
Hvad er flowcytometri?
Flowcytometri er en teknik, der anvendes til at påvise og måle fysiske og kemiske egenskaber ved en population af celler eller partikler. I denne proces suspenderes en prøve, der indeholder celler eller partikler, i en væske og indsprøjtes i flowcytometerinstrumentet.
Hvad er formålet med flowcytometri?
Flowcytometri giver en veletableret metode til at identificere celler i opløsning og anvendes oftest til vurdering af perifert blod, knoglemarv og andre kropsvæsker. Flowcytometriundersøgelser anvendes til at identificere og kvantificere immunceller og karakterisere hæmatologiske maligniteter.1 De kan måle:
- cellestørrelse
- cellens granularitet
- total DNA
- ny syntetiseret
- DNA-genekspression
- overfladereceptorer
- intracellulært proteiner
- transient signal
Muligheden for at foretage disse målinger på meget kort tid er en af de vigtigste fordele ved den flowcytometriske proces. De kan kvantificere op til tre til seks egenskaber eller komponenter kvantificeres i en enkelt prøve, celle for celle, for ca. 10.000 celler, på mindre end et minut.
Flowcytometriinstrumentering og metodologi
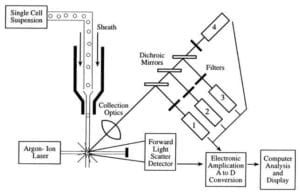 Flowcytometre tager en suspension af monodisperse, enkelte, uklumpede celler ind og kører dem en ad gangen (single file) forbi en laserstråle, hvor hver celle passerer gennem laserstrålen, spredes og fluorescerende lys og derefter tælles og sorteres eller karakteriseres yderligere.
Flowcytometre tager en suspension af monodisperse, enkelte, uklumpede celler ind og kører dem en ad gangen (single file) forbi en laserstråle, hvor hver celle passerer gennem laserstrålen, spredes og fluorescerende lys og derefter tælles og sorteres eller karakteriseres yderligere.
De tre hovedkomponenter i et flowcytometer er fluidikken, optikken og elektronikken.
- Det fluidiske system i et flowcytometer er ansvarligt for at transportere prøverne fra prøverøret til flowcellen, forbi laseren, sorteres og/eller kasseres.
- Komponenterne i det optiske system omfatter excitationslyskilder, linser og optiske filtre, der anvendes til at indsamle og flytte bølgelængder af lys rundt i instrumentet og detektionssystemet, der genererer fotostrømmen. Forskellen i bølgelængderesponsen i dataene hjælper med at analysere celletypen.
- Elektronikken eller flowcytometerinstrumenteringen.
Et af hovedprincipperne for anvendelse af flowcytometri er muligheden for at analysere den komplette cellecyklus og analysere DNA-indholdet i forskellige faser. Overvågning af de naturlige hændelser i cellecyklussen kan give oplysninger til sygdomsdiagnose og prognose af terapi. De forskellige faser i cellecyklus kan afsløre ændret DNA-indhold og andre anomalier, der indikerer tumortilstedeværelse eller tegn på fremskreden celledød. Dataudtrykkene lagres i en computer via specialiseret flowcytometriesoftware, der er forbundet med det valgte instrument, der anvendes på analysetidspunktet. Flowcytometridata rapporteres typisk på to forskellige måder: et histogram og/eller et dot plot2.
| G1-fase: | RNA, ribosomer og proteiner syntetiseres |
| S-fase: | DNA replikeres |
| G2-fase: | Repræsenterer fasen mellem DNA-syntese og mitose |
| M-fase: | Cellerne opdeles i to datterceller |
FACS
Fluorescens-aktiveret cellesortering (FACS) er en specialiseret type flowcytometri. Det er en metode til sortering af en heterogen blanding af biologiske celler i to eller flere beholdere, én celle ad gangen, baseret på hver enkelt celles specifikke lyssprednings- og fluorescerende egenskaber. Den adskiller sig fra flowcytometri på den måde, at den giver en unik karakterisering i stedet for blot at tælle og sortere celler. Det er almindeligt, at de to principper arbejder i en proces af typen samkarakterisering for at tilbyde en komplet kvalitativ og kvantitativ tilgang til flowcytometrisk analyse.
Den flowcytometriske proces:
Celsuspensionen føres ind i midten af en smal, hurtigt strømmende væskestrøm. Strømmen er indrettet således, at der er en stor adskillelse mellem cellerne i forhold til deres diameter. En vibrerende mekanisme tvinger strømmen af celler til at dele sig i individuelle dråber. Systemet er indstillet således, at der er en lav sandsynlighed for, at der er mere end én celle pr. dråbe. Lige før strømmen bryder op i dråber, passerer strømmen gennem en fluorescensmålestation, hvor hver enkelt celles fluorescenskarakter af interesse måles.
En elektrisk opladningsring er placeret lige ved det punkt, hvor strømmen brydes i dråber. Der placeres en ladning på ringen baseret på den umiddelbart forudgående måling af fluorescensintensiteten, og den modsatte ladning fanges på dråben, når den bryder ud af strømmen. De opladede dråber falder derefter gennem et elektrostatisk afbøjningssystem, der afbøjer dråberne i beholdere på grundlag af deres opladning. I nogle systemer påføres ladningen direkte på strømmen, og den dråbe, der bryder af, beholder en ladning af samme fortegn som strømmen. Strømmen returneres derefter til neutralitet, efter at dråben er brudt af.
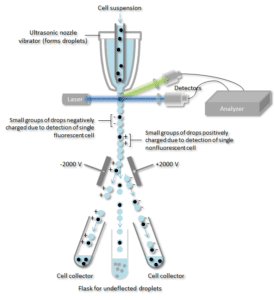
Et antistof, der er specifikt for et bestemt celleoverfladeprotein, er forbundet med et fluorescerende molekyle og tilsættes derefter til en blanding af celler. Det næste trin er processen med fluorescens, mens, specifikke celler passerer gennem en laserstråle de overvåges. Dråber, der indeholder en enkelt celle, tildeles en positiv eller negativ ladning, afhængigt af om cellen har et fluorescerende mærket antistof. Dråber, der indeholder en enkelt celle, registreres derefter af et elektrisk felt og ledes over i separate opsamlingsrør i henhold til deres ladning, hvilket gør det let at adskille de celler, der er markeret med det fluorescerende antistof.
Multicolor flowcytometri
Multicolor flowcytometri er en nyttig teknik ved undersøgelse af blandede populationer af celler, f.eks. blod- og vævsceller i prøver fra mennesker og dyr. Generelt markeres en bestemt celletype med et fluorescerende farvestof (markører) som f.eks. fluorofor eller propidiumjodid. Muligheden for at anvende flere fluorescerende markører samtidig gør det muligt at identificere flere celletyper samt funktionelle markører, der yderligere karakteriserer hver enkelt prøve. Der findes specialiserede instrumenter, der er i stand til at måle mere end 12 farver 3,4 . Disse fluorescerende farvestoffer og markører måles ved hjælp af forskellige bølgelængder af det lys, der udsendes fra laseren, for at sortere efter den enkelte celletype. Hver markør er exciteret ved en specifik bølgelængde af lys for at differentiere dem, når der anvendes flere markører.
Adaptering af et typisk farvningspanel fra 4 til 6 farver til mere end 12 farver er ikke blot et spørgsmål om “plug and play”, det skal gribes an på en systematisk måde for at opnå vellykkede parametre i et farvningspanel. De grundlæggende principper for paneldesign fungerer bedst på grundlag af undersøgelser forud for brug. Med andre ord er forberedelse nøglen, selv fra begyndelsen af processen med henvisning til farvningsindekset med hensyn til effektiv matchning af fluorochromer efter lysstyrke5.
Flowcytometri Tip:
Sæt lidt tid af til at forstå de subtile nuancer af dit flowcytometer, før du udformer dit primære antistofpanel. Fokuser på, hvor de mest følsomme målinger kan foretages på systemet. Der er mere i historien end blot fluorescerende intensitet.
Overvej at erstatte med et mindre lyst fluorokrom for at undgå kanalfejl.
Fælles anvendelser af flowcytometriske metoder
Flowcytometri er en integreret komponent på flere kliniske områder, herunder diagnose, behandlingsplaner og systemisk sygdom, uanset om den er statisk eller progressiv. Efterhånden som vi lærer mere om de praktiske anvendelser til brug i flowcytometri, udvides vidensgrundlaget yderligere. Nu er forskere mere end nogensinde før meget begejstrede for at kunne lære mere om kompleksiteten af visse sygdomme og tilstande. Det har ført til en hurtig ændring i diagnosticering af mønstre og drastisk ændrede medicinske tilgange til behandling af sygdomme som f.eks. kræft6.
Flowcytometriske metoder er ofte involveret med andre omfattende testmønstre som f.eks. morfologisk undersøgelse. I mange tilfælde viser hæmatologiske neoplasmer specifikke morfologiske ændringer, og flowcytometri giver større specificitet og hjælper patologer med at udvide på vævsanomalier eller anden fremskreden sygdom. Flowcytometri kan i nogle tilfælde forudbestemme tilbagefald af kræft, før morfologiske ændringer påvises7.
Et par af de vigtigste anvendelser, der anvendes inden for rammerne af moderne kliniske indstillinger, både terapeutiske og forskningsorienterede, omfatter:
- Proteinekspression – i hele cellen, selv i kernen
- Protein post translationelle modifikationer – omfatter kløvede og fosforylerede proteiner
- RNA – herunder både miRNA, og mRNA-transskriptioner
- Cellens sundhedsstatus – påvisning af apoptotiske celler eller celledød
- Cellens cyklusstatus – et effektivt redskab til at vurdere celler i G0/G1-fase i forhold til S-fase, G2 eller polyploiditet, herunder analyse af celleproliferation og aktivering
- Identificering og karakterisering af forskellige delmængder af celler i en heterogen prøve – herunder skelnen mellem centrale effektorhukommelsesceller fra udtømte T-celler eller regulatoriske T-celler
Oplysning
De grundlæggende principper for flowcytometri har ændret sig meget lidt i det seneste årti, men anvendelserne af denne teknologi har udviklet sig meget. Grundlaget for flowcytometri har været i overensstemmelse med dens primære funktion, som består i at afhøre individuelle celler eller partikler i en strøm med en laser, mens cellerne bevæger sig forbi et sæt stationære detektorer. Cytometre detekterer i stigende grad flere fluorescensfarver sammen med højhastighedssortering og analysefunktion8.
Flowcytometri spiller en integreret rolle i molekylærvidenskabelig forskning og udvikler sig fortsat med hastige skridt. Der findes flere kommercielle flowcytometre på markedet. De har tendens til at fungere efter det samme grundprincip, men der er vigtige forskelle i deres design og koncepter for tilpasning og integration af andre komponenter.
Snart vil der i horisonten blive introduceret en 3D-instrumentering, som vil blive inkorporeret i et hybride proprietært instrument, der produceres af NanoCellect Biomedical, WOLF Cell Sorter. Vi kan også se frem til udviklingen af smalspektret fluorescerende prober, integrationen af molekylærbiologiske teknikker med flowcytometri, og evalueringen af cellefrie markører såsom cytokiner vil være nøglekomponenter i den fortsatte udvikling af flowcytometrianalyser og celleassayteknologi.
Kilder:
1 http://clinchem.aaccjnls.org/content/46/8/1221
2 https://pubmed.ncbi.nlm.nih.gov/18615596-flow-cytometry-histograms-transformations-resolution-and-display/
3 https://onlinelibrary.wiley.com/doi/full/10.1002/cyto.a.20959
4 https://currentprotocols.onlinelibrary.wiley.com/doi/abs/10.1002/cpim.26
5 https://www.nature.com/articles/nprot.2006.250
6 https://pubmed.ncbi.nlm.nih.gov/19967915-immunophenotypic-analysis-of-bone-marrow-b-lymphocyte-precursors-hematogones-by-flow-cytometry/
7 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4803461/
8 https://link.springer.com/protocol/10.1385/0-89603-150-0:543