Nydelsen og betydningen af celler og batterier er uomtvistelig. I vores daglige liv gør vi brug af celler på så mange forskellige måder. I de sidste par begreber har vi allerede introduceret dig til batterier i almindelighed. Her vil vi dog give dig en dybdegående analyse af galvaniske celler. Så lad os komme i gang.
Suggested Videos
Galvaniske celler
En galvanisk celle er blandt andet en type elektrokemisk celle. Den bruges til at levere elektrisk strøm ved at foretage overførsel af elektroner gennem en redoxreaktion. En galvanisk celle er en eksemplarisk idé om, hvordan man kan udnytte energi ved hjælp af enkle reaktioner mellem nogle få givne elementer. Det er forbløffende at studere, hvordan en galvanisk celle kan opstilles og udnyttes til at opnå energi.
Udtrykt i de mest enkle vendinger fungerer en galvanisk celle som en anordning, hvor der samtidig finder oxidations- og reduktionsreaktioner sted. Disse reaktioner bruges til at omdanne den kemiske energi til elektrisk energi, som kan udnyttes til alle kommercielle formål.
Se flere emner under Elektrokemi
- Batterier
- Konduktans af elektrolytiske opløsninger
- Korrosion
- Elektrokemiske celler
- Elektrolytiske celler og elektrolyse
- Brændselsceller
- Nernst-ligning
- Variation af ledningsevne og molær ledningsevne med koncentrationen
Galvaniske cellers virkemåde

Den galvaniske celles virkemåde er ganske enkel. Den indebærer en kemisk reaktion, der gør den elektriske energi tilgængelig som slutresultat. Under en redoxreaktion udnytter en galvanisk celle energioverførslen mellem elektroner til at omdanne kemisk energi til elektrisk energi.
Galvanisk celle udnytter evnen til at adskille strømmen af elektroner i processen med oxidation og reduktion, hvilket forårsager en halv reaktion og forbinder hver med en ledning, så der kan dannes en vej for strømmen af elektroner gennem en sådan ledning. Denne strøm af elektroner kaldes i det væsentlige en strøm. En sådan strøm kan bringes til at flyde gennem en ledning for at fuldføre et kredsløb og opnå sit output i et hvilket som helst apparat som f.eks. et fjernsyn eller et ur.
En galvanisk celle kan fremstilles af to metaller af enhver art. Disse to metaller kan udgøre anoden og katoden, hvis de er i kontakt med hinanden. Denne kombination muliggør den galvaniske korrosion af det metal, som er mere anodisk. Et forbindelseskredsløb skal være nødvendigt for at tillade denne korrosion.
Opbygning af en galvanisk celle
For at skabe en galvanisk celle skal man gennemgå følgende opbygning. Cellen vil ideelt set omfatte to elektroder. Den ene af disse elektroder, katoden, skal være en positivt ladet elektrode, mens den anden skal være anoden, den negativt ladede elektrode.
Disse to elektroder skal udgøre de to væsentlige komponenter i den galvaniske celle. Den kemiske reaktion i forbindelse med reduktion skal finde sted ved katoden, mens oxidationshalveringsreaktionen skal finde sted ved anoden. Som det allerede er blevet sagt, kan to vilkårlige metaller anvendes til at skabe den kemiske reaktion.
Forståelse af den galvaniske celle med et eksempel
Lad os tage et eksempel, hvor de to metaller, der indgår i den kemiske reaktion, er zink og kobber. Når den kemiske reaktion finder sted, vil zink ende med at miste to elektroner. Disse vil blive optaget af kobber for at blive til elementært kobber. Da disse to metaller vil blive anbragt i to separate beholdere og vil blive forbundet med en ledende ledning, vil der blive dannet en elektrisk strøm, som vil overføre alle elektroner fra det ene metal til det andet.
På samme tid skal de to metaller nedsænkes i en saltopløsning, lad os sige Zinksulfat og Kobbersulfat i dette tilfælde. I dette tilfælde blandes de to opløsninger ikke direkte sammen, men kan forbindes ved hjælp af en bro eller et medium. Dette medium skal stå for overførslen af ioner, men også sørge for, at de to opløsninger ikke kommer til at blande sig med hinanden.
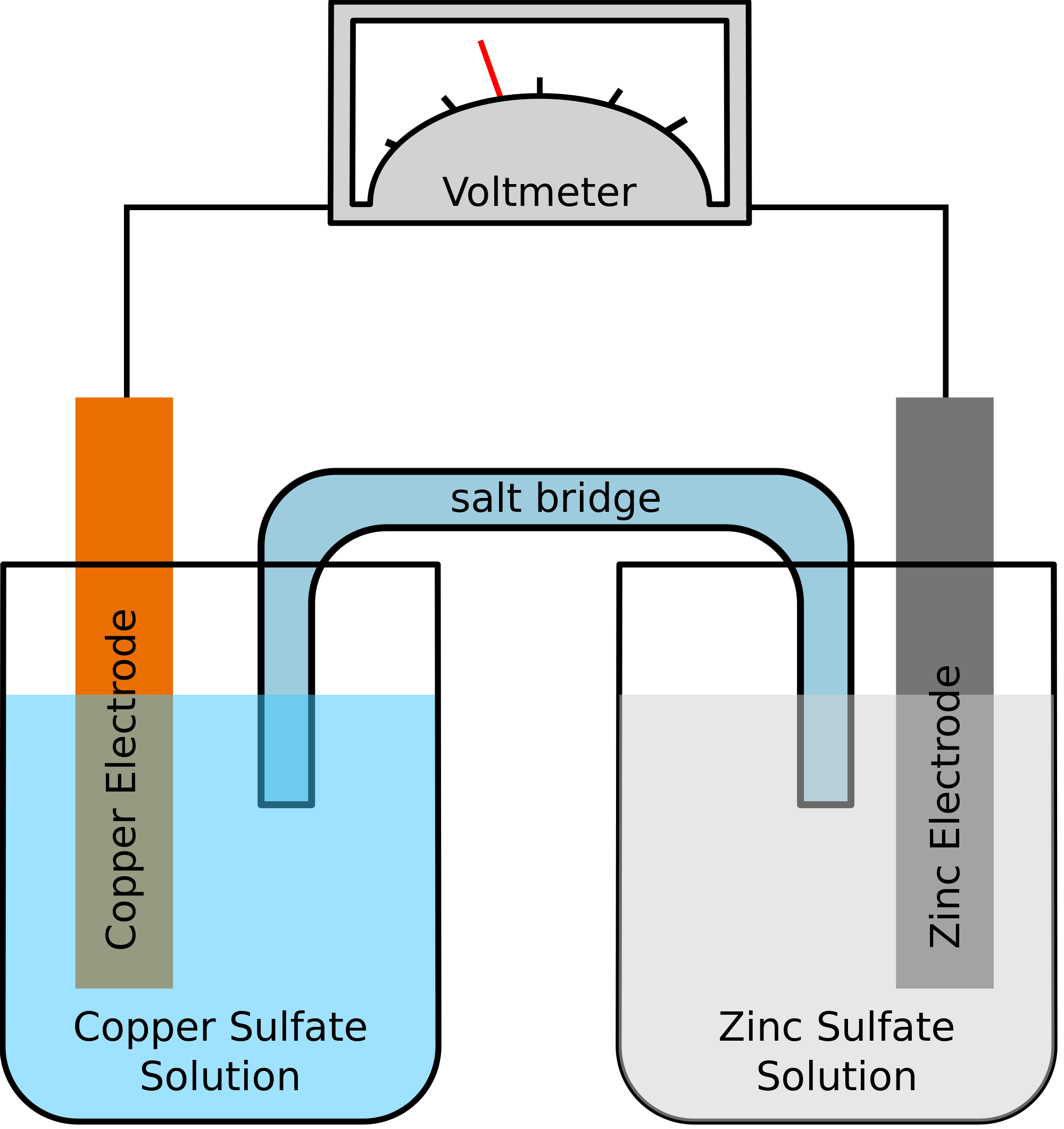
Sådan en bro hjælper med at lukke kredsløbet til at bære den elektriske ladning og sørger også for, at opløsningerne i beholderne med metallerne forbliver neutrale og ikke blandes med hinanden. Så længe saltbroen ikke forstyrrer redoxreaktionen, hvorunder oxidation og reduktion finder sted, er det ligegyldigt, hvilken saltbro der anvendes i den kemiske reaktion.
Nogle vigtige termer
Nogle af de vigtige termer, der tages i brug i en galvanisk celle, er anført nedenfor:
- Fasegrænser: Det henviser til de to metaller, der fungerer som katode og anode.
- Saltbro: Den forbindelsesbro eller det medium, der gør det muligt at gennemføre en redoxreaktion.
- Oxidation og reduktion: De kemiske processer, der gør det muligt for den elektriske strøm at danne og strømme gennem en galvanisk celle.
Løste eksempler til dig
Spørgsmål: Hvad vil der ske i en galvanisk celle, hvis der ikke anvendes nogen saltbro, mens redoxreaktionen finder sted?
Løsning: I mangel af en saltbro i hver beholder, der indeholder metallerne, ville redoxreaktionen begynde på nogenlunde samme måde. Men i fraværet af saltbroen ville det samme komme til en ret brat afslutning. De respektive opløsninger vil ikke være i stand til at opretholde deres elektriske neutralitet. Bortset fra dette vil der ikke ske nogen ændring i den kemiske reaktion eller nogen ændring af nogen art på grund af fraværet af saltbroen eller mediet.