Acetylering henviser til en reaktion, der introducerer en acetylfunktionel gruppe i en kemisk forbindelse, hvor hydrogenatomet i en hydroxylgruppe erstattes af en acetylgruppe (CH3 CO) for at give en specifik ester, acetat. Proteinacetylering har almindeligvis to forskellige former. Hos mennesker bliver næsten (80-90 %) af proteinerne co-translationelt acetyleret ved deres Nα-terminaler i de spirende polypeptidkæder. En anden type acetyleres typisk på lysinrester.
N-terminal acetylering
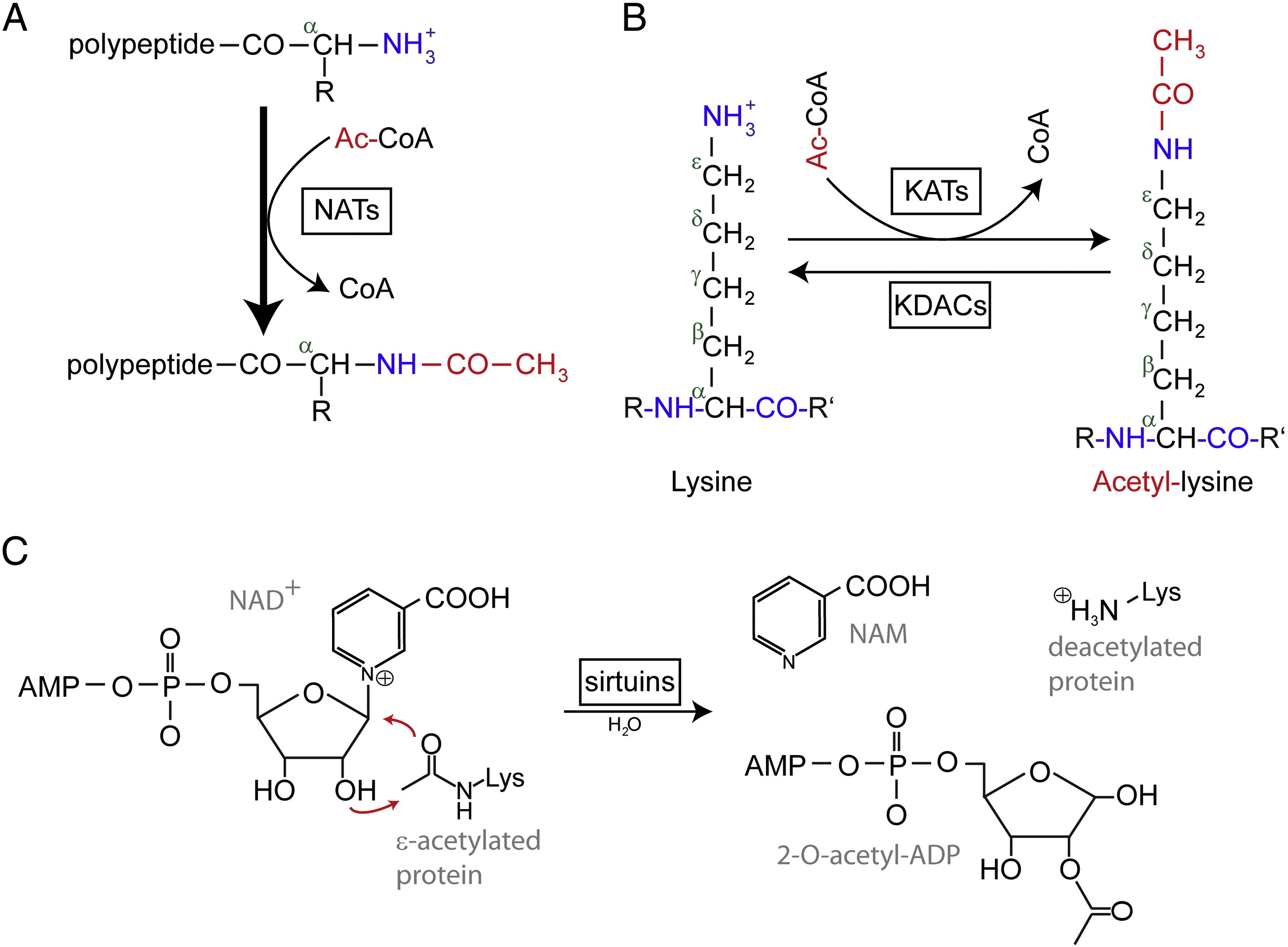
N-terminal (Nt) acetylering katalyseres af Nt-acetyltransferaser (NAT’er) og har indtil videre vist sig at være irreversibel. NAT’er, enzymer i mono- eller multisubunits bestående af en katalytisk underenhed og op til to hjælpeunderenheder, kan overføre en acetylgruppe fra acetyl-coenzym A (Ac-CoA) til α-aminogruppen i proteinets første aminosyrerest. I NAT’er modulerer den største hjælpeunderenhed den katalytiske underenheds aktivitet og substratspecificitet. Forskellige NAT’er er ansvarlige for Nt-acetyleringen. Hos mennesker er der indtil videre fundet seks NAT’er, herunder NatA, NatB, NatC, NatD, NatE og NatF. Ud over forskellen i underenhedssammensætningen varierer de forskellige NAT’er i deres substratspecificiteter.
Nt-acetylering spiller forskellige roller i molekylære virkninger. For det første bestemmer Nt-acetylering den subcellulære lokalisering for visse proteiner. For eksempel kan Arl3 og Grh1, to Golgi-associerede proteiner, ikke associere sig med Golgi-apparatet, når de mangler Nt-acetylgruppen. For det andet er det rapporteret, at Nt-acetylering tilbageholder proteiner i cytosolen og hæmmer en post-translationel translokationsvandring til det endoplasmatiske retikulum (ER) og den sekretoriske vej. Desuden kan Nt-acetylering ændre egenskaberne ved N-terminus, så protein-protein-interaktioner bliver moduleret. Det blev vist for flere proteiner, at affiniteten til deres bindingspartnere øges efter Nt-acetylering. E2-ubiquitin-konjugerende E2-enzym Ubc12 undergår f.eks. Nt-acetylering af NatC, hvilket giver en øget affinitet over for dets interaktionspartner, E3-ubiquitinligase Dcn1. Desuden kontrollerer Nt-acetylering proteinkvalitet og levetid og regulerer proteinstoiometri via N-end rule pathway.
N-terminal acetylering har mange funktioner i fysiologien. NAT’er er essentielle for normal udvikling, knogle- og blodkarudvikling. N-terminal acetylering kan regulere blodtryk, proteasomlokalisering, hormon, samt organelle struktur og funktion. I menneskelige sygdomme er den relateret til neurodegenerative sygdomme (såsom Alzheimers sygdom, Parkinsons sygdom og Lewy body demens) og kræft (såsom lungekræft, brystkræft og kolorektal cancer).
Lysinacetylering
Acetylerede lysinrester blev først opdaget i histoner, der regulerer gentranskription. Men lysinacetylering er ikke begrænset til histoner. I modsætning til Nt-acetylering er lysinacetylering reversibel. Acetyleringen katalyseres af lysinacetyltransferaser (KAT’er), og deacetyleringen af lysinrester katalyseres af lysin deacetylaser (KDAC’er).
Det er rapporteret, at 17-22 gener KAT’er er blevet identificeret i det menneskelige genom (det nøjagtige antal KAT’er er kontroversielt), som kan klassificeres i tre forskellige familier, herunder GCN5 (general control non-derepressible 5)-relateret acetyltransferase (GNAT)-familien, MYST-familien og p300/CBP-familien (CREB-binding protein). De kendte substrater af KAT-komplekser omfatter ikke kun histonproteiner, men også nogle forskellige transkriptionsfaktorer, transkriptionelle co-regulatorer og nogle proteiner fra specifikke cellulære signalveje som f.eks. p53, β-catenin, NF-κB, MyoD eller Rb. Og selv nogle RNA-molekyler kan være acetylerede. Der findes fire forskellige typer af KDAC’er, herunder klasse I, II, III og IV. Klasse I, II og IV er Zn2 + -afhængige amidohydrolaser, mens klasse III (også kaldet sirtuiner) bruger NAD+ som co-substrat til sin katalytiske aktivitet er Zn2 + -afhængige amidohydrolaser.
Histonerne er de første opdagede acetylerede proteiner. Histonmolekylerne modificeres af forskellige PTM’er, herunder fosforylering, methylering og acetylering. histonacetylering bestemmer histonens samling samt foldningen og kompaktheden af DNA-histoninteraktionen og udgør derfor et skift mellem en permissiv og repressiv kromatinstruktur. Ud over histoner kan KAT’er katalysere cytoskeletale proteiner. Der er nogle nye identificerede acetyleringssteder i andre proteiner, herunder HMG-proteiner, c-Myc, østrogen- og androgenreceptorer, E2F/Rb osv.
Den fysiologiske rolle af lysinacetylering er blevet rapporteret. Histonproteinerne er forbundet med en stram regulering af stort set alle typer DNA-templede processer som transkription, replikation, rekombination, reparation samt oversættelse og dannelse af specialiserede kromatinstrukturer. Derfor påvirker proteinlysinacetylering en række cellulære signalveje samt metabolisme, stressreaktioner, apoptose og membrantrafik.
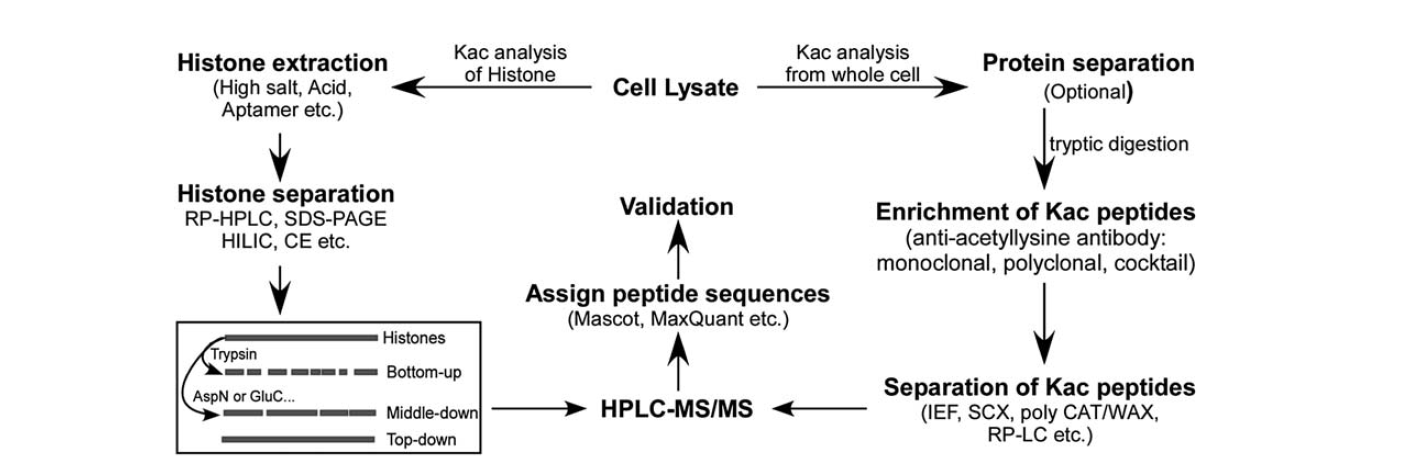
Der er relativt få værktøjer til rådighed til identifikation af lysinacetylering. Med udviklingen af massespektrometri har det været et vigtigt værktøj til identifikation og kvantificering af lysinacetylering. For at analysere histonlysinacetylering er der flere trin, herunder cellelysat, histonextraktion, histonseparation, massespektrometri og dataanalyse. Analysetrinene til analyse af proteinlysinacetylering fra hele cellen omfatter cellelysat, proteinseparation, berigelse af lysinacetyleringspeptider, separation af lysinacetyleringspeptider, massespektrometri og dataanalyse.