
Når klorgas bobles gennem en cylinder med tomatsaft, bliver klorin/tomatsaft-blandingen næsten helt hvid i løbet af fem minutter. Denne spektakulære ændring er et resultat af klorets kemiske virkning, der virker som et oxiderende blegemiddel, på pigmenterne i tomatsaft. Når gamle avisudklip, der er misfarvede på grund af ældning og eksponering for lys, behandles med 1 % vandig natriumborhydridopløsning, bliver papiret dramatisk hvidt i løbet af tyve minutter. I dette tilfælde har papiret fået sin oprindelige hvide farve tilbage ved hjælp af natriumborhydrid, der fungerer som et reducerende blegemiddel.
Et blegemiddel er et stof, der kan blege eller affarve andre stoffer. Farvede stoffer indeholder generelt grupper af atomer, kaldet chromophorer , der kan absorbere synligt lys med specifikke, karakteristiske bølgelængder og reflektere eller transmittere den del af lyset, der ikke absorberes. Hvis en kromosfor f.eks. absorberer blåt lys, vil den reflektere lys af den komplementære farve, og det kromosforholdige stof vil fremstå gult. Blegemidler ødelægger i det væsentlige chromophorerne (og fjerner derved farven) ved oxidation eller reduktion af disse absorberende grupper. Blegemidler kan således klassificeres som enten oxidationsmidler eller reduktionsmidler .
Nogle af anvendelsesmulighederne for blegemidler er:
- Blegning af tekstiler og stoffer
- Blegning af træmasse
- Fjernelse af pletter
- Kommerciel og husholdningsvask og rengøring
- Som bestanddele i skure- og opvaskemidler
- Afblegning af hår
Oxiderende blegemidler
Et stort antal oxiderende blegemidler blev gennemgået af Jules A. Szilard i Bleaching Agents and Techniques (1973). De oxiderende blegemidler (og blegemidler), der er almindeligt anvendte i dag, er: klor, klordioxid, alkaliske hypokloritter, hydrogenperoxid, peroxygenforbindelser samt sollys og kunstigt lys.
Klor (Cl 2 ). Opdagelsen af klor af den svenske kemiker Carl Wilhelm Scheele i 1774 markerede begyndelsen på den moderne æra af blegning. Ifølge Sidney M. Edelstein i en tidsskriftsartikel fra 1948 med titlen “The Role of Chemistry in the Development of Dyeing and Bleaching” var den franske kemiker Claude-Louis Berthollet den første til at bruge klor til at blege bomulds- og linnedstoffer.
Klor er blevet brugt til at blege træmasse. Mange papirmassefabrikker, der anvender Kraft-pulpningsprocessen, fremstiller natriumhydroxid (der er nødvendigt for at fordøje træspåner) på stedet ved elektrolyse af saltvand , en koncentreret vandig opløsning af natriumklorid.
2NaCl + 2H 2 O → 2NaOH + H 2 + Cl 2 (1)
Klor er et biprodukt. Efterfølgende klorblegning af den brune papirmasse giver et produkt, der kan anvendes til fremstilling af skrive- og trykpapir. Desværre bliver organiske forbindelser i papirmassen både oxideret og kloreret, hvorved der dannes små mængder af organiske klorforbindelser, herunder
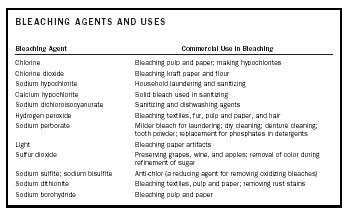
| Blegemidler og anvendelse | |
| Blegemiddel | Kommerciel anvendelse ved blegning |
| Klor | Blegning af papirmasse og papir; fremstilling af hypochlorit |
| Klordioxid | Blegning af kraftpapir og mel |
| Natriumhypochlorit | Husholdningsvask og desinficering |
| Calcium hypochlorit | Blegemiddel i fast form til desinfektion |
| Natriumdichlorisocyanurat | Desinfektions- og opvaskemidler |
| Brintoverilte | Blegning af tekstiler, pels, papirmasse og papir samt hår |
| Natriumperborat | Mildere blegemiddel til hvidvaskning; kemisk rensning; rengøring af tandproteser; tandpulver; erstatning for fosfater i vaskemidler |
| Lys | Blegning af papirgenstande |
| Svovldioxid | Konservering af druer, vin og æbler; fjernelse af farve under raffinering af sukker |
| Natriumsulfit; natriumbisulfit | Anti-chlor (et reduktionsmiddel til fjernelse af oxiderende blegemidler) |
| Natriumdithionit | Blegning af tekstiler, papirmasse og papir; fjernelse af rustpletter |
| Natriumborohydrid | Blegning af papirmasse og papir |
dioxiner. Faktisk er det mest udbredte dioxin, der produceres ved papirmasse- og blegningsprocessen, 2,3,7,8-tetrachlordibenzo- p -dioxin (2,3,7,8-TCDD), blevet fundet at være både kræftfremkaldende og dødbringende toksin . Derfor er klor som blegemiddel ved at blive erstattet af de mere sikre blegemidler klordioxid og hydrogenperoxid. Faktisk går tendensen i papirmasse- og papirindustrien i retning af helt klorfri (TCF) blegning. Klor anvendes nu i blegningsindustrien hovedsagelig til fremstilling af hypochloritopløsninger og tørre blegemidler som f.eks. calciumhypochlorit.
Klordioxid (ClO 2 ). Klordioxid har været anvendt som blegemiddel både i gasform og i vandig opløsning. På grund af dets eksplosive karakter fortyndes klordioxid i gasform ofte med nitrogen eller kuldioxid. Hvis klordioxid opbevares eller transporteres, ledes det gennem koldt vand og opbevares på køl.
Klordioxid fremstilles industrielt ved reduktion af natriumchlorat med svovldioxid i vandig opløsning.
2NaClO 3 + SO 2 + H 2 SO 4 → 2ClO 2 + 2NaHSO 4 (2)
En forholdsvis sikker metode til fremstilling af ClO 2 omfatter reaktionen mellem natriumklorit (NaClO 2 ) og formaldehyd (H 2 CO).
H 2 CO + H + + + ClO 2 – → HOCl + HCOOH (3)
Efterhånden som reaktion 3 forløber, falder opløsningens pH-værdi (som følge af dannelsen af myresyre ). Den øgede surhedsgrad i opløsningen fremmer dannelsen af ClO 2 , vist i ligning 4.
HCOOH + HOCl + 2ClO 2 – → 2ClO 2 + Cl – + H 2 O + HCOO – (4)
I en sur opløsning opfører klordioxid sig som et oxidationsmiddel. Den fuldstændige reduktion af ClO 2 er vist i ligning 5.
ClO 2 + 4H + + + 5 e – → Cl – + 2H 2 O (5)
De enkelte trin i denne samlede reduktionsreaktion producerer HClO 2 , HOCl og Cl 2 , som alle opfører sig som oxidationsmidler. Der kræves et surt medium, da ClO 2 disproportioneres i alkaliske opløsninger, som vist i ligning 6.
2ClO 2 + 2OH – → ClO 3 – + ClO 2 – + H 2 O (6)
Klordioxid anvendes hovedsagelig til blegning af papirmasse.
Hypochloritter (OCl – ). Hypochlorit-blegemidler fremstilles af NaOCl og i mindre grad af Ca(OCl) 2 . Hypochloritter anvendes til tøjvask, som desinfektionsmidler, til blegning af papirmasse og tekstiler og til fjernelse af blæk fra genbrugspapir. Kommercielle blegningsopløsninger fremstilles ved at lade klorgas passere gennem koldt, fortyndet, vandigt natriumhydroxid, som vist i ligning 7.
Cl 2 + 2OH – → OCl – + Cl – + H 2 O (7)
Alternativt kan hypochlorit-ionen dannes ved hydrolyse af organiske nitrogen-chlorforbindelser. Nogle af de vigtigste nitrogen-chlorforbindelser, der anvendes på denne måde, er de klorerede isocyanurater. Disse anvendes i rengøringsmidler og opvaskemaskiner.
For at være et effektivt blegemiddel skal hypochloritopløsningen holdes alkalisk (pH > 9,0) for at undertrykke hydrolysen af OCl – (se ligning 8) og forhindre dannelsen af ustabilt HOCl.
OCl – + H 2 O → HOCl + OH – (8)
I sure opløsninger dannes og nedbrydes HOCl.
3HOCl → HClO 3 + 2HCl (9)
HOCl vil også reagere med HCl, som er et af nedbrydningsprodukterne.
HOCl + HCl → H 2 O + Cl 2 (10)
Hypochloritblegeopløsninger må ikke indeholde tungmetalkationer, da disse kationer (ligesom lys eller varme) fremmer nedbrydningen af HOCl, som vist i ligning 11.
2HOCl → 2HCl + O 2 (11)
De aktive stoffer i hypochloritblegemidler varierer med pH-værdien. Ved pH < 2 er Cl 2 den vigtigste komponent i opløsningen; ved pH 4 til 6 er HOCl den dominerende art; ved pH > 9 er OCl – den eneste tilstedeværende komponent. Det er hypochlorit-ionen i den basiske opløsning, der er den aktive bestanddel i husholdningsblegemiddel, som typisk består af ca. 5-6 % NaOCl. OCl – ionen oxiderer chromophorer i farvede materialer og reduceres selv til chlorid- og hydroxidioner.
OCl – + H 2 O + 2 e – → Cl – + 2OH – (12)
Den blegningsproces, der foretages af kommercielle hypochloritblegemidler, forstærkes ofte ved brug af optiske blegemidler, forbindelser, der absorberer indfaldende ultraviolet lys og udsender synligt lys, hvilket får stoffet til at fremstå lysere og hvidere.
Hydrogenperoxid (H 2 O 2 ) . Hydrogenperoxid kan fremstilles ved reaktion af bariumperoxid og svovlsyre (se ligning 13). Da bariumsulfat udfældes, kan hydrogenperoxid let udskilles.
BaO 2 + H 2 SO 4 → BaSO 4 + H 2 O 2 2 (13)
Brintoverilte har som blegemiddel, der anvendes i papirmasse- og papirindustrien, den fordel, at det er ikke-forurenende. På grund af ustabiliteten af ren hydrogenperoxid anvendes vandige opløsninger til blegning. Ved stuetemperatur nedbrydes hydrogenperoxid meget langsomt til vand og ilt.
2H 2 O 2 → H 2 O + O 2 (14)
Tilstedeværelsen af overgangsmetalkationer (især Fe 3+ , Mn 2+ og Cu 2+ ) og andre katalysatorer fremskynder imidlertid denne reaktion dramatisk. Som følge heraf skal vandig brintoverilte stabiliseres med kompleksdannere, der lagrer overgangsmetalkationer.
Den aktive blegningsart i hydrogenperoxid er perhydroxylanionen , OOH – , der dannes ved ionisering af H 2 O 2 .
H 2 O 2 + H 2 O → H 3 O + + OOH – (15)
Hydrogenperoxids syreioniseringskonstant er meget lav ( K a = 2 × 10 -12 ) med det resultat, at opløsninger af H 2 O 2 2 skal gøres alkaliske for at

for at øge koncentrationen af OOH – . I mangel af et alkalisk medium er hydrogenperoxid ikke længere effektivt som blegemiddel. F.eks. anvendes der i afblegningsfasen ved hårfarvning ofte hydrogenperoxid (5-6 %), men også ammoniak for at tilvejebringe et alkalisk medium.
Samtidig må pH-værdien ikke stige over 11, da der på dette tidspunkt begynder nedbrydning af OOH – at ske.
2OOH – → O 2 + 2OH – (16)
Peroxygenforbindelser. Der findes en række faste peroxygenforbindelser, som frigiver hydrogenperoxid, når de opløses i vand. Disse omfatter natriumperborat (NaBO 3 z 4H 2 O eller NaBO 2 z H 2 O 2 z 3H 2 O) og natriumcarbonatperoxyhydrat (2Na 2 CO 3 z 3H 2 O 2 ). Natriumperboratets struktur indeholder peroxoanionen B 2 (O 2 ) 2 (OH) 4 2- , som indeholder to O-O-bindinger, der forbinder to tetraedriske BO 2 (OH) 2-grupper. Disse peroxygenforbindelser anvendes i vaske- og rengøringsmidler, proteserensemidler og tandpulver.
Blegning med lys. Blegning med enten naturligt sollys eller kunstigt lys er blevet anvendt til at fjerne pletter fra papirartefakter og til behandling af tekstiler. Det materiale, der skal bleges, nedsænkes først i en alkalisk opløsning af enten calcium- eller magnesiumbicarbonat og beskyttes derefter mod ultraviolet stråling ved at dække det med plexiglas, Lexan eller Mylar. Derefter udsættes den for lys i to til fire timer ved naturligt sollys og to til tolv timer ved kunstigt lys.
Reducerende blegemidler
Reduktionsmidler, der anvendes til blegning, omfatter sulfitter, bisulfitter, dithionitter og natriumborhydrid, som alle anvendes til blegning af papirmasse og tekstiler.
Sulfitter (SO 3 2- ) og bisulfitter (HSO 3 – ). Svovlens oxidationstrin i både SO 3 2- og HSO 3 – er +4, og der sker let oxidation til +6 med dannelse af henholdsvis SO 4 2- og HSO 4 – , hvilket gør sulfitter og bisulfitter til gode reduktionsmidler.
Dithionitter (S 2 O 4 4 2- ) . Både natrium- og zinkdithionit har fundet anvendelse til blegning af mekanisk papirmasse og tekstiler. Fremstillingen af dithionit-ionen sker ved reduktion af bisulfit-ionen og svovldioxid med Zn-støv.
2HSO 3 – + SO 2 + Zn → Zn 2+ + S 2 O 4 2- + SO 3 2- + H 2 O (17)
Dithionit-ionen, S 2 O 4 2- , som har svovl i oxidationstrin +3, opfører sig som et stærkt reduktionsmiddel i alkaliske opløsninger.
S 2 O 4 2- + 4OH – → 2SO 3 2- 2H 2 O + 2 e – (18)
Efterhånden som pH-værdien sænkes, falder dithionit-ionens reducerende kraft, som forudsagt af LeChateliers princip.
Dithionitter er nyttige til fjernelse af rustpletter, og neutrale citratopløsninger af Na 2 S 2 O 4 blev anvendt til at fjerne jernkorrosionsprodukter fra genstande, der blev bjærget fra Titanic.
Natriumborhydrid (NaBH 4 ). Natriumborhydrid er hovedsagelig blevet anvendt til industriel blegning af mekanisk papirmasse. BH 4 – ionen er et stærkt reduktionsmiddel i alkalisk opløsning.
BH 4 – + 10OH – → BO 3 3- + 8 e – + 7H 2 O (19)
Et problem ved anvendelse af natriumborhydrid er, at BH 4 – ionen langsomt nedbrydes i vandig opløsning.
BH 4 – + 4H 2 O → B(OH) 4 – + 4H 2 (20)
Som en alternativ metode kan BH 4 – salte opløses i enten CH 3 OH eller i det mindre giftige C 2 H 5 OH. Nedbrydningen af BH 4 – ionen i alkoholer sker med en meget langsommere hastighed:
BH 4 – + 4ROH → B(OR) 4 – + 4H 2 (R = CH 3 , C 2 H 5 ) (21)
Konklusion
Et blegemiddel kan blege eller affarve et stof ved at reagere med de chromophorer, der er ansvarlige for stoffets farve. Afhængigt af kromoforernes art vil blegningsmidlet enten være et oxiderende eller reducerende middel. Det vil sige, at kromoforen enten oxideres eller reduceres for at frembringe et farveløst eller hvidtet stof. Blegemidler og deres kommercielle anvendelse er opsummeret i tabel 1.