Trend 2: For oxosyrer med et givet centralatom stiger syreindholdet med centralatomets oxidationstilstand eller med andre ord med antallet af oxygenatomer bundet til centralatomet.
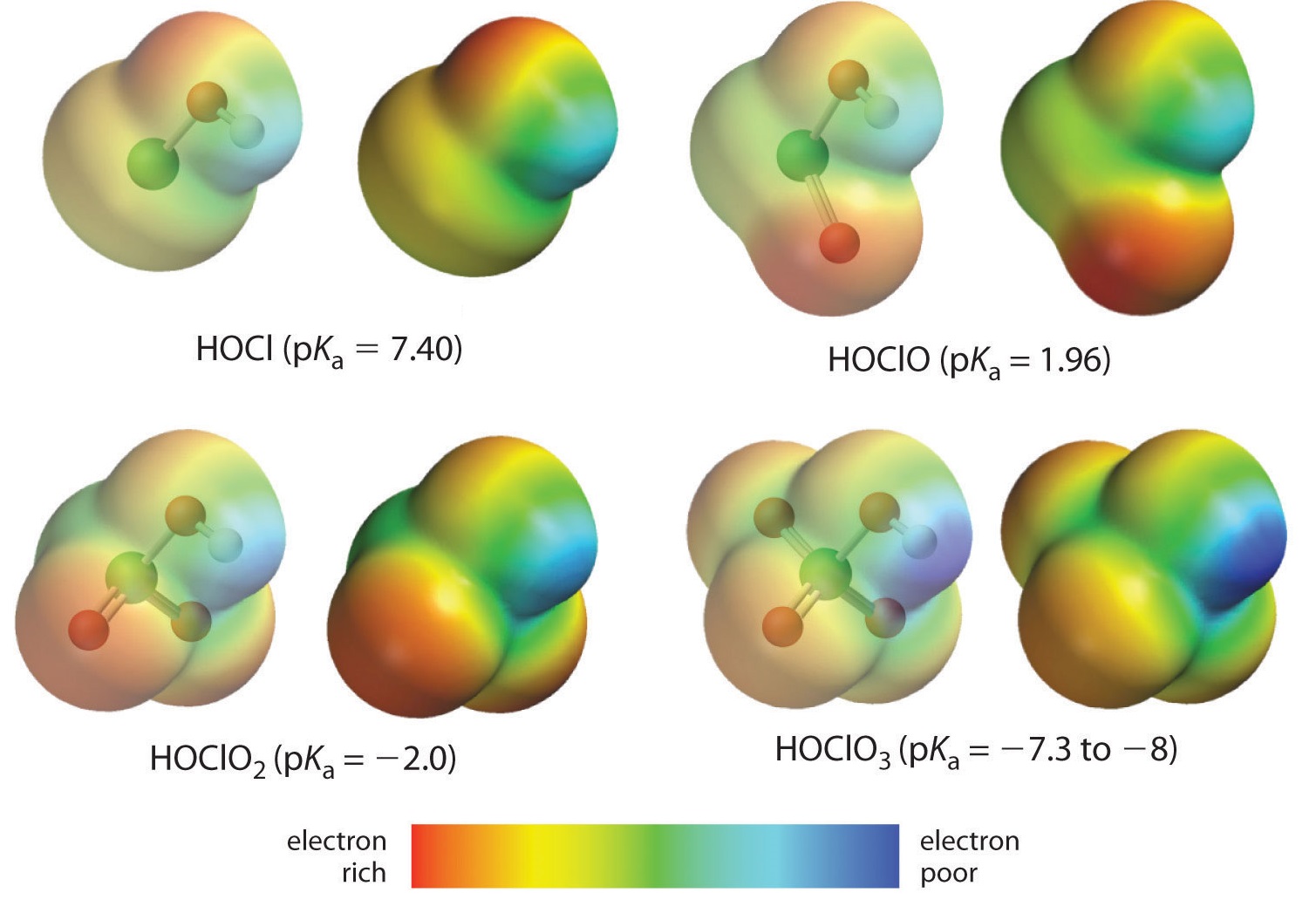
Her ser vi på tendensen for syrer, hvor der er varierende antal oxygenatomer bundet til et givet centralatom. Som eksempler kan nævnes serierne af perchlorsyre (\(\ce{ClO_4^{-}}}\)), klorsyre (\(\ce{ClO_3^{-}}}\)), klorsyre (\(\ce{ClO_2^{-}}}\)) og hypochlorsyre (\(\ce{ClO^{-}}}\)). I disse serier er syren stærkere, jo større er antallet af oxygenatomer, jo stærkere er syren. Dette kan forklares på flere måder. Set fra selve syrens synspunkt er den vigtigste faktor igen den induktive effekt, i dette tilfælde den evne, som de oxygenatomer, der er knyttet til det centrale atom, har til at trække på elektrontætheden på tværs af OH-bindingen. Dette ses af ladningstæthedsdiagrammet for kloroxosyrerne, der er vist i figur \(\PageIndex{1}\), hvor den delvise positive ladning på det sure hydrogen stiger med antallet af tilstedeværende oxygenatomer.
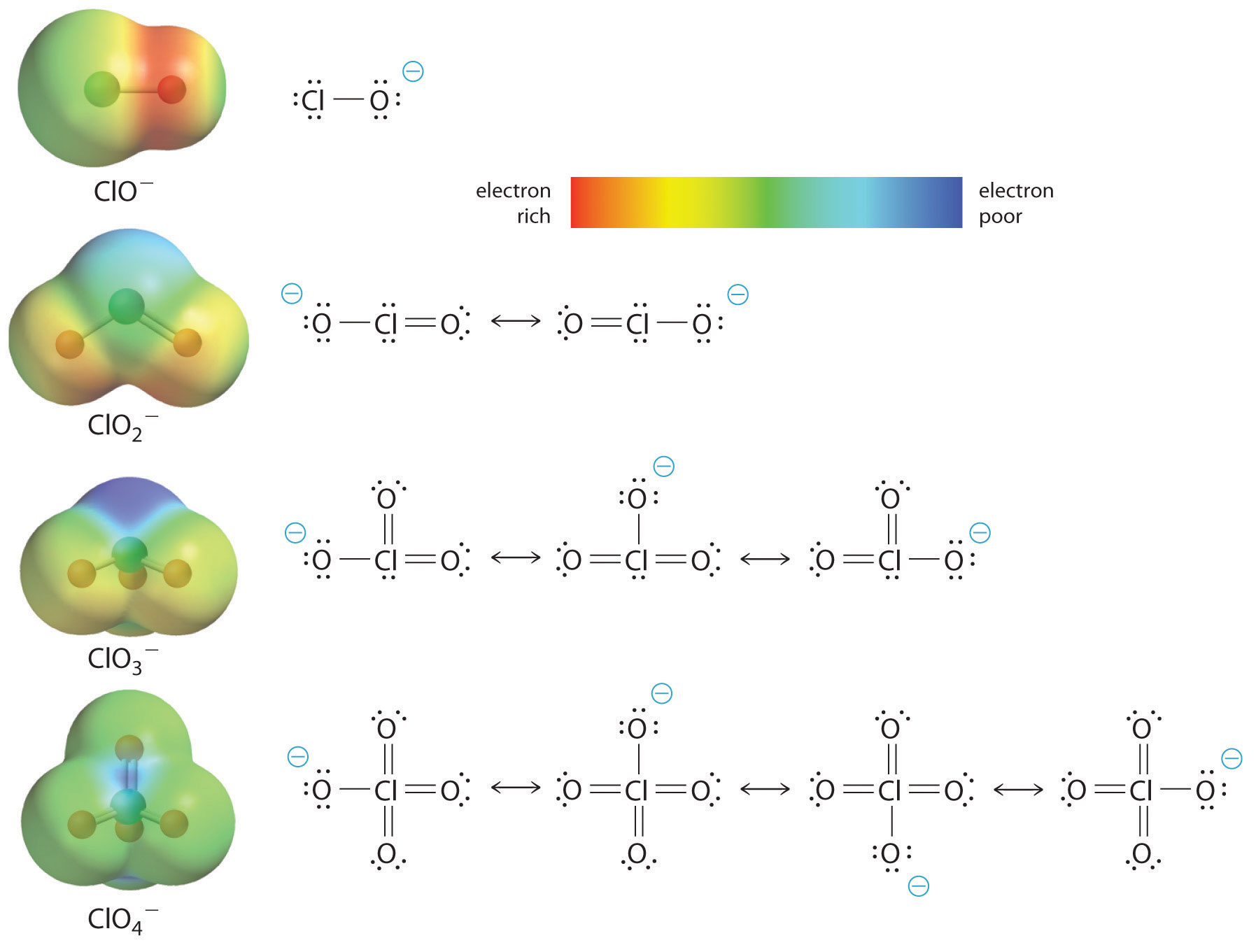
Stigningen i oxosyrens surhedsgrad med antallet af oxygener bundet til det centrale atom kan også ses ved at betragte stabiliteten af den konjugerede oxyanion. At stabiliteten af den konjugerede base stiger med antallet af oxygenatomer kan ses af ladningsfordelingsdiagrammerne og Lewis-bindingsmodellerne for kloroxyanionerne, der er vist i figur \(\PageIndex{2}\). Efterhånden som den negative ladning spredes over flere oxygenatomer, bliver den mere og mere diffus.
Ovelse \(\PageIndex{1}\)
Svovl og selen danner begge oxosyrer af formlen \(\ce{H_2EO_4}\), hvor E er enten S eller Se. Disse kaldes henholdsvis svovlholdig og selenholdig syre. Hvilken oxosyre ville du forvente ville være mere sur: selenholdig syre eller svovlholdig syre?
Svar
Svovlholdig syre burde være mere sur. Da svovl er mere elektronegativt end selen vil svovl i højere grad polarisere OH-bindinger, hvilket gør dem mere sure. Denne forudsigelse bekræftes af en sammenligning af \(pK_a\)-værdierne for syrerne:
| Syre | \(pK_{a1}\) | \(pK_{a2}\) | |
|---|---|---|---|
| svovlholdig syre, \(H_2SO_3\) | 1.85 | 7.2 | |
| selenholdig syre, \(H_2SeO_3\) | 2.62 | 8.32 |