US Pharm. 2018;43(9):21-26.
ABSTRACT: A terapia de reposição hormonal (TSH) é o tratamento mais eficaz para os sintomas vasomotores e geniturinários associados à menopausa. Os efeitos adversos associados à TSH dependem de vários fatores, incluindo dosagem, via, duração do uso, tempo de início e escolha do agente. A decisão de iniciar a TRH deve incluir uma avaliação de risco, e a TRH deve ser individualizada para o paciente. As muitas opções de HRT existentes vêm em uma ampla gama de dosagens e formas de dosagem. Os farmacêuticos devem ser capazes de aconselhar os pacientes sobre a TRH e seus efeitos colaterais.
A mulher média viverá um terço de sua vida na menopausa ou no passado.1 O tratamento dos sintomas da menopausa ganhou importância crescente devido às morbidades associadas ao envelhecimento nas mulheres.2 A terapia de reposição hormonal (TSH), termo usado para descrever a terapia de estrogênio, terapia de combinação estrogênio-progesterona, ou terapia de agonista ou antagonista receptor de estrogênio, continua a desempenhar um papel importante na mitigação dos sintomas perimenopausais e pós-menopausa.3 Embora a experiência de cada mulher seja diferente, os sintomas vasomotores (VMS) e vulvovaginais são duas das queixas mais comuns associadas às alterações hormonais envolvidas na menopausa.4
Sintomas da menopausa
VMS são alguns dos sintomas mais comuns e mais problemáticos da menopausa. Afrontamentos, caracterizados por uma sensação repentina de calor na parte superior do tórax e face que dura de 2 a 4 minutos, ocorrem em aproximadamente 75% das mulheres na menopausa.1 Outros possíveis VMS são a transpiração, palpitações e ansiedade.1 Os VMS têm sido associados à diminuição da qualidade do sono, irritabilidade, dificuldade de concentração e qualidade de vida reduzida.3 Além disso, esses sintomas têm sido associados a riscos cardiovasculares, ósseos e cognitivos.5-9 A TSV tem sido reconhecida há muito tempo como o tratamento mais eficaz para a TMS.4,10
Além da TMS incômoda, muitas mulheres apresentam sintomas vulvovaginais. Estima-se que 10% a 40% das mulheres experimentam atrofia vaginal.3 A atrofia vaginal pode causar dor vulvar, ardor e prurido; secura vaginal; corrimento vaginal; dispareunia (relação sexual difícil ou dolorosa); e manchas ou sangramento após a relação sexual.1 Estes sintomas tendem a ocorrer na fase pós-menopausa tardia e podem levar ao desconforto da roupa apertada, enquanto sentado ou exercitado, ou com actividade sexual.1 A TSH tópica é tipicamente recomendada para o tratamento dos sintomas vulvovaginais.1
Além de aliviar os sintomas previamente declarados, existem evidências de que a HRT padrão de baixa dose também pode prevenir fraturas pós-menopausa do quadril, espinhais e não espinhais.10 Os benefícios da TRH para VMS e sintomas geniturinários incluem melhorias na bexiga hiperativa, diminuição dos distúrbios do sono, redução do risco de diabetes tipo 2, potencial proteção contra doença arterial coronariana (DAC) e infarto do miocárdio, diminuição do risco de osteoporose ou fratura e redução potencial da mortalidade por todas as causas.1,10 Os benefícios da TRH conferem à densidade óssea, entretanto, diminuem rapidamente após a descontinuação. Além disso, embora alguns produtos tenham aprovação do FDA para a prevenção da osteoporose, nenhum deles está atualmente aprovado para o tratamento da osteoporose. Os principais riscos associados ao uso desses agentes incluem tromboembolismo venoso (TEV), acidente vascular cerebral isquêmico, aumento da incidência de câncer endometrial (se um estrogênio sem oposição for usado em uma mulher com útero) e aumento do risco de câncer de mama quando a TSH é usada além de 3 a 5 anos.4,10
Produtos disponíveis para TSH
Uma ampla gama de produtos para TSH está disponível em várias formas de dosagem.4 Das preparações orais, as opções incluem estrogênios equinos conjugados (CEE), 17-beta estradiol micronizado (micronizado para melhorar a absorção), estrogênios esterificados, etinilestradiol (uma preparação de estrogênio altamente potente que é usada em dosagens muito mais baixas para HRT do que para contracepção oral), comprimidos combinados de estrogênio-progestanho e um comprimido combinado CEE/bazedoxifeno.4
O comprimido CEE/bazedoxifeno, uma combinação de estrogênio e um modulador seletivo do receptor de estrogênio, está disponível nos Estados Unidos para o tratamento da menopausa VMS e prevenção da osteoporose. Nesta combinação, o bazedoxifeno previne a hiperplasia endometrial induzida pelo estrogênio, tornando desnecessária a administração de um progestógeno. Entretanto, o bazedoxifeno está associado ao aumento do risco de TEV.4 O uso do bazedoxifeno tem sido considerado seguro quando estudado por até 7 anos no tratamento da osteoporose, mas a combinação tem sido estudada apenas para durações mais curtas.11,12 Estudos de VMS de até 2 anos de duração não demonstraram nenhum aumento na incidência de sensibilidade mamária ou risco de câncer de mama.3 As diretrizes atuais recomendam o uso de CEE/bazedoxifeno em mulheres na pós-menopausa com útero e sem contra-indicações para tratar a VMS e ajudar a prevenir a perda óssea, mas não especificam a duração da terapia.1 Com base nas evidências disponíveis, o tratamento da VMS com CEE/bazedoxifeno por até 2 anos parece seguro; a segurança de uso além de 2 anos permanece pouco clara.
HRT também está disponível em várias aplicações tópicas. Estão disponíveis preparações de adesivos transdérmicos de 17-beta estradiol ou combinações de estrogênio-progestina. Outras preparações tópicas incluem pacotes de gel ou bombas doseadas, sprays e emulsões.4 Injeções de depósito também podem ser consideradas, mas esses produtos são raramente usados no ajuste da HRT.4 Um resumo das formulações sistêmicas disponíveis de HRT é dado na tabela 1.13-15
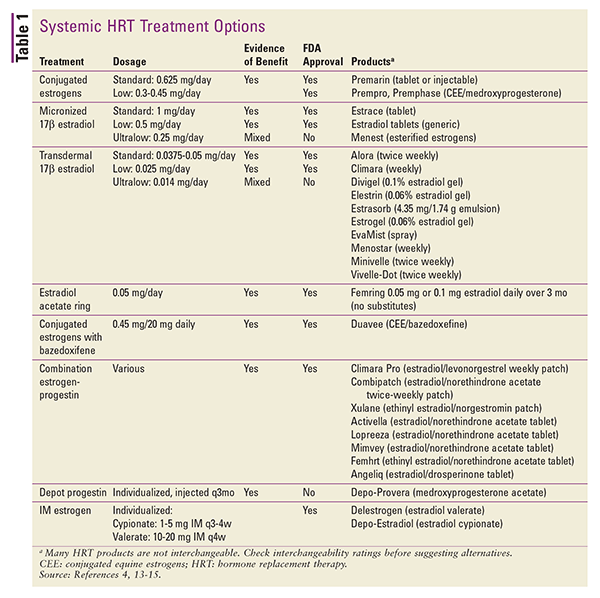
Na conversão de uma forma de dosagem para outra, as diferenças na via de administração e na potência do produto podem ser contabilizadas usando-se os equivalentes de dose estimados.4 Os equivalentes de dose para preparações orais são os seguintes 1 mg micronizado de 17-beta estradiol equivale a 1,25 mg de sulfato de piperazina estrona. Nas conversões entre as preparações orais e transdérmicas de estrogênio, 0,05 mg/24 horas transdérmicas é igual a aproximadamente 0,625 mg diários por via oral.4
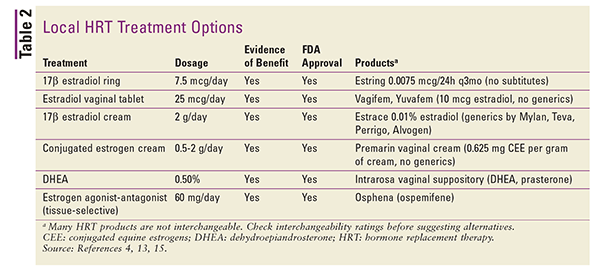
Preparações locais são geralmente de baixa dose e são usadas especificamente para o tratamento dos sintomas de atrofia vulvovaginal.4 Doses mais altas podem ser usadas para o tratamento da VMS sistêmica, mas isso geralmente não é recomendado.4 As preparações locais incluem anéis vaginais, comprimidos e cremes. Consulte a tabela 2 para um resumo das formulações locais disponíveis de TSH.4,13,15
Atual Diretrizes Recomendações
Três organizações – o Colégio Americano de Obstetras e Ginecologistas, a Sociedade Norte-Americana de Menopausa (NAMS) e a Sociedade Endócrina – produziram diretrizes sobre o uso da TSH na menopausa. Conforme observado nessas diretrizes, as indicações para TSH incluem o manejo do VMS associado à menopausa e o tratamento dos efeitos vulvovaginais na ausência de sintomas sistêmicos incômodos.1,3,4 Verificou-se que o estrogênio sozinho ou em combinação com um progestógeno reduziu o VMS semanal em 75% e reduziu significativamente a gravidade dos sintomas em comparação com o placebo.4
Em mulheres com idade inferior a 60 anos, com menos de 10 anos após a menopausa, que tenham um VMS incômodo e não tenham contra-indicações à TSH ou risco excessivo de câncer cardiovascular ou de mama, recomenda-se o uso de terapia apenas com estrogênio para aquelas sem útero. A adição de progestina é recomendada em pacientes com útero para prevenir hiperplasia endometrial e câncer endometrial em potencial.1,3,4 Atualmente, a exposição necessária à progestina não é clara, mas muitos provedores dão progestina em um ciclo de 14 dias a cada mês.4 Para mulheres com mais de 60 anos ou com mais de 10 anos após a menopausa, recomenda-se a consideração de outras terapias (não hormonais) em vez da TRH.3
Em mulheres com risco elevado de doença cardiovascular (DCV; definido como >10% de risco de DCV a 10 anos pelo American College of Cardiology/American Heart Association), as terapias não-hormonais são preferidas.3 Em mulheres com risco moderado de DCV, o estrogênio transdérmico com ou sem progestógeno é preferível à terapia oral, pois esses preparados têm menor efeito sobre a pressão arterial, lipídios e metabolismo de carboidratos.1 Em pacientes com risco elevado de TEV, é preferível o uso de vias não orais na dose efetiva mais baixa. Finalmente, em pacientes com risco elevado ou intermediário de câncer de mama, é dada preferência a terapias não hormonais.4
Se a TRH for selecionada, todas as diretrizes recomendam o uso da dose efetiva mais baixa.1,4,10 Um benefício de doses menores de TRH é o melhor perfil de efeito colateral em comparação com os regimes de altas doses.4 Atualmente, não há uma via preferencial de terapia para o tratamento da TEV; portanto, a via de administração deve ser guiada pela preferência do paciente. Deve-se observar que produtos transdérmicos podem estar associados a uma menor incidência de efeitos adversos, como TEV, mas estudos ainda estão sendo realizados.10
Para o tratamento de sintomas geniturinários em mulheres sem histórico de cânceres dependentes de hormônios, pode ser usado estrogênio vaginal de baixa dose.1 Apenas para sintomas vaginais, as diretrizes recomendam contra a adição de progestina, independentemente da presença do útero. Esta terapia também pode ser apropriada em pacientes com histórico de cancros dependentes de hormônio, mas nesses casos, a escolha da terapia deve ser baseada em um processo de decisão compartilhado que inclua a discussão dos riscos e benefícios. Os potenciais benefícios do estrogênio vaginal incluem a rápida melhora dos sintomas vaginais e urinários e a possível prevenção de infecções recorrentes do trato urinário. Terapias não estrogênicas aprovadas pela FDA e terapias de cordão-guia usadas para aliviar a dispareunia incluem ospemifeno e desidropiandrosterona intravaginal.16,17
Terapia somente de hidrogênio, testosterona, terapias alternativas não hormonais baseadas em plantas e hormônios bioidênticos compostos carecem de dados e geralmente não são recomendados.1,4 O NAMS afirma que os prescritores podem considerar a TSH composta em situações em que um paciente é incapaz de tolerar terapias aprovadas pela FDA.3 As opções de tratamento não-hormonal para sintomas vasomotores incluem inibidores seletivos de recaptação de serotonina e inibidores seletivos de recaptação de serotonina-norepinefrina, clonidina e gabapentina, e tratamento não-hormonal para sintomas vaginais incluem lubrificantes, agonistas-antagonistas estrogênicos e remédios fitoterápicos.4 As evidências que apoiam o uso de terapias não hormonais variam, e nem todas as opções têm evidências comprovadas ou uma indicação aprovada pela FDA.4
A monitorização da TSH deve incluir rastreios regulares do cancro da mama durante e após a conclusão da terapia. O sangramento recorrente não programado deve ser avaliado rapidamente.1 A duração da terapia deve ser revisada pelo menos anualmente, sendo preferível a duração mais curta do tratamento.1 Quando pacientes e provedores decidem descontinuar a TRH, pode ser usada uma estratégia de conicidade ou uma estratégia de descontinuação abrupta. Faltam evidências sobre os métodos de descontinuação; portanto, recomenda-se a tomada de decisões compartilhadas para o processo de descontinuação.1,4
Interações Drogas-Drogas
A maioria dos produtos de TSH comercialmente disponíveis (TABELA 1) sofre metabolismo hepático mediado pelo sistema CYP450.15 Especificamente, os produtos de estrogênio são parcialmente metabolizados pelo CYP3A4; portanto, fortes indutores de CYP3A4 podem reduzir a eficácia do estrogênio HRT e fortes inibidores podem aumentar as concentrações séricas de estrogênio. Além disso, outros substratos medicamentosos para essas enzimas podem interferir no metabolismo da TRH.15
Efeitos colaterais comuns e de gravidade
Os maiores efeitos colaterais associados à TRH incluem DVC, câncer de mama, câncer endometrial ou ovariano, acidente vascular cerebral e TEV.1 O uso de estrogênio sem oposição aumenta o risco de hiperplasia endometrial e câncer, daí a recomendação de adição de progestina em mulheres com útero. Quanto ao risco de câncer de mama, parece haver um pequeno risco de desenvolver câncer de mama quando uma mulher está em uso de estrogênio por 5 anos.3 A literatura atual é inconsistente quanto à determinação do risco de desenvolver câncer de ovário a partir da TRH.3 Estudos mais randomizados e controlados são necessários para determinar o verdadeiro risco de desenvolver câncer de ovário com uso de TRH.1 Os efeitos da TRH na doença arterial coronariana (DAC), acidente vascular cerebral e TEV variam dependendo da idade da mulher no momento do início ou desde o início da menopausa. Parece que as mulheres que tomam TSH por mais de 10 anos a partir do início da menopausa correm um risco maior de desenvolver TSH.3 Em geral, estudos sugerem que formulações orais e transdérmicas em doses mais baixas conferem um risco menor de derrame e TEV em comparação com as doses padrão de TSH.3 Pacientes com mais de 60 anos de idade quando iniciados na TSH ou com mais de 10 anos a partir do início da menopausa correm um risco maior para esses efeitos adversos. Além disso, mulheres que tomam TSH com estrogênio sozinhas ou em combinação estão em risco aumentado de litíase biliar, colecistite e colecistectomia.3 O risco de doença da vesícula biliar tem sido associado ao uso de TSH oral e pode não existir com formulações tópicas ou transdérmicas.1,3
Contraindicações
As diretrizes da sociedade profissional não especificaram uma lista de contra-indicações absolutas ou relativas à HRT.2 Portanto, como na maioria das tomadas de decisão clínica, é importante uma avaliação individualizada de risco-benefício. Em geral, a TRH deve ser evitada em pacientes com sangramento vaginal inexplicável; histórico de acidente vascular cerebral ou ataque isquêmico transitório; infarto do miocárdio; embolia pulmonar ou TEV; câncer de mama ou endometrial; doença hepática ativa; deficiência conhecida de proteína C, proteína S ou antitrombina ou outros distúrbios trombofílicos; e gravidez conhecida ou suspeita de gravidez.1 Além disso, deve-se ter cuidado em pacientes com diabetes, doença da vesícula biliar, hipertrigliceridemia (>400 mg/dia), hipoparatiroidismo, meningioma benigno, risco intermediário ou alto de câncer de mama, alto risco de doença cardíaca, ou enxaqueca com aura.2
Pontos de aconselhamento
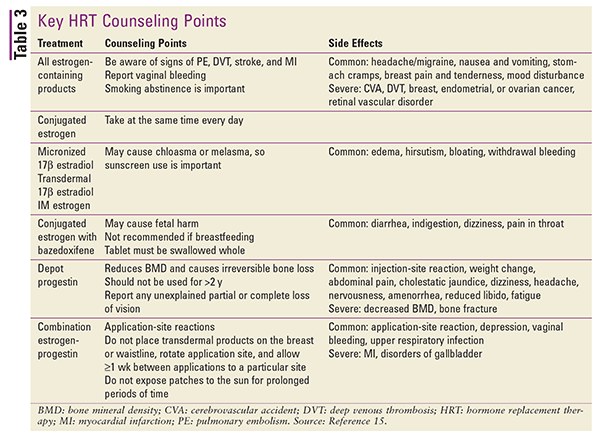
Refer à TABELA 3 para um resumo dos principais pontos de aconselhamento do paciente e efeitos colaterais para os vários tipos de TSH.15
Conclusão
RTH, que está disponível em uma ampla gama de preparações, é o tratamento mais eficaz tanto para os sintomas VMS quanto para os geniturinários. Como os riscos associados à TSH são diferentes para cada mulher, o tratamento deve ser individualizado e ter como objetivo maximizar a eficácia, minimizar a duração da terapia e reduzir o risco de efeitos adversos. Em cenários nos quais a TRH não é uma opção, existem opções de tratamento não hormonal tanto para a VMS quanto para os sintomas geniturinários, mas a eficácia e a aprovação desses produtos pela FDA variam; portanto, os dados de eficácia desses produtos devem ser revisados.
1. Stuenkel CA, Davis SR, Gompel A, et al. Tratamento dos sintomas da menopausa: uma Diretriz de Prática Clínica da Sociedade Endócrina. J Clin Endocrinol Metab. 2015;100(11):3975-4011.
2. Shifren JL, Schiff I. Papel da terapia hormonal no tratamento da menopausa. Obsteto Gynecol. 2010;115(4):839-855.
3. The NAMS 2017 Hormone Therapy Position Statement Advisory Panel. A declaração de posição da Terapia Hormonal de 2017 da Sociedade Norte-Americana de Menopausa. Menopausa. 2017;24(7):728-753.
4. ACOG Boletim Prático No. 141: gestão dos sintomas da menopausa. Obsteto Gynecol. 2014;123(1):202-216.
5. Thurston RC, Sutton-Tyrrell K, Everson-Rose SA, et al. Hot flashes and subclinical cardiovascular disease: findings from the Study of Women’s Health Across the Nation Heart Study. Circulação. 2008;118(12):1234-1240.
6. Thurston RC, Kuller LH, Edmundowicz D, Matthews KA. História de afrontamentos e calcificação da aorta em mulheres na pós-menopausa. Menopausa. 2010;17(2):256-261.
7. Thurston RC, Sutton-Tyrrell K, Everson-Rose SA, et al. Afrontamentos e espessura da íntima média carotídea entre as mulheres de meia idade. Menopausa. 2011;18(4):352-358.
8. Crandall CJ, Aragaki A, Cauley JA, et al. Associações de sintomas vasomotores da menopausa com incidência de fraturas. J Clin Endocrinol Metab. 2015;100(2):524-534.
9. Maki PM. Memória verbal e menopausa. Maturitas. 2015;82(3):288-290.
10. Sociedade Norte-Americana de Menopausa. A declaração de posição da terapia hormonal de 2012: A Sociedade Norte-Americana de Menopausa. Menopausa. 2012;19(3):257-271.
11. Palacios S, Silverman SL, de Villiers TJ, et al. Um ensaio aleatório de 7 anos, controlado por placebo, avaliando a eficácia a longo prazo e a segurança do bazedoxifeno em mulheres pós-menopausadas com osteoporose: efeitos na densidade óssea e na fractura. Menopausa. 2015;22(8):806-813.
12. Archer DF, Freeman EW, Komm BS, et al. Pooled analysis of the effects of conjugated estrogens/bazedoxifene on vasomotor symptoms in the selective estrogens, menopause, and response to therapy trials. J Saúde Feminina (Larchmt). 2016;25(11):1102-1111.
13. FDA. Orange book: produtos medicamentosos aprovados com avaliações de equivalência terapêutica. Detalhes do produto para ANDA 204726. www.accessdata.fda.gov/scripts/cder/ob/results_product.cfm?Appl_Type=A&Appl_No=204726. Acesso 18 de março de 2018.
14. FDA. Drogas@FDA: Produtos farmacêuticos aprovados pela FDA. www.accessdata.fda.gov/scripts/cder/daf/index.cfm. Acesso em 17 de junho de 2018.
15. DrugDex . Greenwood Village, CO: Truven Health Analytics, Inc. www.micromedexsolutions.com. Acesso a 15 de Junho de 2018.
16. Constantine G, Graham S, Portman DJ, et al. A função sexual feminina melhorou com ospemifeno em mulheres na pós-menopausa com atrofia vulvar e vaginal: resultados de um ensaio aleatório, controlado por placebo. Climatério. 2015;18(2):226-232.
17. Labrie F, Archer DF, Koltun W, et al. Eficácia da desidroepiandrosterona intravaginal (DHEA) na dispareunia moderada a grave e secura vaginal, sintomas de atrofia vulvovaginal, e da síndrome geniturinária da menopausa. Menopausa. 2016;23(3):243-256.