FörbränningEdit
Som de flesta andra kolväten kan omättade kolväten genomgå förbränningsreaktioner som ger upphov till koldioxid och vatten vid fullständig förbränning. Reaktionsekvationen är:
- CxHy + y+4x/4O2 → y/2H2O + xCO2
I avsaknad av syre kommer förbränningen att övergå till ofullständig förbränning och producera kolmonoxid och kol.
De omättade kolvätena kommer att producera ofullständig förbränningsprodukt lättare än mättade. Som ett resultat av detta har förbränningen av omättade kolväten vanligtvis en gul låga, som skiljer sig från den blå lågan hos de mättade kolvätena. Detta tyder på att förbränningen av omättade kolväten kommer att omfatta flerstegsmekanismer, och förbränningen av kol ger den gula flamfärgen.
Då omättade kolväten har mindre väteinnehåll kommer de att producera mindre vatten och minska flammans fuktighet, samt minska syreförbrukningen. Acetylen(etyn) kan till exempel användas som bränsle.

Vid jämförelse med de enskilda σ C-C-bindningarna i de mättade kolvätena har de omättade elektrondensiteten i π-bindningarna, som inte har så mycket elektrontäthet som överlappar som σ. Som ett resultat av detta är den kemiska energi som lagras i en dubbelbindning mindre än i två enkelbindningar. Vid förbränning av omättade kolväten, som bryter kol-kol-bindningarna för att frigöra energi, frigörs alltså mindre energi än vid förbränning av mättade kolväten med samma antal kolväten i samma moläritet. Denna tendens kan tydligt ses i listan över standardförbränningsenthalpier för kolväten.
| Antal kol | Substans | Typ | Formel | Hcø(kJ/mol) |
|---|---|---|---|---|
| 2 | etan | mättad | C2H6 | -1559.7 |
| etan | omättad | C2H4 | -1410.8 | |
| etan | omättad | C2H2 | -1300.8 | |
| 3 | propan | omättad | CH3CH2CH3 | -2219.2 |
| propen | omättad | CH3CH=CH2 | -2058.1 | |
| propyn | omättad | CH3C≡CH | -1938.7 | |
| 4 | butan | mättad | CH3CH3CH2CH2CH3 | -2876.5 |
| but-1-en | omättad | CH2=CH-CH2CH3 | -2716.8 | |
| but-1-yne | omättad | CH≡C-CH2CH3 | -2596.6 |
Elektrofil additionEdit
De dubbel- eller trippelbindningar som måste finnas i omättade kolväten ger hög elektrontäthet som gör att molekylerna blir perfekta platser för elektrofila additionsreaktioner. I denna typ av reaktion kommer en π-bindning mellan kolväten att brytas till två separata σ-bindningar mellan varje kol och den adderade gruppen. En karbokationsintermediär är vanligtvis involverad i mekanismen.
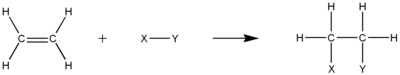
HydrogeneringRedigera
Hydrogenering är den elektrofila additionen av vätgas till omättade kolväten. Resultatet blir ett mer mättat kolväte, men blir inte nödvändigtvis ett mättat kolväte. Till exempel kan semihydrogenering av en alkin bilda en alken. Icke desto mindre måste det totala antalet π-bindningar minska i processen. π-kol-kolbindningen är också nödvändig för denna process.
Reaktionsekvationen för hydrering av eten till etan är:
- H2C=CH2 + H2→H3C-CH3
Hydreringsreaktionen kräver vanligen katalysatorer för att öka hastigheten.
Det totala antalet väte som kan tillsättas till ett omättat kolväte beror på dess grad av omättnad. Ett omättat kolväte med formeln CXHY kan få högst 2X+2-Y väteatomer tillsatta. Detta gör att molekylen blir mättad.
HalogeneringRedigera
Likt vätgas kommer heterolysen av halogen(X2) att ge upphov till en elektrofil X+-jon, varefter den attackeras av elektronen på π-bindningen. Till skillnad från väte kommer halogenering att producera haloniumjoner som intermediärer istället för karbocationer i de flesta andra fall. Haloniumkatjonen lämnar begränsat utrymme för X-jonen att angripa och kommer endast att omvandlas till en transprodukt. Nettoresultatet av halogenering är en minskning av en π-bindning och en ökning av två kol-halogen σ-bindningar på de två kolvätena.

Reaktionsekvationen för bromaddition av ethen är till exempel:
- H2C=CH2 + Br2→H2CBr-CH2Br (trans)
Bromtest används för att testa mättnaden av kolväten. Testet innebär att man tillsätter bromvatten till det okända kolvävet; om bromvattnet avkoloreras av kolvävet, vilket beror på en halogeniseringsreaktion, kan man då dra slutsatsen att kolvävet är omättat. Om det inte dekolouriseras är det mättat.
Bromtestet kan också användas som en indikation på graden av omättnad för omättade kolväten. Bromtal definieras som gram brom som kan reagera med 100 g produkt. I likhet med hydrogenering är halogeneringen av brom också beroende av antalet π-bindningar. Ett högre bromtal indikerar högre grad av omättnad.
HydreringRedigera
π-bindningen hos omättade kolväten är också redo att ta emot H+ och OH- från vatten. Reaktionen involverar vanligtvis stark syra som katalysator. Det beror på att det första steget i hydreringsmekanismen innebär att π-bindningen deprotonerar ett H+ från den starka syran för att bilda en karbokation. Nettoresultatet av reaktionen blir en alkohol.
Reaktionsekvationen för hydrering av eten är:
- H2C=CH2 + H2O→H3C-CH2OH
De π-bindningar som finns i trippelbindningar kan också genomgå hydrering i sura förhållanden och bilda enoler. Enolen blir dock inte en produkt utan en intermediär, och slutprodukten blir en keton. Enolintermediären går under tautomerisering och bildar den mer stabila ketonen.
Reaktionsekvationen för hydrering av etyn för att bilda acetaldehyd är:
- HC≡CH + H2O → H2C=CH-OH
- H2C=CH-OH ⇌ H3C-CHO
HydrohalogeneringRedigera
Huvudartikel: Hydrohalogenering
 Exempel på hydrohalogenering: addition av HBr till en alken
Exempel på hydrohalogenering: addition av HBr till en alken

Hydrohalogeneringen innebär att H-X adderas till omättade kolväten. Detta kommer att minska en π C=C-bindning och resultera i 2 C-H och C-X σ-bindningar med 2 separata kolväten. Bildandet av den intermediära karbokationen är selektivt och följer Markovnikovs regel. Hydrohalogenering av alken kommer att resultera i haloalkan, och hydrohalogenering av alken kommer att resultera i vinylhalogenid. Hydrohalogeneringen av alkan är mycket långsammare än alken.
Reaktionsekvationen för HBr addition till eten är:
- H2C=CH2 + HBr→H3C-CH2Br
OxidationEdit

Oxidation av omättade kolväten beror på styrkan hos oxidationsmedlet. Ett svagt oxidationsmedel leder till dihydroxylering, avlägsnande av en π-bindning för att bilda två σ-bindningar med syre. Dihydroxylering av alken ger diol, och dihydroxylering av alkan ger vicinal dikarbonyl.
Ett starkare oxidationsmedel, till exempel KMnO4 eller ozon, kommer att leda till oxidativ klyvning. I detta fall bryts π-bindningen med σ-bindningen, vilket delar kolvätemolekylen i två. Syre binder med de återstående två π-bindningarna separat. Oxidativ klyvning av alken ger ketoner eller aldehyder, beroende på platsen för dubbelbindningen, och klyvning av alkyner ger karboxylsyra.
Allylisk substitutionRedigera
Den π-bindning som finns i omättade kolväten kommer att sänka dissociationsenergin för de allyliska C-H-bindningarna, som är C-H-bindningar av kolet som är intill sp2-kolvätena. Som ett resultat av detta kommer den fria radikala substitutionsreaktionen att gynnas framför additionsreaktionerna.
Ett exempel på detta är NBS-bromineringsreaktionen med alken. N-Br-bindningen i NBS är svag så att mycket Br fri radikal kommer att bildas. Den fria radikalen kommer att angripa de försvagade allyliska väteämnena och ersätta dem med bromatomer. Reaktionsekvationen är:
- RCH2CH=CH2 + (CH2CO)2NBr → RCHBrCH=CH2 + RCH=CHCHCH2Br + (CH2CO)2N
Reaktionen ger upphov till två isomerer med brom som är knutna till olika kolväten. Reaktionen kräver en stor mängd Br fria radikaler istället för elektrofila Br+ joner, som kommer att gå under en additionsreaktion. NBS är nödvändigt för att skapa ett sådant tillstånd.
Om kolvätegrupper är knutna till allyliskt kol kommer detta kol att bli mer mättat. Enligt Zaitsevs regel kommer detta kol att bilda en stabilare karbokationsintermediat. Som ett resultat av detta kommer en allylisk omarrangemang att ske och π-bindningen kommer att flytta till detta kol. Detta kommer att ge en huvudprodukt med brom som är substituerat till kolet fyra bindningar bort från kolvätegruppen.
CycloadditionEdit

För omättade kolväten kan ringstruktur och π-bindningar båda öka graden av omättnad, utbyte mellan ringstruktur och π-bindningar kan förekomma under speciella förhållanden. Till exempel, för en konjugerad dien och en substituerad alken kommer Diels-Alder-reaktionen att inträffa som bildar en cyklohexen. En sådan reaktion är mycket selektiv i stereokemi.
Alkyner kan under metallkatalysatorer, till exempel kobolt, också genomgå en cycloadditionsreaktion som kallas alkintrimering. Tre alkyner går igenom en ”2+2+2” cykliseringsreaktion och förenas snabbt till en bensen. trimerisering av olika alkener är vanligtvis inte selektiv, men speciellt utformade katalysatorer kan öka selektiviteten.
Reagerar som ligandRedigera

Den delokaliserade π-bindningen i omättade kolväten ger en hög elektrontäthet, vilket gör det möjligt för molekylen att bli en metallligand. I alkenliganden kan bindningsstrukturen beskrivas med Dewar-Chatt-Duncanson-modellen. I detta fall doneras π-elektrontätheten till metallens d-orbitaler. Ju starkare donationen är, desto starkare är bakbindningen från metallens d-orbital till alkenens π*-antibindningsorbital. Denna effekt minskar alkenens bindningsordning och ökar C-C-bindningslängden. Som ett resultat bildar metallen en liten ringstruktur med de två kolvätena.
D DCD-modellen kan också beskriva alkenens ligandstruktur. Metallkomplex kan också vara intermediär för trimerisering av alkyner, så metaller kan vara katalysatorer för reaktionen.
Syntesen av alkenligandkomplex kan beskrivas som en elektrofil additionsreaktion.
Likt linjära omättade kolväten har arenerna också delokaliserade π-bindningar som kan donera till metaller för att bilda komplex. I fall som bensen donerar kolvätena lika mycket elektrondensitet till metallen, medan kolvätena i vissa andra fall donerar på olika sätt till metallen, vilket gör att arenen böjs eller dearomatiseras.