Låt oss först gå in på grunderna för flödescytometri
Vad är flödescytometri?
Flödecytometri är en teknik som används för att upptäcka och mäta fysiska och kemiska egenskaper hos en population av celler eller partiklar. I denna process suspenderas ett prov som innehåller celler eller partiklar i en vätska och injiceras i flödescytometerinstrumentet.
Vad är syftet med flödescytometri?
Flödecytometri ger en väletablerad metod för att identifiera celler i lösning och används oftast för att utvärdera perifert blod, benmärg och andra kroppsvätskor. Flödescytometriundersökningar används för att identifiera och kvantifiera immunceller och karaktärisera hematologiska maligniteter.1 De kan mäta:
- cellstorlek
- cellens granularitet
- total DNA
- ny syntetiserad
- DNA-genuttryck
- yta receptorer
- intracellulär. proteiner
- transient signal
Förmågan att utföra dessa mätningar på mycket kort tid är en av de viktigaste fördelarna med den flödescytometriska processen. De kan kvantifiera upp till tre till sex egenskaper eller komponenter kvantifieras i ett enda prov, cell för cell, för cirka 10 000 celler, på mindre än en minut.
Flödescytometriinstrumentering och metodik
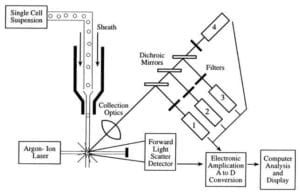 Flödescytometrar tar in en suspension av monodisperse enskilda, oklumpade celler och kör dem en i taget (single file) förbi en laserstråle där varje cell passerar genom laserstrålen, sprids och fluorescerar ljuset och räknas och sorteras eller karakteriseras ytterligare.
Flödescytometrar tar in en suspension av monodisperse enskilda, oklumpade celler och kör dem en i taget (single file) förbi en laserstråle där varje cell passerar genom laserstrålen, sprids och fluorescerar ljuset och räknas och sorteras eller karakteriseras ytterligare.
De tre huvudkomponenterna i en flödescytometer är fluidik, optik och elektronik.
- Flödessystemet i en flödescytometer ansvarar för att transportera proverna från provröret till flödescellen, förbi lasern, sorteras och/eller kasseras.
- Komponenterna i det optiska systemet innefattar exciteringsljuskällor, linser och optiska filter som används för att samla in och förflytta våglängder av ljuset runt instrumentet och detektionssystemet som genererar fotoströmmen. Skillnaden i våglängdsrespons i data hjälper till att analysera celltyp.
- Elektroniken eller flödescytometerns instrumentering.
En av huvudprinciperna för att använda flödescytometri är förmågan att analysera hela cellcykeln och analysera DNA-innehållet i olika faser. Övervakning av de naturliga händelserna i cellcykeln kan ge information för sjukdomsdiagnostik och terapiprognos. De olika faserna i cellcykeln kan avslöja förändrat DNA-innehåll och andra anomalier som indikerar tumörförekomst eller tecken på avancerad celldöd. Datauttrycken lagras i en dator via specialiserad flödescytometriprogramvara som är kopplad till vald instrumentanvändning under analystillfället. Flödescytometridata rapporteras vanligtvis på två olika sätt: ett histogram och/eller en punktdiagram2.
| G1 fas: | RNA, ribosomer och proteiner syntetiseras |
| S fas: | DNA replikeras |
| G2 fas: | Representerar fasen mellan DNA-syntes och mitos |
| M-fasen: | Cellerna delas upp i två dotterceller |
FACS
Fluorescens-aktiverad cellsortering (FACS) är en specialiserad typ av flödescytometri. Det är en metod för att sortera en heterogen blandning av biologiska celler i två eller flera behållare, en cell i taget, baserat på varje cells specifika egenskaper när det gäller ljusspridning och fluorescens. Den skiljer sig från flödescytometri genom att den ger en unik karakterisering i stället för att bara räkna och sortera celler. Det är vanligt att de två principerna arbetar i en process av typen samkarakterisering för att erbjuda en fullständig kvalitativ och kvantitativ metod för flödescytometrisk analys.
Den flödescytometriska processen:
Cellsuspensionen dras med i mitten av en smal, snabbt strömmande vätskeström. Flödet är arrangerat så att det finns en stor separation mellan cellerna i förhållande till deras diameter. En vibrerande mekanism tvingar cellströmmen att dela sig i enskilda droppar. Systemet är inställt så att sannolikheten för att det finns mer än en cell per droppe är låg. Strax innan strömmen bryts i droppar passerar flödet genom en fluorescensmätningsstation där den intressanta fluorescerande karaktären hos varje cell mäts.
En elektrisk laddningsring placeras precis vid den punkt där strömmen bryts i droppar. En laddning placeras på ringen baserat på den omedelbart föregående mätningen av fluorescensintensiteten, och den motsatta laddningen fångas på droppen när den bryts från strömmen. De laddade dropparna faller sedan genom ett elektrostatiskt avledningssystem som avleder dropparna till behållare baserat på deras laddning. I vissa system appliceras laddningen direkt på strömmen och den droppe som bryts av behåller en laddning med samma tecken som strömmen. Strömmen återgår sedan till neutralitet efter det att droppen bryts av.
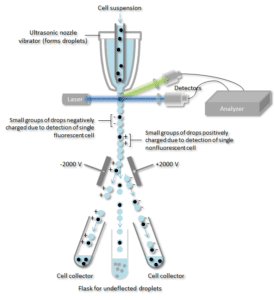
En antikropp som är specifik för ett visst cellytprotein associeras med en fluorescerande molekyl och tillsätts sedan till en blandning av celler. Nästa steg är processen med fluorescens, medan specifika celler passerar genom en laserstråle de övervakas. Droppar som innehåller en enskild cell tilldelas en positiv eller negativ laddning, beroende på om cellen har en fluorescensmärkt antikropp. Droppar som innehåller en enskild cell upptäcks sedan av ett elektriskt fält och leds in i separata uppsamlingsrör beroende på deras laddning, vilket gör det lätt att separera de celler som är märkta med den fluorescerande antikroppen.
Multicolor flödescytometri
Multicolor flödescytometri är en användbar teknik när man undersöker blandade populationer av celler, t.ex. blod- och vävnadsceller i prover från människor och djur. I allmänhet markeras en specifik celltyp med fluorescerande färgämne (markörer) som t.ex. fluorofor eller propidiumjodid. Möjligheten att använda flera fluorescerande markörer samtidigt gör det möjligt att identifiera flera celltyper samt funktionella markörer som ytterligare karakteriserar varje prov. Det finns specialiserade instrument som kan mäta 12-plus färger 3,4 . Dessa fluorescerande färgämnen och markörer mäts med hjälp av olika våglängder av ljus som sänds ut från lasern för att sortera efter individuell celltyp. Varje markör exciteras vid en specifik våglängd i ljuset för att differentiera dem när man använder flera markörer.
Att anpassa en typisk färgningspanel från 4 till 6 färger till mer än 12 färger är inte bara en fråga om ”plug and play”, utan måste angripas på ett systematiskt sätt för att uppnå framgångsrika parametrar i en färgningspanel. De grundläggande principerna för panelens utformning fungerar bäst om man utgår från forskning före användning. Med andra ord är det viktigt att förbereda sig redan från början när man hänvisar till färgningsindexet för att effektivt matcha fluorokromer efter ljusstyrka5.
Flödescytometritips:
Insätt lite tid för att förstå flödescytometerns subtila nyanser innan du utformar din primära antikroppspanel. Fokusera på var de känsligaste mätningarna kan göras på systemet. Det finns mer än bara fluorescerande intensitet.
Överväg att byta ut mot ett mindre ljusstarkt fluorokrom för att undvika kanalfel.
Gemensamma tillämpningar av flödescytometrimetodik
Flödescytometri är en integrerad komponent inom flera kliniska områden, inklusive diagnos, behandlingsplaner och systemiska sjukdomar oavsett om de är statiska eller progressiva. I takt med att vi lär oss mer om de praktiska tillämpningarna för användning av flödescytometri utökas kunskapsbasen ytterligare. Nu, mer än någonsin tidigare, är forskarna mycket entusiastiska över att kunna lära sig mer om komplexiteten i vissa sjukdomar och tillstånd. Det har lett till en snabb förändring av diagnostikmönster och drastiskt förändrade medicinska metoder för att behandla sjukdomar som cancer6.
Flödescytometrimetodik är ofta involverad med andra omfattande testmönster såsom morfologisk undersökning. I många fall uppvisar hematologiska neoplasmer specifika morfologiska förändringar, och flödescytometri ger större specificitet och hjälper patologer att expandera på vävnadsanomalier eller annan avancerad sjukdom. Flödescytometri kan i vissa fall förutbestämma återfall i cancer innan morfologiska förändringar upptäcks7.
Några av de viktigaste tillämpningar som används inom ramen för moderna kliniska miljöer, både terapeutiska och forskningsinriktade, är bl.a. följande:
- Proteinuttryck – genom hela cellen, till och med i kärnan
- Proteinmodifieringar efter translation – inkluderar klyvda och fosforylerade proteiner
- RNA – inkluderar både miRNA, och mRNA-transkript
- Cellhälsostatus – detektion av apoptotiska celler eller celldöd
- Cellcykelstatus – ett kraftfullt verktyg för att bedöma celler i G0/G1-fas jämfört med S-fas, G2 eller polyploidi, inklusive analys av cellproliferation och aktivering
- Identifiering och karakterisering av distinkta delmängder av celler i ett heterogent prov – inklusive särskiljande av centrala effektorminnesceller från uttömda T-celler eller regulatoriska T-celler
Avsluta
Flödescytometrins grundprinciper har förändrats lite under det senaste decenniet, men tillämpningarna av denna teknik har utvecklats mycket. Grunderna för flödescytometri har varit förenliga med dess primära funktion, som är att förhöra enskilda celler eller partiklar i ett flöde med en laser när cellerna rör sig förbi en uppsättning stationära detektorer. Allt fler färger av fluorescens upptäcks av cytometrar, tillsammans med höghastighetssortering och analysfunktion8.
Flödecytometri spelar en viktig roll i molekylärvetenskaplig forskning och fortsätter att utvecklas i snabb takt. Det finns flera kommersiella flödescytometrar på marknaden. De tenderar att fungera enligt samma grundprincip, men det finns viktiga skillnader i deras utformning och koncept för inriktning och integrering av andra komponenter.
Snart kommer ett 3D-instrument att introduceras och införlivas i ett hybridinstrument som tillverkas av NanoCellect Biomedical, WOLF Cell Sorter. Vi kan också se fram emot utvecklingen av fluorescerande prober med smalt spektrum, integrationen av molekylärbiologiska tekniker med flödescytometri och utvärderingen av cellfria markörer, t.ex. cytokiner, kommer att vara nyckelkomponenter i den fortsatta utvecklingen av flödescytometrianalysen och tekniken för cellanalyser.
Källor:
1 http://clinchem.aaccjnls.org/content/46/8/1221
2 https://pubmed.ncbi.nlm.nih.gov/18615596-flow-cytometry-histograms-transformations-resolution-and-display/
3 https://onlinelibrary.wiley.com/doi/full/10.1002/cyto.a.20959
4 https://currentprotocols.onlinelibrary.wiley.com/doi/abs/10.1002/cpim.26
5 https://www.nature.com/articles/nprot.2006.250
6 https://pubmed.ncbi.nlm.nih.gov/19967915-immunophenotypic-analysis-of-bone-marrow-b-lymphocyte-precursors-hematogones-by-flow-cytometry/
7 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4803461/
8 https://link.springer.com/protocol/10.1385/0-89603-150-0:543